2020届一轮复习人教版弱电解质的电离平衡作业
弱电解质的电离平衡
基础题组
1.下列事实一定能证明HNO2是弱电解质的是( )
①常温下NaNO2溶液pH大于7
②用HNO2溶液做导电实验,灯泡很暗
③HNO2和NaCl不能发生反应
④常温下0.1 mol·L-1 HNO2溶液的pH=2.1
⑤NaNO2和H3PO4反应,生成HNO2
⑥常温下将pH=1的HNO2溶液稀释至原体积的100倍,溶液pH约为2.8
A.①④⑥
B.①②③④
C.①④⑤⑥
D.全部
2.近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是 ( )
A.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以
B.氢硫酸的导电能力低于相同浓度的亚硫酸
C.0.10 mol·L-1的氢硫酸和亚硫酸的pH分别为4.5和2.1
D.氢硫酸的还原性强于亚硫酸
3.常温下1 mol·L-1的氨水加水稀释时,下列选项中随着加水量的增加而减小的是( )
A.c(OH-)
B.NH3·H2O电离程度
C.n(H+)
D.KW
4.室温下,关于pH=1的醋酸溶液,下列说法正确的是( )
A.溶液中c(H+)比pH=1的盐酸小
B.1 L该醋酸溶液与足量的Fe粉完全反应,生成0.05 mol H2
C.若将10 mL该醋酸溶液加水稀释至100 mL,溶液 pH=2
D.与0.1 mol/L的NaOH溶液完全反应所需溶液体积:V(NaOH溶液)>V(醋酸溶液)
5.常温下0.1 mol·L-1醋酸溶液的pH=a,下列措施能使溶液pH=(a+1)的是( )
A.将溶液稀释到原体积的10倍
B.加入适量的醋酸钠固体
C.加入等体积0.2 mol·L-1盐酸
D.升高溶液的温度
6.室温下,向0.01 mol·L-1的醋酸溶液中滴入pH=7的醋酸铵溶液,溶液pH随滴入醋酸铵溶液体积变化的曲线示意图如下图所示。下列分析正确的是( )
A.a点,pH=2
B.b点,c(CH3COO-)>c(NH4+)
C.c点,pH可能大于7
D.ac段,溶液pH增大是CH3COOH H++CH3COO-逆向移动的结果
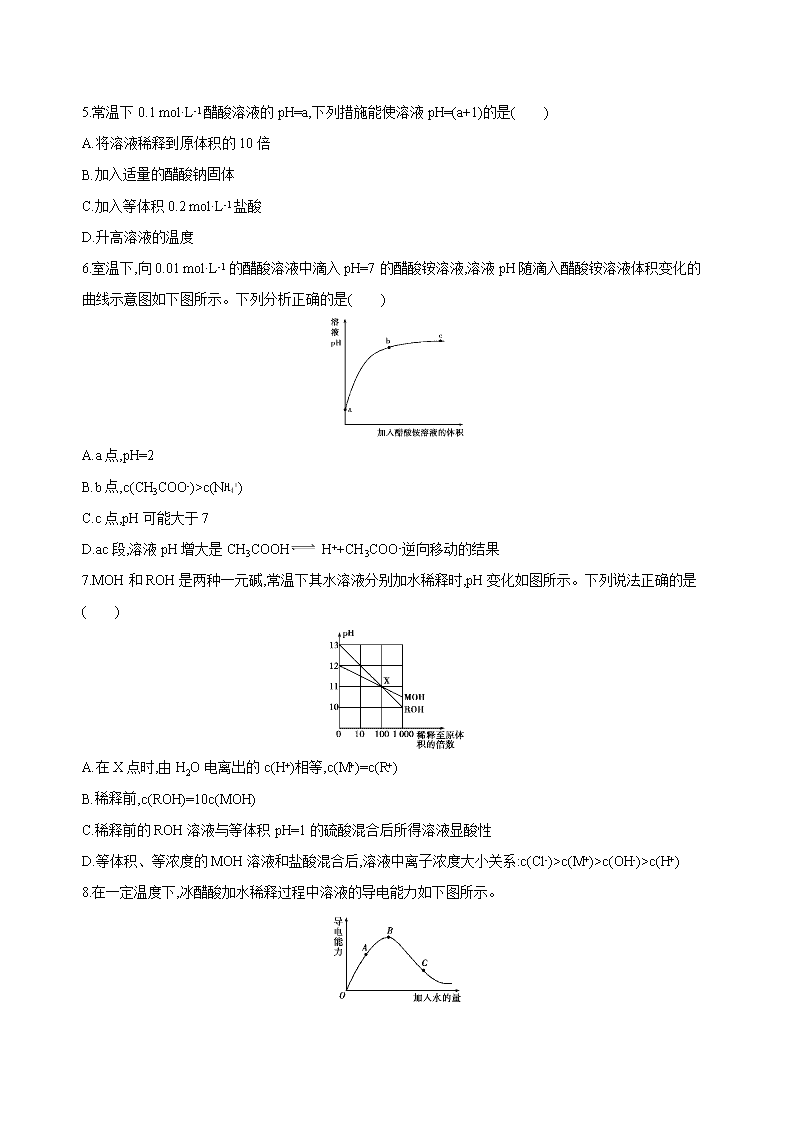
7.MOH和ROH是两种一元碱,常温下其水溶液分别加水稀释时,pH变化如图所示。下列说法正确的是( )
A.在X点时,由H2O电离出的c(H+)相等,c(M+)=c(R+)
B.稀释前,c(ROH)=10c(MOH)
C.稀释前的ROH溶液与等体积pH=1的硫酸混合后所得溶液显酸性
D.等体积、等浓度的MOH溶液和盐酸混合后,溶液中离子浓度大小关系:c(Cl-)>c(M+)>c(OH-)>c(H+)
8.在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如下图所示。
(1)“O”点导电能力为0的原因是 。
(2)A、B、C三点溶液中c(H+)由小到大的顺序是 。
(3)A、B、C三点溶液中醋酸的电离程度最大的是 。
(4)若使C点溶液中c(CH3COO-)增大,而c(H+)减小,可采取的措施主要有:① ;② ;③ 。
9.部分弱酸的电离常数如下表:
弱酸
HCOOH
HCN
H2CO3
电离常数
(25 ℃)
K=1.77×10-4
K=4.9×10-10
K1=4.3×10-7
K2=5.6×10-11
(1)依据表格中三种酸的电离常数,判断三种酸酸性由强到弱的顺序为 。
(2)向NaCN溶液中通入CO2气体能否制得HCN?若能,写出反应的化学方程式: 。
(3)同浓度的HCOO-、HC、C、CN-结合H+的能力由强到弱的顺序是 。
(4)①升高0.1 mol/L HCOOH溶液的温度,HCOOH的电离程度 (填“增大”“减小”或“不变”,下同)。
②加水稀释, 。
(5)pH=4的HCOOH溶液和pH=4的NH4Cl溶液中,水的电离程度相同吗? 。
(6)试用两种最常用的方法判断常温下HCOOH是一种弱酸。
提升题组
10.常温下,有下列四种溶液,下列说法正确的是( )
①
②
③
④
0.1 mol·L-1NaOH溶液
pH=11的
NaOH溶液
0.1 mol·L-1
CH3COOH溶液
pH=3的
CH3COOH溶液
A.②与④混合,若溶液显酸性,则所得溶液中离子浓度可能为:c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
B.由水电离出的c(OH-):①>③
C.③稀释到原来的100倍后,pH与④相同
D.①与③混合,若溶液pH=7,则V(NaOH溶液)>V(CH3COOH溶液)
11.常温下10 mL浓度均为0.1 mol·L-1的HX和HY两种一元酸的溶液加水稀释过程中的pH随溶液体积变化曲线如图所示。则下列说法不正确的是( )
A.电离常数:K(HX)
c(Y-)>c(X-)>c(OH-)>c(H+)
D.a点水的电离程度大于b点水的电离程度
12.等体积、浓度均为0.2 mol·L-1的三种溶液:①HA溶液、②HB溶液、③NaHCO3溶液,已知将①、②分别与③混合,实验测得所产生的CO2气体体积(V)随时间(t)的变化如图所示。下列说法不正确的是( )
A.酸性:HB>HA>H2CO3
B.反应结束后所得两溶液中:c(A-)>c(B-)
C.上述三种溶液中由水电离的c(OH-)相对大小:NaHCO3>HA>HB
D.HA溶液和NaHCO3溶液混合所得的溶液中:c(A-)+c(HA)=0.1 mol·L-1
13. 25 ℃时,用0.100 0 mol/L BOH溶液滴定20 mL 0.100 0 mol/L一元酸HA的溶液,其滴定曲线如图所示。下列说法正确的是 ( )
A.HA的电离平衡常数Ka为1×10-14
B.滴定时应选择甲基橙作指示剂
C.当滴入BOH溶液20 mL时,溶液中:c(B+)=c(A-)>c(OH-)=c(H+)
D.当滴入BOH溶液10 mL时,溶液中:c(A-)> c(B+)>c(H+)> c(OH-)
14.砷(As)是一些工厂和矿山废水中的污染元素,使用吸附剂是去除水中砷的有效措施之一。
(1)将硫酸锰、硝酸钇与氢氧化钠溶液按一定比例混合,搅拌使其充分反应,可获得一种砷的高效吸附剂X,吸附剂X中含有C,其原因是 。
(2)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图1和图2所示。
图1
图2
①以酚酞为指示剂(变色范围pH 8.0~10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为 。
②H3AsO4第一步电离方程式H3AsO4 H2As+H+的电离常数为,则p= (p=-lg )。
(3)溶液的pH对吸附剂X表面所带电荷有影响。pH=7.1时,吸附剂X表面不带电荷;pH>7.1时带负电荷,pH越高,表面所带负电荷越多;pH<7.1时带正电荷,pH越低,表面所带正电荷越多。pH不同时吸附剂X对三价砷和五价砷的平衡吸附量(吸附达平衡时单位质量吸附剂X吸附砷的质量)如图3所示。
图3
①在pH 7~9之间,吸附剂X对五价砷的平衡吸附量随pH升高而迅速下降,其原因是 。
②在pH 4~7之间,吸附剂X对水中三价砷的去除能力远比五价砷的弱,这是因为 。提高吸附剂X对三价砷去除效果可采取的措施是 。
答案精解精析
基础题组
1.C ①常温下NaNO2溶液pH大于7,说明亚硝酸钠是强碱弱酸盐,则HNO2是弱电解质,故①正确;②溶液的导电性与离子浓度及离子所带电荷数有关,用HNO2溶液做导电实验,灯泡很暗,不能证明HNO2为弱电解质,故②错误;③HNO2和NaCl不能发生反应,只能说明不符合复分解反应发生的条件,但不能说明HNO2是弱电解质,故③错误;④常温下0.1 mol·L-1 HNO2溶液的pH=2.1,说明HNO2不能完全电离,可说明HNO2为弱电解质,故④正确;⑤较强酸可以制取较弱酸,NaNO2和H3PO4反应,生成HNO2,说明HNO2
的酸性弱于H3PO4,则HNO2为弱电解质,故⑤正确;⑥常温下将pH=1的HNO2溶液稀释至原体积的100倍,溶液pH约为2.8,说明HNO2为弱电解质,故⑥正确。
2.D 两种酸的还原性与酸性的相对强弱无关。
3.A A项,氨水加水稀释,促进NH3·H2O的电离,但c(OH-)仍减小,溶液碱性减弱,正确;B项,随着加水量的增加,NH3·H2O电离程度增大,错误;C项,因加水稀释时,溶液碱性减弱,溶液中c(OH-)减小,温度不变,则c(H+)和c(OH-)的乘积不变,所以c(H+)增大,由于溶液体积也增大,所以n(H+)增大,错误;D项,温度不变,则c(H+)和c(OH-)的乘积不变,KW不变,错误。
4.D A项,pH=1的醋酸溶液中的c(H+)与pH=1的盐酸中c(H+)相等,错误;B项,醋酸是弱电解质,随反应进行,H+被消耗,促使醋酸电离出H+,生成的H2的物质的量大于0.05 mol,错误;C项,10 mL该醋酸溶液加水稀释至100 mL,醋酸电离程度增大,溶液pH<2,错误;D项,pH=1的醋酸溶液中c(CH3COOH)>0.1 mol/L,则与0.1 mol/L NaOH溶液完全反应时,V(NaOH溶液)>V(醋酸溶液),正确。
5.B A项,将溶液稀释到原体积的10倍,如果是强酸溶液则pH正好是a+1,但醋酸是弱酸,稀释后其溶液pH小于a+1;B项,加入醋酸钠固体,醋酸根离子浓度增大,使醋酸的电离平衡左移,氢离子浓度减小,pH可能变为a+1;C项,加入0.2 mol·L-1盐酸,pH减小;D项,升高温度,促进醋酸的电离,pH减小。
6.B A项,醋酸是弱酸,0.01 mol·L-1的醋酸溶液的pH>2。B项,b点为醋酸和醋酸铵的混合溶液,溶液显酸性,结合电荷守恒可知,c(CH3COO-)>c(NH4=)。C项,酸性溶液和中性溶液混合,不可能得到碱性溶液。D项,若所加CH3COONH4溶液的浓度很大,则溶液pH增大是CH3COOH H++CH3COO-逆向移动的结果;若所加CH3COONH4溶液的浓度很小,则相当于稀释,c(H+)减小,所以溶液pH增大。
7.A 在X点时,由H2O电离出的c(H+)相等,c(OH-)相等,则c(M+) =c(R+),A正确;由图像可知,两种碱的电离程度不同,MOH为弱碱,ROH为强碱,故c(ROH)<10c(MOH),B错误;稀释前的ROH溶液与等体积pH=1的硫酸混合后,由于ROH为强碱,则完全中和,所得溶液显中性,C错误;等体积、等浓度的MOH溶液和盐酸混合后,完全反应生成的MCl为强酸弱碱盐,则有c(Cl-)>c(M+)>c(H+)>c(OH-),D错误。
8.答案 (1)在“O”点处CH3COOH未电离,无离子存在
(2)CH2CO3>HCN
(2)能;NaCN+H2O+CO2 HCN+NaHCO3
(3)C>CN->HC>HCOO-
(4)①增大 ②增大
(5)不相同
(6)方法Ⅰ:配制0.01 mol/L的HCOOH溶液,测其pH,若pH>2,则证明HCOOH为弱酸;
方法Ⅱ:配制少量HCOONa溶液,测其pH,若pH>7,则证明HCOOH为弱酸。
提升题组
10.A B项,0.1 mol·L-1 NaOH溶液中,由水电离出的c(OH-)为10-13 mol·L-1,0.1 mol·L-1 CH3COOH溶液中,c(H+)<0.1 mol·L-1,则由水电离出的c(OH-)大于10-13 mol·L-1,所以由水电离出的c(OH-):①<③,错误;C项,0.1 mol·L-1 CH3COOH溶液稀释至原来的100倍,浓度变为0.001 mol·L-1,则pH>3,错误;D项,①与③等体积混合时,溶液pH>7,若溶液的pH=7,则V(CH3COOH溶液)>V(NaOH溶液),错误。
11.D 10 mL浓度均为0.1 mol·L-1的HX和HY两种一元酸的溶液,HY溶液的pH小于HX溶液,说明HY溶液中氢离子浓度大于相同浓度的HX溶液中的氢离子浓度,则HY的酸性强于HX,故电离常数:K(HX)c(X-),则溶液中离子浓度大小关系为c(Na+)>c(Y-)>c(X-)>c(OH-)>c(H+),C正确;a、b两点溶液中氢离子浓度相同,对水电离的抑制程度相同,故两点水的电离程度相同,D错误。
12.B 由题图可知,HB溶液与NaHCO3溶液反应的速率快,说明HB的酸性强于HA的酸性,A项对;反应结束后,恰好生成NaA、NaB,根据“越弱越水解”知B项错;HC水解能促进水的电离,HA、HB抑制水的电离,C项对;由物料守恒知D项对。
13.D 0.100 0 mol/L HA溶液的pH=2,Ka=10-3,A错误;当酸、碱恰好完全反应时,溶液呈碱性,不在甲基橙的变色范围内,故B错误;当滴入BOH溶液20 mL时,溶液呈碱性,故C错误。
14.答案 (1)碱性溶液吸收了空气中的CO2
(2)①OH-+H3AsO3 H2As+H2O ②2.2
(3)①在pH 7~9之间,随pH升高H2As转变为HAs,吸附剂X表面所带负电荷增多,静电斥力增加
②在pH 4~7之间,吸附剂X表面带正电,五价砷主要以H2As和HAs阴离子存在,静电引力较大;而三价砷主要以H3AsO3分子存在,与吸附剂X表面产生的静电引力小 加入氧化剂,将三价砷转化为五价砷
解析 (1)碱性溶液易吸收空气中的CO2,CO2与碱发生反应CO2+2OH- C+H2O,故吸附剂X中含有C。
(2)①观察图1知,在pH为8~10之间,H3AsO3的分布分数逐渐减小,H2As的分布分数逐渐增大,故该过程中,NaOH与H3AsO3反应生成NaH2AsO3和水,离子方程式为OH-+H3AsO3 H2As+H2O。
②由H3AsO4的第一步电离方程式知,=,观察图2知,当pH=2.2,即c(H+)=10-2.2mol/L时,H3AsO4的分布分数和H2As的分布分数相等,即=10-2.2,故p=-lg =-lg 10-2.2=2.2。