- 2021-07-08 发布 |
- 37.5 KB |
- 12页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020高考化学冲刺核心素养微专题8化学反应原理综合题解题策略练习含解析
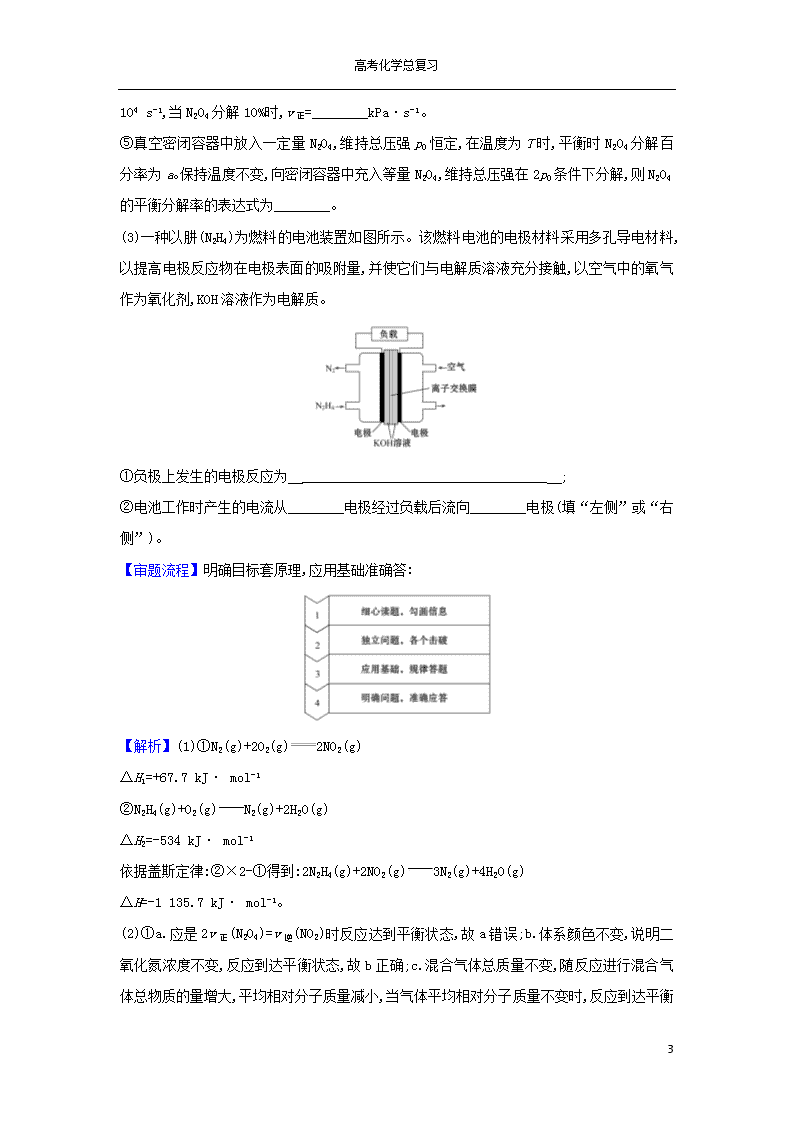
高考化学总复习 化学反应原理综合题解题策略 1.审题步骤 (1)步骤1:浏览全题,明确已知和所求,挖掘解题切入点。 (2)步骤2:①对于化学反应速率和化学平衡图象类试题,读懂图象,明确纵横坐标的含义,理解起点、终点、拐点的意义,分析曲线的变化趋势。 ②对于图表数据类试题,分析数据,研究数据间的内在联系,找出数据的变化规律,挖掘数据的隐含意义。 ③对于电化学类试题,首先判断是原电池还是电解池,然后分析电极类别,书写电极反应式,按电极反应式进行相关计算。 ④对于电解质溶液类试题,要明确溶液中的物质类型及其可能存在的平衡类型,然后进行解答。 (3)步骤3:针对题目中所设计的问题,联系相关理论进行逐个作答。 2.答题模板 【典例】 2019年10月1日,中华人民共和国成立70周年阅兵中,由7个型号导弹方队组成的战略打击模块驶过天安门,东风-41导弹方队行进在地面受阅方队的最后。东风-41弹道导弹是中国研发的第四代战略导弹,也是最新的一代。导弹的推进剂分液体推进剂与固体推进剂,东风-41弹道导弹采用最新的固体推进剂。 12 高考化学总复习 (1)液体推进剂主要含有液态肼(N2H4)。已知 ①N2(g)+2O2(g)2NO2(g) ΔH=+67.7 kJ· mol-1, ②N2H4(g)+O2(g)N2(g)+2H2O(g) ΔH=-534 kJ· mol-1, 则肼与NO2完全反应的热化学方程式为 。 (2)无色气体N2O4是一种强氧化剂,为重要的火箭推进剂之一,N2O4与NO2转换的热化学方程式为N2O4(g)2NO2(g) ΔH=+24.4 kJ· mol-1 ①将一定量N2O4投入固定容积的真空容器中,下述现象能说明反应达到平衡的是________。 a.v正(N2O4)=2v逆(NO2) b.体系颜色不变 c.气体平均相对分子质量不变 d.气体密度不变 达到平衡后,保持体积不变升高温度,再次到达平衡时,则混合气体颜色________(填“变深”“变浅”或“不变”),判断理由 __________。 ②平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数(例如:p(NO2)=p总×x(NO2)。写出上述反应平衡常数Kp表达式________(用p总、各气体物质的量分数x表示)。 ③在一恒温恒容的容器中,发生反应N2O4(g)2NO2(g),下列图象正确的是________。 ④上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中 k正、k逆为速率常数,则Kp为________(以k正、k逆表示)。若将一定量N2O4投入真空容器中恒温恒压分解(温度298 K、压强100 kPa),已知该条件下k正=4.8× 12 高考化学总复习 104 s-1,当N2O4分解10%时,v正=________kPa·s-1。 ⑤真空密闭容器中放入一定量N2O4,维持总压强p0恒定,在温度为T时,平衡时N2O4分解百分率为a。保持温度不变,向密闭容器中充入等量N2O4,维持总压强在2p0条件下分解,则N2O4的平衡分解率的表达式为________。 (3)一种以肼(N2H4)为燃料的电池装置如图所示。该燃料电池的电极材料采用多孔导电材料,以提高电极反应物在电极表面的吸附量,并使它们与电解质溶液充分接触,以空气中的氧气作为氧化剂,KOH溶液作为电解质。 ①负极上发生的电极反应为 ___________________________________ ; ②电池工作时产生的电流从________电极经过负载后流向________电极(填“左侧”或“右侧”)。 【审题流程】明确目标套原理,应用基础准确答: 【解析】(1)①N2(g)+2O2(g)2NO2(g) ΔH1=+67.7 kJ· mol-1 ②N2H4(g)+O2(g)N2(g)+2H2O(g) ΔH2=-534 kJ· mol-1 依据盖斯定律:②×2-①得到:2N2H4(g)+2NO2(g)3N2(g)+4H2O(g) ΔH=-1 135.7 kJ· mol-1。 (2)①a.应是2v正(N2O4)=v逆(NO2 12 高考化学总复习 )时反应达到平衡状态,故a错误;b.体系颜色不变,说明二氧化氮浓度不变,反应到达平衡状态,故b正确;c.混合气体总质量不变,随反应进行混合气体总物质的量增大,平均相对分子质量减小,当气体平均相对分子质量不变时,反应到达平衡状态,故c正确;d.混合气体的总质量不变,容器的容积不变,气体密度始终不变,故d错误,正反应是吸热反应,其他条件不变,温度升高平衡正向移动,c(NO2)增加,颜色加深。 ②由题目信息可知,用某组分(B)的平衡压强(PB)表示平衡常数为生成物分压的系数次幂乘积与反应物分压系数次幂乘积的比, N2O4(g)2NO2(g)的平衡常数Kp==。 ③A.平衡常数只与温度有关,温度不变,平衡常数不变,图象不符合,故A错误;B.N2O4的物质的量越大,压强越大,正反应方向进行的程度越小,N2O4的转化率越小,图象符合,故B正确;C.NO2的物质的量越大,压强越大,逆反应方向进行的程度越大,则NO2的百分含量越小,图象不符合,故C错误;D.ΔH与反应方程式中化学计量数成正比,ΔH不随NO2的物质的量的变化而变化,故D错误。 ④平衡时正逆反应速率相等,由v正=k正·p(N2O4),v逆=k逆·p2(NO2),联立可得Kp=,当N2O4分解10%时,设投入的N2O4为1 mol,转化的N2O4为0.1 mol,则: N2O4(g)2NO2(g) 物质的量增大Δn 1 2-1=1 0.1 mol 0.1 mol 故此时p(N2O4)=×100 kPa=×100 kPa,则v正=4.8×104 s-1××100 kPa≈3.9×106 kPa·s-1。 ⑤在温度为T时,平衡时N2O4分解百分率为a,设投入的N2O4为1 mol,转化的N2O4为a mol,则: N2O4(g)2NO2(g) 起始量(mol): 1 0 变化量(mol): a 2a 平衡量(mol): 1-a 2a 故w(N2O4)=,w(NO2)=, 12 高考化学总复习 则平衡常数Kp===p0× 保持温度不变,平衡常数不变,令N2O4的平衡分解率为y,则: p0×=2p0×,解得y=。 (3)①通入燃料的电极为负极,负极上燃料失电子发生氧化反应,电极反应式为N2H4+4OH--4e-N2+4H2O。②原电池工作时,电流由正极经导线流向负极,则由右侧流向左侧。 答案:(1)2N2H4(g)+2NO2(g)3N2(g)+4H2O(g) ΔH=-1 135.7 kJ· mol-1 (2)①bc 变深 正反应是吸热反应,其他条件不变,温度升高平衡正向移动,c(NO2)增加,颜色加深 ② ③B ④ 3.9×106 ⑤ (3)①N2H4+4OH--4e-N2+4H2O ②右侧 左侧 Ⅰ.据报道,我国在南海北部神狐海域进行的可燃冰(甲烷的水合物)试采获得成功。甲烷是一种重要的化工原料。 (1)甲烷重整是提高甲烷利用率的重要方式,除部分氧化外还有以下两种: 水蒸气重整:CH4(g)+H2O(g)CO(g)+3H2(g) ΔH1=+205.9 kJ·mol-1 ① CO(g)+H2O(g)CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1 ② 二氧化碳重整:CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH3 ③ 则反应①自发进行的条件是____________________,ΔH3=____________kJ·mol-1。 Ⅱ.氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g)2NH3(g)。 (2)在不同温度、压强和相同催化剂条件下,初始N2、H2 分别为0.1 mol、0.3 mol时, 12 高考化学总复习 平衡后混合物中氨的体积分数(φ)如图所示。 ①其中,p1、p2 和p3 由大到小的顺序是____________,其原因是____________________________ 。 ②若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)________vB(N2)(填“>”“<”或“=”)。 ③若在250 ℃、p1 为105 Pa条件下,反应达到平衡时容器的体积为1 L,则该条件下B点N2 的分压p(N2)为 Pa (分压=总压×物质的量分数,保留一位小数)。 Ⅲ.以连二硫酸根(S2)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示: (3)①阴极区的电极反应式为 ______________________________。 ②NO吸收转化后的主要产物为N,若通电时电路中转移了0.3 mol e-,则此通电过程中理论上吸收的NO在标准状况下的体积为________ mL。 Ⅳ.常温下,将a mol·L-1的醋酸与b mol·L-1Ba(OH)2 溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=________(用含a和b的代数式表示)。 【解析】Ⅰ. (1)该反应ΔH>0、ΔS>0, ΔH-TΔS<0能自发进行,所以在高温条件下反应①能自发进行; 12 高考化学总复习 CH4(g)+H2O(g)CO(g)+3H2(g) ΔH1=+205.9 kJ·mol-1 ① CO(g)+H2O(g)CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1 ② 根据盖斯定律①-②得CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH3=ΔH1-ΔH2= +205.9 kJ·mol-1+41.2 kJ·mol-1=+247.1 kJ·mol-1; Ⅱ.(2) ①温度相同时,增大压强,N2 (g)+3H2 (g)2NH3(g)平衡正向移动,所以压强越大氨的体积分数增大,p1、p2 和p3 由大到小的顺序是p1>p2>p3; ②压强越大、温度越高,反应速率越快;A点压强、温度都低于B,所以vA(N2)查看更多