- 2021-07-08 发布 |
- 37.5 KB |
- 20页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高中化学 讲课 离子浓度比较
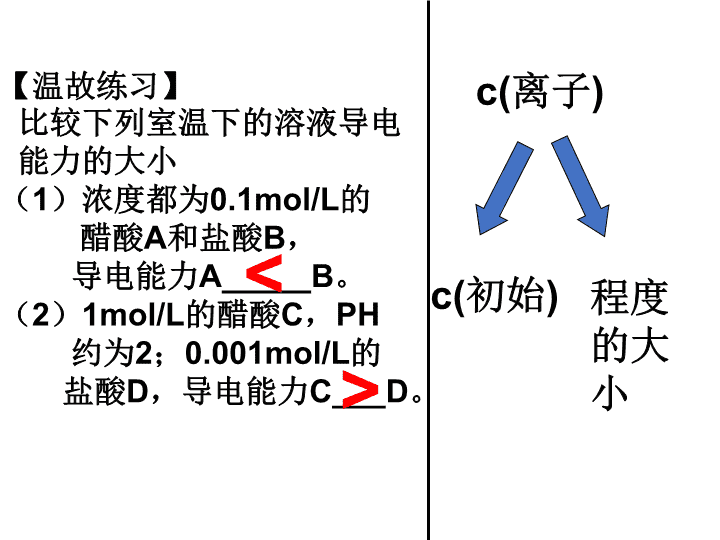
《选修4》 电解质水溶液中离子 浓度的关系及分析策略 【温故练习】 比较下列室温下的溶液导电 能力的大小 (1)浓度都为0.1mol/L的 醋酸A和盐酸B, 导电能力A_____B。 (2)1mol/L的醋酸C,PH 约为2;0.001mol/L的 盐酸D,导电能力C___D。 < > c(离子) 程度 的大 小 c(初始) 【课程设计】 c(离子) 程度的大小相近的浓度 c(离子) 程度的大小 相近的初始浓度 课程设计:先分析初始浓度相近的溶液, 再来分析相差较远的溶液。 c(离子) 程度的大小 相近的初始浓度 解题步骤:先找来源,再比程度。 策略一 1、初始浓度相近,多平衡共存, 程度大的浓度大 ; 策略一 1、初始浓度相近,多平衡共存, 程度大的浓度大 ; 2、解决复杂问题的策略 陌生问题熟悉化,复杂问题简单化。 【变式练习1】含CH3COONa和CH3COOH 各0.2mol/L的两溶液等体积混合后溶液中离 子浓度由大到小的关系为______________。 c(H+) > c(OH-) c(CH3COO-)> c(Na+) 策略二:守恒关系既能分析溶液中的等式关 系,更能帮助分析不等式的关系。 c(离子) 程度的大小c(初始) ? 【练习】向1L浓度为0.1mol/L的醋酸中缓慢的加 入过量的NaOH固体,溶液中的离子浓度可能出现 的大小情况有: (1)n(NaOH)=0 ,______________________; (2)n(NaOH)=0.5mol,____________________; (3)n(NaOH)=1.0mol,____________________; (4)n(NaOH)=2.0mol,____________________; 思考:为什么设定这几种情况? 【练习】向1L浓度为0.1mol/L的醋酸中缓慢的加 入过量的NaOH固体,溶液中的离子浓度可能出现 的大小情况有: (1) c(H+)>c(CH3COO-)>c(OH-); (2) c(CH3COO-)>c(Na+)>c(H+)>c(OH-); (3) c(Na+)>c(CH3COO-)>c(OH-)>c(H+); (4) c(Na+)>c(OH-)>c(CH3COO-)>c(H+); 策论三:初始浓度相差远找准特殊点, 【练习】向1L浓度为0.1mol/L的醋酸中缓慢的加 入过量的NaOH固体,溶液中的离子浓度可能出现 的大小情况有: (1) c(H+)>c(CH3COO-)>c(OH-) (2) c(CH3COO-)>c(Na+)>c(H+)>c(OH-); 随着NaOH的从无到有,在(1)(2)两种情况 之间离子的浓度会发生什么样的变化呢? 0.0 0.5 1.0 2.0 0.5 n(NaOH) c(离子) HNaAcOH (1) c(H+)>c(CH3COO-)>c(OH-)>c(Na+) (2) c(CH3COO-)>c(Na+)>c(H+)>c(OH-); 0.50.0 0.5 H NaAc OH Na OH Ac H H Na Ac OH (1) c(H+)>c(CH3COO-)>c(OH-)>c(Na+) (2) c(CH3COO-)>c(Na+)>c(H+)>c(OH-); 0.50.0 0.5 H NaAc OH Na OH Ac H H Na Ac OH c(CH3COO-)= c(H+)> c(Na+) =c(OH-)c(CH3COO-) >c(H+)=c(Na+)>c(OH-) 【练习】向1L浓度为0.1mol/L的醋酸中缓慢的加 入过量的NaOH固体,溶液中的离子浓度可能出现 的大小情况有: (1) c(H+)>c(CH3COO-)>c(OH-)>c(Na+) (2) c(CH3COO-)>c(Na+)>c(H+)>c(OH-); c(CH3COO-)= c(H+)> c(Na+) =c(OH-) c(CH3COO-) >c(H+)=c(Na+)>c(OH-) (3) c(Na+)>c(CH3COO-)>c(OH-)>c(H+); (4) c(Na+)>c(OH-)>c(CH3COO-)>c(H+); c(CH3COO-) = c(Na+) > c(OH-) = c(H+) c(Na+) > c(CH3COO-) =c(H+) >c(OH-) 【练习】向1L浓度为0.1mol/L的醋酸中缓慢的加 入过量的NaOH固体,溶液中的离子浓度可能出现 的大小情况有: (1)n(NaOH)=0 ,______________________; (2)n(NaOH)=0.5mol,____________________; (3)n(NaOH)=1.0mol,____________________; (4)n(NaOH)=2.0mol,____________________; 策论三:初始浓度相差远找准特殊点, 点点之间找渐变。 遇到溶液看初始浓度, 浓度近,比程度,守恒助; 浓度远,找等点,看渐变。 【总策略】 【小结】 所有难题不可怕, 陌生问题熟悉化, 复杂问题简单化, 坚定信念攻克它。查看更多