- 2021-07-08 发布 |
- 37.5 KB |
- 5页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
人教版选修二第1单元课题2知能优化训练
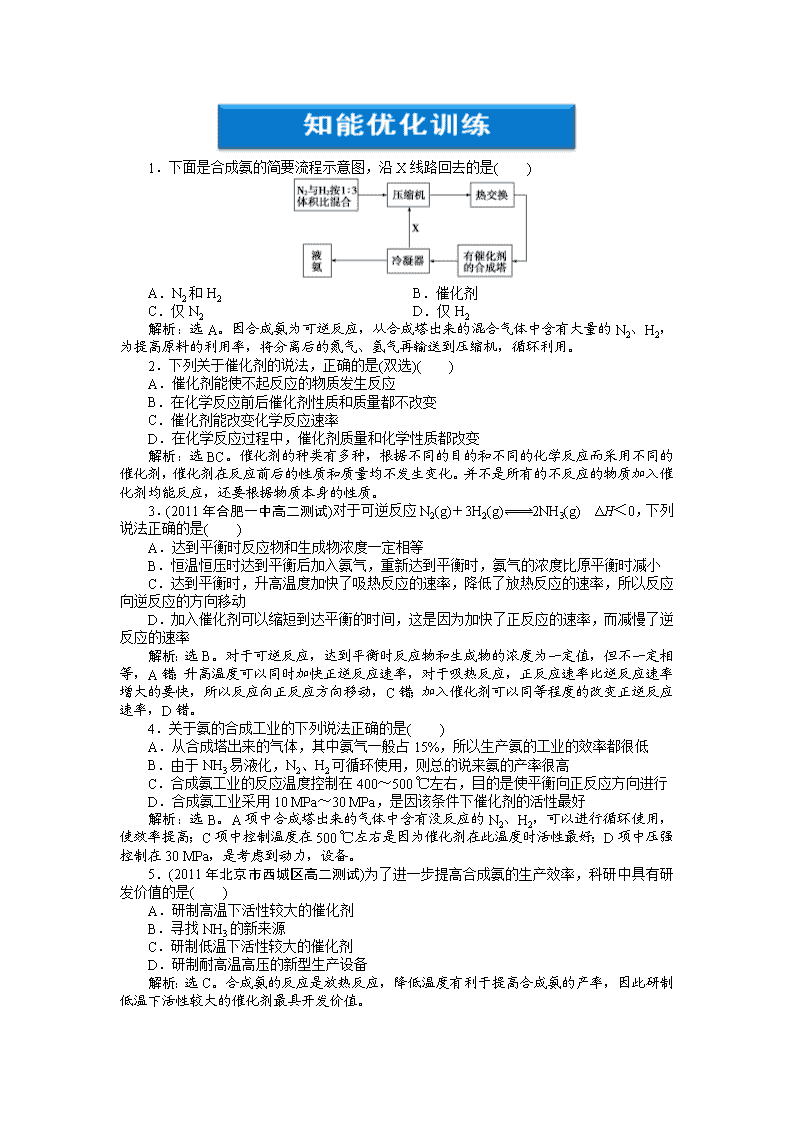
1.下面是合成氨的简要流程示意图,沿X线路回去的是( ) A.N2和H2 B.催化剂 C.仅N2 D.仅H2 解析:选A。因合成氨为可逆反应,从合成塔出来的混合气体中含有大量的N2、H2,为提高原料的利用率,将分离后的氮气、氢气再输送到压缩机,循环利用。 2.下列关于催化剂的说法,正确的是(双选)( ) A.催化剂能使不起反应的物质发生反应 B.在化学反应前后催化剂性质和质量都不改变 C.催化剂能改变化学反应速率 D.在化学反应过程中,催化剂质量和化学性质都改变 解析:选BC。催化剂的种类有多种,根据不同的目的和不同的化学反应而采用不同的催化剂,催化剂在反应前后的性质和质量均不发生变化。并不是所有的不反应的物质加入催化剂均能反应,还要根据物质本身的性质。 3.(2011年合肥一中高二测试)对于可逆反应N2(g)+3H2(g)2NH3(g) ΔH<0,下列说法正确的是( ) A.达到平衡时反应物和生成物浓度一定相等 B.恒温恒压时达到平衡后加入氨气,重新达到平衡时,氨气的浓度比原平衡时减小 C.达到平衡时,升高温度加快了吸热反应的速率,降低了放热反应的速率,所以反应向逆反应的方向移动 D.加入催化剂可以缩短到达平衡的时间,这是因为加快了正反应的速率,而减慢了逆反应的速率 解析:选B。对于可逆反应,达到平衡时反应物和生成物的浓度为一定值,但不一定相等,A错;升高温度可以同时加快正逆反应速率,对于吸热反应,正反应速率比逆反应速率增大的要快,所以反应向正反应方向移动,C错;加入催化剂可以同等程度的改变正逆反应速率,D错。 4.关于氨的合成工业的下列说法正确的是( ) A.从合成塔出来的气体,其中氨气一般占15%,所以生产氨的工业的效率都很低 B.由于NH3易液化,N2、H2可循环使用,则总的说来氨的产率很高 C.合成氨工业的反应温度控制在400~500 ℃左右,目的是使平衡向正反应方向进行 D.合成氨工业采用10 MPa~30 MPa,是因该条件下催化剂的活性最好 解析:选B。A项中合成塔出来的气体中含有没反应的N2、H2,可以进行循环使用,使效率提高;C项中控制温度在500 ℃左右是因为催化剂在此温度时活性最好;D项中压强控制在30 MPa,是考虑到动力,设备。 5.(2011年北京市西城区高二测试)为了进一步提高合成氨的生产效率,科研中具有研发价值的是( ) A.研制高温下活性较大的催化剂 B.寻找NH3的新来源 C.研制低温下活性较大的催化剂 D.研制耐高温高压的新型生产设备 解析:选C。合成氨的反应是放热反应,降低温度有利于提高合成氨的产率,因此研制低温下活性较大的催化剂最具开发价值。 6.实验室合成氨装置如下图所示,则以下说法中错误的是( ) A.装置甲的作用之一是干燥 B.装置甲的作用是化合 C.乙处导出的气体是N2、H2、NH3 D.检验产物可用湿润的红色石蕊试纸或浓盐酸等 解析:选B。装置甲的作用有三点:①干燥气体;②观察气体逸出速率便于控制比例;③使气体混合均匀。 7.下列有关合成氨工业的叙述,可用勒夏特列原理来解释的是( ) A.使用铁触媒,使N2和H2混合气体有利于合成氨 B.高压比常压条件更有利于合成氨的反应 C.500 ℃左右比室温更有利于合成氨的反应 D.合成氨时采用循环操作,可提高原料的利用率 解析:选B。A项使用催化剂对平衡无影响;C项500 ℃时催化剂活性最好;D项采用循环操作提高原料利用率与平衡移动无关。 8.化工生产中,为加快反应速率应优先考虑的措施是( ) A.选用适宜的催化剂 B.采用高压 C.采用高温 D.增大反应物浓度 解析:选A。化工生产中应首先考虑的是生产成本,因此应先考虑使用催化剂,提高反应速率。 9.在3H2+N22NH3反应中,使用催化剂的理由是( ) A.使平衡向正反应方向移动 B.没有催化剂该反应不能发生 C.使化学反应速率增大 D.遏止逆反应的发生 答案:C 10.工业合成氨的反应是在500 ℃左右进行,主要原因是( ) A.500 ℃时反应速率最快 B.500 ℃时的平衡浓度最大 C.500 ℃时的转化率最高 D.500 ℃催化剂能发挥最大效力 解析:选D。温度控制在500 ℃时,催化剂的催化效果最好。 11.(2011年大连模拟)某温度时,在一体积为2 L的密闭容器中,通入112 g N2和24 g的H2,此时容器内压强为p大气压。在该温度和催化剂作用下,H2和N2反应达到平衡,测得平衡时压强为0.95p大气压,下列说法不正确的是( ) A.平衡时,N2物质的量是3.6 mol B.平衡时,H2的物质的量是10.8 mol C.平衡时,N2的转化率10% D.NH3的体积百分含量是10% 解析:选D。充入的气体的物质的量分别为: n(N2)==4 mol n(H2)==12 mol 由压强的变化可知平衡后的气体的物质的量为: = n(总)=15.2 mol N2 + 3H2 2NH3 初: 4 mol 12 mol 0 变: x 3x 2x 平: 4 mol-x 12 mol-3x 2x 4 mol-x+12 mol-3x+2x=15.2 mol x=0.4 mol 故平衡时N2的物质的量是3.6 mol,H2的物质的量为10.8 mol。N2的转化率为:α(N2)=×100%=10% NH3的百分含量为:×100%=5.3%。 12.合成氨所用的H2可由煤与水反应制得,其中有一步反应为CO(g)+H2O(g) CO2(g)+H2(g),ΔH<0,欲提高CO转化率可采用的方法有:①降低温度;②增加压强;③使用催化剂;④增大CO的浓度;⑤增大水蒸气的浓度,其中正确的组合是( ) A.①②③④⑤ B.①⑤ C.①④⑤ D.只有⑤ 解析:选B。该反应是一个气体总体积不变的放热反应,欲提高CO的转化率,可设法使化学平衡向正反应方向移动,显然降低温度可以满足这一要求,增加水蒸气的浓度,平衡向正反应方向移动,CO的转化率也可以增大;但若增加CO的浓度,平衡虽然向右移动,但CO的总量增大,其转化率反而减小。增大压强和使用催化剂的操作只能加快反应速率,缩短达到平衡的时间,而与平衡时CO的转化率无关。 13.某蔬菜大棚内把空气中CO2浓度提高3~5倍,O2的浓度尽量减少,结果取得良好的增产效果。从反应6CO2+12H2OC6H12O6+6H2O+6O2(吸热),得到的启发是________________________________________________________________________ ________________________________________________________________________。 答案:增大反应物浓度,同时减少生成物浓度,可使平衡向正反应方向移动,提高C6H12O6的产量 14.合成氨工业中,原料气(N2、H2及CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(l)溶液来吸收原料中的CO,其反应是 [Cu(NH3)2Ac]+CO+NH3[Cu(NH3)3]Ac·CO+Q (1)必须除去原料气中CO的原因是________________________________________________________________________ ________________________________________________________________________。 (2)醋酸二氨合铜(l)吸收CO的适宜条件是________________________。 (3)吸收CO后的醋酸铜氨液经过适当处理又可再生,恢复其吸收CO的能力以循环使用,醋酸铜氨液再生的适宜条件是____________________。 解析:(1)CO可引起催化剂(铁触媒)的中毒,故要除去。 (2)题给信息方程式是一个气体体积减小的放热反应,为使醋酸二氨合铜(l)更好的吸收CO,即平衡向正反应方向移动,适宜条件应是低温、高压。 (3)醋酸铜氨液再生,即平衡向逆反应方向移动,适宜的条件应是高温、低压。 答案:(1)CO可引起催化剂中毒 (2)低温、高压 (3)高温、低压 15.(2011年保定一中高二检测)在以煤为主要原料的合成氨工业中,原料气氢气常用下述方法获得: ①C+H2O(g)CO+H2; ②CO+H2O(g)CO2+H2; (1)已知CO(g)+1/2O2(g)===CO2(g);ΔH=-283.0 kJ/mol; H2(g)+1/2 O2(g)===H2O(g);ΔH=-285.8 kJ/mol;写出上述CO与H2O(g)反应的热化学方程式: ________________________________________________________________________。 (2)从反应混合物中分离出H2的方法通常是以碱液洗气,根据该工业生产的实际分析,最好选用下列哪种溶液作为吸收剂?________,理由是________________________________________________________________________ ________________________________________________________________________。 A.氢氧化钠溶液 B.氨水 C.石灰水或石灰乳 (3)在实验室模拟上述反应②,830 ℃时在1 L的容器中装入CO和H2O(g)各2 mol使之反应,达到平衡时测得容器中CO2的浓度为1 mol/L,计算830 ℃时该反应的平衡常数。 解析:(1)由已知条件,根据盖斯定律很容易写出CO与H2O(g)反应的热化学方程式。 (2)混合气体中存在CO2,可用碱液除去,考虑到工业生产的实际情况,可选用氨水,因为生成的碳铵可作农作物肥料。 (3) CO+H2OCO2+H2 初: 2 2 0 0 变: 1 1 1 1 平: 1 1 1 1 故平衡常数为:K==1。 答案:(1)CO(g)+H2O(g)===CO2(g)+H2(g);ΔH=+2.8 kJ/mol (2)B 该厂有丰富的氨水资源且吸收后形成碳铵,是一种化肥,可取得较好的综合效益 (3)1 16.某化肥厂以氨和空气(其中氧气的体积分数为0.2)为原料生产硝酸铵过程如下: 其中反应①为4NH3+5O24NO+6H2O (1)步骤②中发生了两个反应,将这两个化学方程式合并为一个化学方程式,可表示为______________________。 (2)若不考虑副反应且各步反应均完全,为使生产过程中不再补充空气,则原料气中氨(包括第③步被硝酸吸收的氨)的体积分数最大值为________。 (3)假设实际生产中,反应①、②中含氮物质的利用率分别为a、b,反应③中氨的利用率为c、硝酸的利用率为100%,则合成硝酸铵的整个流程中,氨的总利用率是多少?(要求写出解题过程) 答案:(1)4NO+3O2+2H2O===4HNO3 (2)1/6(或16.7%) (3)法一:假设消耗NH3的总物质的量为1 mol,其中用于制取HNO3的NH3的物质的量为x mol,被HNO3吸收的NH3的物质的量为y mol,则有:x+y=1,abx=cy。 解得:x= y= 氨的总利用率=(xab+yc)/1= 法二:假设第①步参加反应的氨气的物质的量为4 mol,则: 生成硝酸的物质的量为4ab mol; 第③步需要氨气的物质的量为 mol; 氨的总利用率== 17.工业合成氨的反应为:N2(g)+3H2(g)2NH3(g);ΔH<0 (1)写出该反应的化学平衡常数表达式:K=__________。随着温度升高,K 值________(填“增大”、“减小”或“不变”)。 (2)化工生产条件选定的主要原因是(选填字母序号)________。 A.温度、压强对化学平衡的影响 B.铁触媒在该温度时活性大 C.工业生产受动力、材料、设备等条件的限制 (3)改变反应条件,会使平衡发生移动。如下图象表示随条件改变,氨气的百分含量的变化趋势。 当横坐标为压强时,变化趋势正确的是(选填字母序号)________,当横坐标为温度时,变化趋势正确的是(选填字母序号)________。 (4)如图所示三个容积相同的容器①、②、③,若起始温度相同,分别向三个容器中加入:①中3 mol H2和1 mol N2;②中2 mol NH3;③中1.5 mol H2和0.5 mol N2和1 mol NH3;一定条件下反应,达到平衡时各容器中NH3物质的百分含量由大到小的顺序为________(填容器编号)。 (5)合成氨工厂常通过测定反应前后的混合气体密度来确定氮的转化率。某工厂测得进入合成塔中N2、H2的密度为0.5536 g/L(标准状况),从合成塔中出来的混合气体密度为0.693 g/L。则该合成氨厂N2的转化率为________________。 答案:(1) 减小 (2)BC (3)b a (4)①<②<③ (5)25%查看更多