- 2021-07-08 发布 |
- 37.5 KB |
- 13页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届二轮复习水溶液中的离子平衡作业(全国通用)(15)
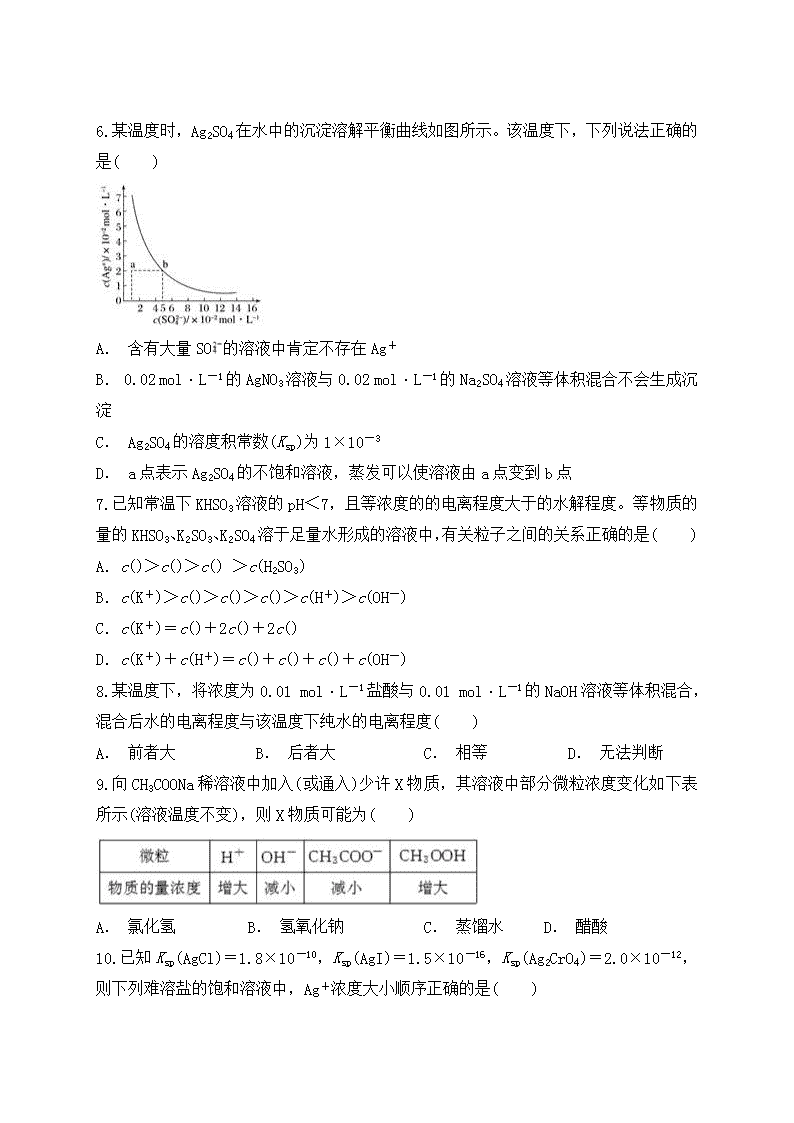
水溶液中的离子平衡 一、单选题 1.把氢氧化钙放入蒸馏水中,一定时间后达到如下平衡:Ca(OH)2(s)Ca2+(aq)+2OH-(aq),加入以下溶液,可使Ca(OH)2减少的是( ) A. Na2S溶液 B. AlCl3溶液 C. NaOH溶液 D. CaCl2溶液 2.对水垢的主要成分是CaCO3和Mg(OH)2而不是CaCO3和MgCO3的解释正确的是( ) A. Mg(OH)2的溶度积大于MgCO3的溶度积,且在水中发生了沉淀转化 B. Mg(OH)2的溶度积小于MgCO3的溶度积,且在水中发生了沉淀转化 C. MgCO3电离出的发生水解,使水中OH-浓度减小,对Mg(OH)2的沉淀溶解平衡而言,Qc<Ksp生成Mg(OH)2沉淀 D. MgCO3电离出的发生水解,使水中OH-浓度增大,对Mg(OH)2的沉淀溶解平衡而言,Qc>Ksp生成Mg(OH)2沉淀 3.一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的( ) ①NaOH(固体) ②H2O ③HCl ④CH3COONa(固体) A. ①② B. ②③ C. ③④ D. ②④ 4.常温下,取0.2 mol·L-1HX溶液与0.2 mol·L-1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则下列说法(或关系式)正确的是( ) A.c(Na+)-c(X-)=9.9×10-7mol·L-1 B.c(Na+)=c(X-)+c(HX)=0.2 mol·L-1 C.c(OH-)-c(HX)=c(H+)=1×10-6mol·L-1 D. 混合溶液中由水电离出的c(OH-)=10-8mol·L-1 5.下列关于水的离子积常数的叙述中,正确的是( ) A. 因为水的离子积常数的表达式是Kw=c(H+)·c(OH-),所以Kw随溶液中c(H+)和c(OH-)的变化而变化 B. 水的离子积常数Kw与水的电离平衡常数K电离是同一个物理量 C. 水的离子积常数仅仅是温度的函数,随着温度的变化而变化 D. 水的离子积常数Kw与水的电离平衡常数K电离是两个没有任何关系的物理量 6.某温度时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示。该温度下,下列说法正确的是( ) A. 含有大量SO的溶液中肯定不存在Ag+ B. 0.02 mol·L-1的AgNO3溶液与0.02 mol·L-1的Na2SO4溶液等体积混合不会生成沉淀 C. Ag2SO4的溶度积常数(Ksp)为1×10-3 D. a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点 7.已知常温下KHSO3溶液的pH<7,且等浓度的的电离程度大于的水解程度。等物质的量的KHSO3、K2SO3、K2SO4溶于足量水形成的溶液中,有关粒子之间的关系正确的是( ) A.c()>c()>c() >c(H2SO3) B.c(K+)>c()>c()>c()>c(H+)>c(OH-) C.c(K+)=c()+2c()+2c() D.c(K+)+c(H+)=c()+c()+c()+c(OH-) 8.某温度下,将浓度为0.01 mol·L-1盐酸与0.01 mol·L-1的NaOH溶液等体积混合,混合后水的电离程度与该温度下纯水的电离程度( ) A. 前者大 B. 后者大 C. 相等 D. 无法判断 9.向CH3COONa稀溶液中加入(或通入)少许X物质,其溶液中部分微粒浓度变化如下表所示(溶液温度不变),则X物质可能为( ) A. 氯化氢 B. 氢氧化钠 C. 蒸馏水 D. 醋酸 10.已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16,Ksp(Ag2CrO4)=2.0×10-12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是( ) A. AgCl>AgI>Ag2CrO4 B. AgCl>Ag2CrO4>AgI C. Ag2CrO4>AgCl>AgI D. Ag2CrO4>AgI>AgCl 11.由一价离子组成的四种盐:AC、BD、AD、BC的1 mol·L-1的溶液,在室温下前两种溶液的pH=7,第三种溶液pH>7,最后一种溶液pH<7,则( ) A. 答案A B. 答案B C. 答案C D. 答案D 12.为了除去MgCl2溶液中的FeCl3,可在加热搅拌的条件下加入的一种试剂是( ) A. NaOH B. Na2CO3 C. 氨水 D. MgO 13.下列电离方程式书写正确的是( ) A. NaHCO3===Na++H++ B. HFH++F- C. H2SO42H++ D. CH3COONH4CH3COO-+ 14.下列说法正确的是( ) A. 含有AgCl和AgI固体的悬浊液中c(Ag+)>c(Cl-)=c(I-) B. 25 ℃时Cu(OH)2在水中的溶解度大于在Cu(NO3)2溶液中的溶解度 C. 在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 D. 25 ℃ AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 15.室温时,下列混合溶液的pH一定小于7的是( ) A. pH=3的盐酸和pH=11的氨水等体积混合 B. pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合 C. pH=3的醋酸和pH=11的氢氧化钡溶液等体积混合 D. pH=3的硫酸和pH=11的氨水等体积混合 二、填空题 16.H2S是二元弱酸,溶液中存在H2SH++HS-、HS-H++S2-。 (1)向H2S溶液中加入CuSO4溶液时,电离平衡向________移动,c(H+)________, c(S2-)________。 (2)向H2S溶液中加入NaOH固体时,电离平衡向________移动,c(H+)________, c(S2-)________。 (3)若将H2S溶液加热至沸腾,c(H2S)________。 (4)若要增大H2S溶液中的c(S2-),最好加入__________。 17.部分弱酸的电离平衡常数如表: (1)在温度相同时,各弱酸的Ka值与酸性的相对强弱的关系为_________________。 (2)室温下①0.1 mol·L-1HCOONa,②0.1 mol·L-1NaClO,③0.1 mol·L-1Na2CO3,④0.1 mol·L-1NaHCO3溶液的pH由大到小的关系为 ________________________________________________________________________。 (3)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO、CO、HSO、HCO浓度由大到小的顺序为________________________。 (4)下列离子方程式正确的是________(填字母)。 a.2ClO-+H2O+CO2===2HClO+CO b.2HCOOH+CO===2HCOO-+H2O+CO2↑ c.H2SO3+2HCOO-===2HCOOH+SO d.Cl2+H2O+2CO===2HCO+Cl-+ClO- (5)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为________________。 18.25 ℃ 时,在①pH=2的盐酸、②pH=2的醋酸、③pH=12的氨水、④pH=12的NaOH溶液4种溶液中,由水电离出的c(H+)大小关系(或顺序)是______。 三、实验题 19.KMnO4在酸性介质中的强氧化性广泛应用于化学实验中。如: 2KMnO4+3H2SO4+5Na2SO3===5Na2SO4+K2SO4+2MnSO4+3H2O。某同学用KMnO4测定实验室长期存放的Na2SO3固体的纯度。现准确称取6.3 g Na2SO3固体样品,配成500 mL溶液,取25.00 mL放入锥形瓶中,用0.010 00 mol·L-1的酸性KMnO4溶液进行滴定,滴定结果如下表所示: (1)配制500 mL Na2SO3溶液时,必须用到的实验仪器有:烧杯、玻璃棒、托盘天平、药匙和___________________________________________________________。 (2)判断滴定终点的依据是__________________________________________________。 (3)用上述实验数据,计算Na2SO3的纯度为________。 20.用中和滴定的方法测定NaOH和Na2CO3的混合溶液中NaOH的含量,可先在混合液中加入过量的BaCl2溶液,使Na2CO3完全转变成BaCO3沉淀,然后用标准盐酸滴定。请回答: (1)向混有BaCO3沉淀的NaOH溶液中滴入盐酸,应选用________指示剂,判断到达滴定终点的实验现象是______________________________。 (2)为测定某烧碱样品中NaOH的含量(设样品中杂质为Na2CO3),某同学进行如下实验:准确称取5.0 g样品配制成250 mL溶液,然后分三次各取配制好的烧碱溶液20.00 mL于三个用蒸馏水洗净的锥形瓶中,分别加入过量的BaCl2溶液,并向锥形瓶中各加入1~2滴指示剂,用浓度为0.2000 mol·L-1的盐酸标准液进行滴定,相关数据记录如下: ①实验3到达滴定终点时所耗HCl溶液的体积为________;依据表中数据,计算出烧碱样品中含NaOH的质量分数为________%。(小数点后保留两位数字) ②滴定时的正确操作是__________________。 ③下列操作会导致烧碱样品中NaOH含量测定值偏高的是________。 A.锥形瓶用蒸馏水洗后未用待测液润洗 B.酸式滴定管用蒸馏水洗后未用标准液润洗 C.在滴定前有气泡,滴定后气泡消失 D.滴定前平视读数,滴定结束俯视读数 21.现以0.100 0 mol·L-1NaOH溶液滴定20.00 mL 0.100 0 mol·L-1HCl溶液为例,讨论强碱滴定强酸的情况,通过计算完成下表(已知:lg2=0.3,lg5=0.7。溶液混合时的体积变化忽略不计): (1)请利用表的数据绘制滴定曲线。 (2)如果初读数和末读数如图所示,滴定液的用量为________ mL。 四、计算题 22.已知某温度时0.01 mol·L-1HAc的电离度是4.24%,求其电离平衡常数和溶液中的c(H+)。 23.某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度。 (1)如图表示某次滴定时50 mL滴定管中前后液面的位置,请将用去的标准盐酸的体积填入表中空格。 (2)有关数据记录如下: 根据所给数据,计算出烧碱样品中NaOH的物质的量浓度________ mol·L-1。 24.25 ℃时,在0.5 L 0.2 mol·L-1的HA溶液中,有0.01 mol的HA电离成离子。求该温度下HA的电离常数。 答案解析 1.【答案】B 【解析】加入Na2S溶液,由于S2-水解呈碱性,c(OH-)增大,平衡向左移动,A项错误;加入AlCl3溶液,由于Al3++3OH-===Al(OH)3↓,平衡正向移动,Ca(OH)2减少,B项正确;加入NaOH溶液,c(OH-)增大,平衡向左移动,C项错误;加入CaCl2溶液,溶液中c(Ca2+)增大,平衡向左移动,D项错误。 2.【答案】D 【解析】由于Mg(OH)2和MgCO3中阴、阳离子个数比不同,不能直接根据Ksp的大小比较两者的溶解能力强弱,A、B项不正确;MgCO3溶解生成的能发生水解,增大水中OH-浓度,造成Qc>Ksp,生成Mg(OH)2沉淀,C项错误、D项正确。 3.【答案】D 【解析】①NaOH与盐酸反应,溶液中n(H+)减少,生成氢气减小,不符合;②稀释可使c(H+)减小,n(H+)不变,符合;③加HCl,溶液中c(H+)及n(H+)均增大,不符合;④CH3COONa与盐酸反应生成CH3COOH,c(H+)减小,因CH3COOHCH3COO-+H+,当H+消耗时,平衡正向移动直至H+完全生成氢气,符合。 4.【答案】A 【解析】HX+NaOH===NaX+H2O,最后得NaX溶液,pH=8,说明阴离子能水解,X-+H2OHX+ OH-,H2OH++OH-,该盐溶液中存在电荷守恒:c(Na+)+c(H+)=c(X-)+c(OH-),移项得c(Na+)-c(X-)=c(OH-)-c(H+)=1×10-6mol·L-1-1×10-8mol·L-1=9.9×10-7mol·L-1,A正确。n(Na)=n(X),c(Na+)=c(X-)+c(HX)=0.1 mol·L-1,B错误。该盐溶液中存在电荷守恒:c(Na+)+c(H+)=c(X-)+c(OH-)①,存在物料守恒:c(Na+)=c(X-)+c(HX)②,将②带入①得c(HX)+c(H+)=c(OH-),c(OH-)-c(HX)=c(H+)=1×10-8mol·L-1,C错误。溶液中OH-全部来自于水的电离,pH=8,c(H+)=1×10-8mol·L-1, c(OH-)=mol·L-1=1×10-6mol·L-1,D错误。 5.【答案】C 【解析】H2OH++OH-,Kw=c(H+)·c(OH-) =K电离·c(H2O),只与温度有关;温度越高,Kw越大,与其他因素无关,A、B、D错误。 6.【答案】B 【解析】Ag2SO4在水中存在沉淀溶解平衡,即使含有大量SO的溶液中也会存在Ag+,A项错;0.02 mol·L-1的AgNO3溶液与0.02 mol·L-1的Na2SO4溶液等体积混合,Ag2SO4的离子积Qc=(0.01)2×0.01=1×10-6查看更多