- 2021-07-08 发布 |
- 37.5 KB |
- 11页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020-2021学年湖南省长沙市高考第一次模拟考试理综化学试题及答案
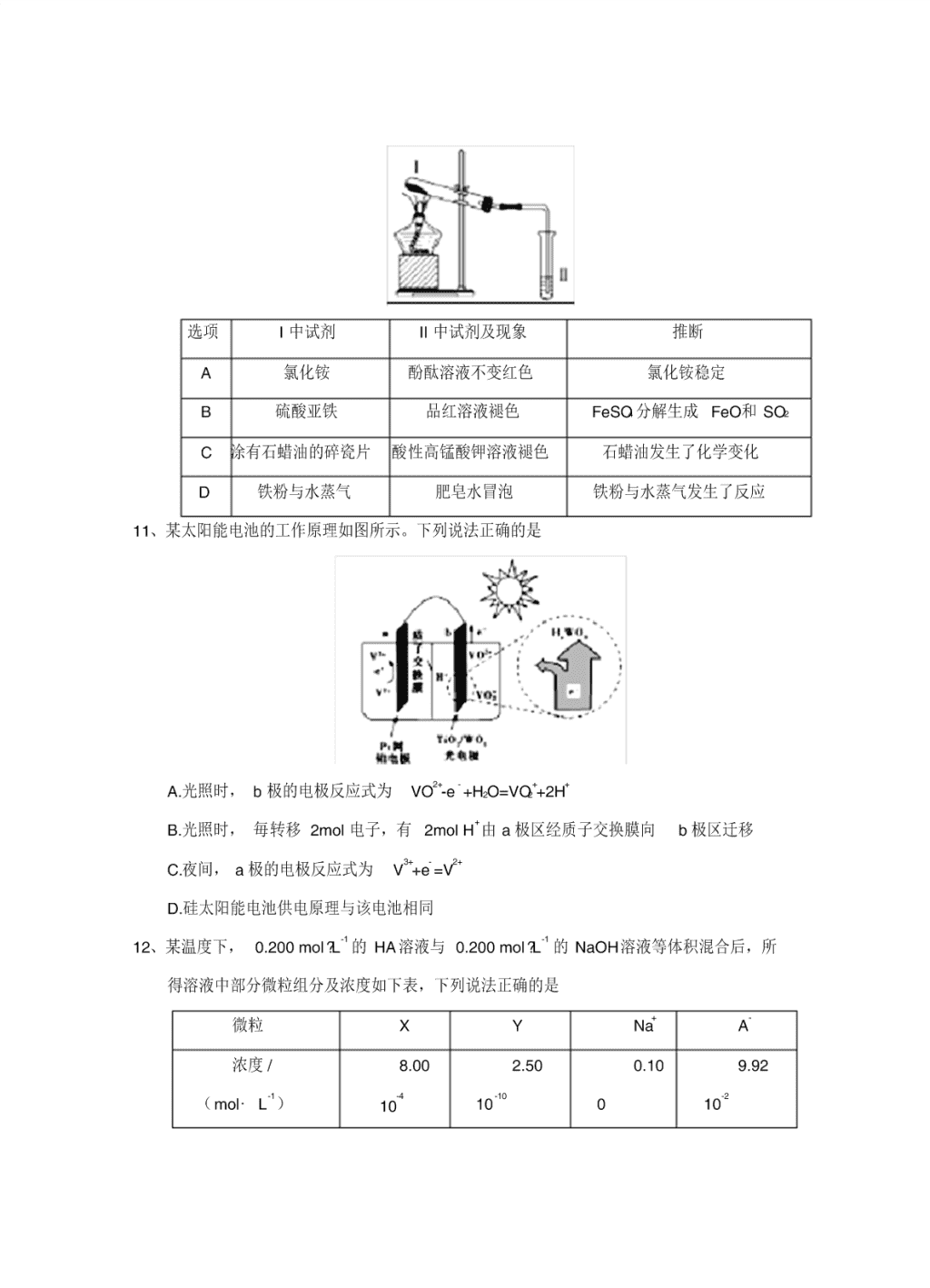
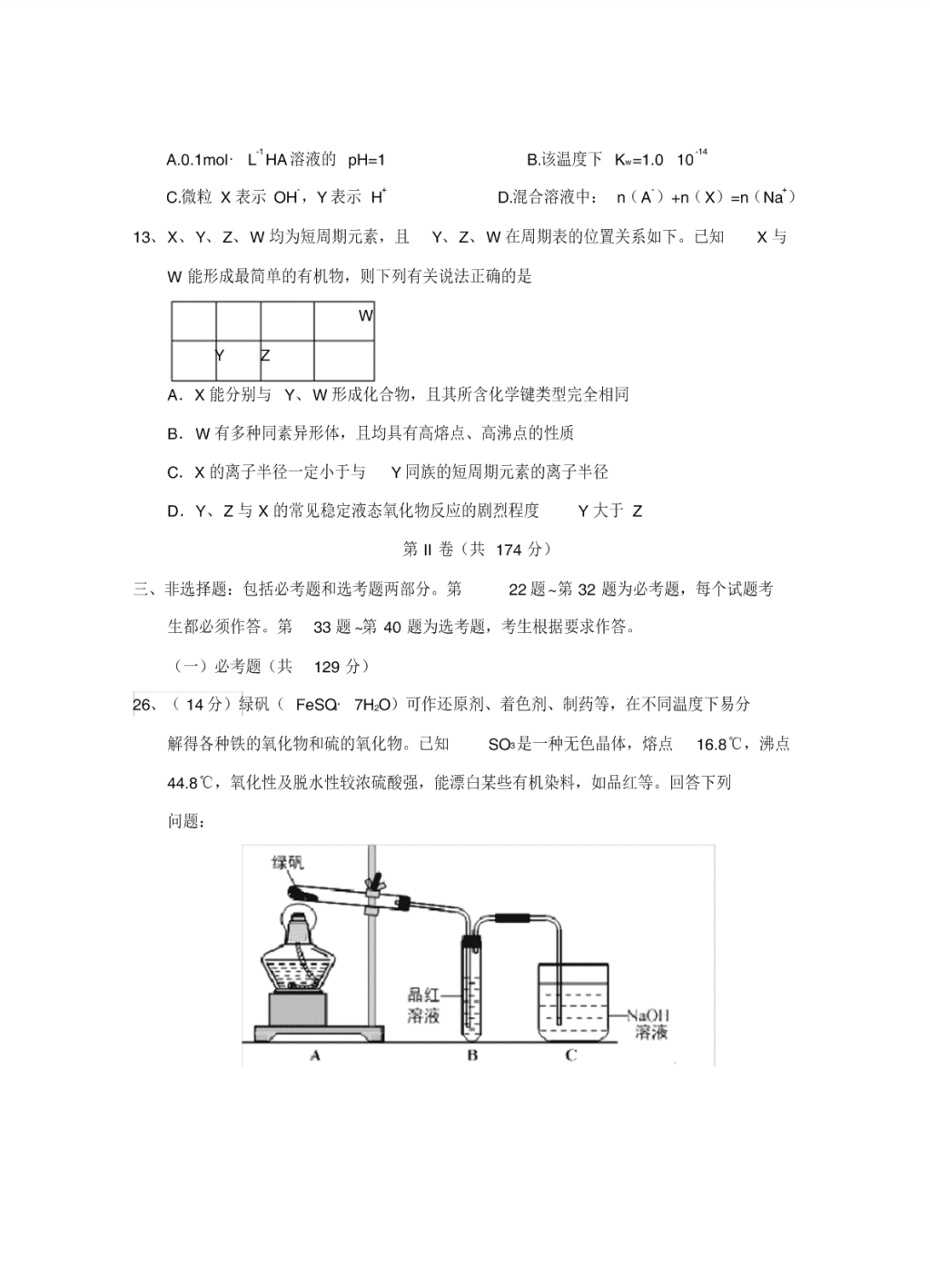
高三第一次模 拟 考 试 理综化学试题 可能用到的相对原子质量: H-1 B-11 N-14 O-16 Na -23 Al-27 P-31 Cl-35.5 Fe-56 Ni-59 Cu-64 第 I 卷(共 126 分) 7、下列关于元素及其化合物的说法不正确的是 A.Fe 在一定条件下可与浓盐酸、稀硫酸、浓硝酸等剧烈反应 B.Al、Cl2 均能和 NaOH溶液发生氧化还原反应,且两单质的作用不相同 C.在稀硫酸中加入铜粉,铜粉不溶解,若再继续加入 KNO3 固体,铜粉会溶解 D.金属单质 Na、 Mg、Fe 在一定条件下与水反应都生成 H2 和相应的碱 8、设 NA为阿伏加德罗常数的值。下列说法正确的是 A. 5.6gFe在氧气中燃烧,完全反应时转移电子数为 0.3NA B.标准状况下, 4.48LCH3C1 中所含原子数为 NA C. 1LpH=1 的 H2SO4 溶液中含有的 H+ 数为 0.2N A D.常温下, 1.7gNH3 和 3.65gHCl 混合后,气体分子数为 0.2NA 9、靑霉素是最重要的抗生素,其在体内经酸性水解后得到一种有机物 X。己知 X 的结 构如下,下列有关 X 的说法正确的是 A.X 为烃的含氧衍生物 B.X 的分子式为 C5H10NO2S C.X 只能发生取代反应 D.X 中碳原子上的 H 若有 1 个被 Cl 取代, 有 2 种不同产物 10、按如图装置进行实验,下列推断正确的是 选项 I 中试剂 II 中试剂及现象 推断 A 氯化铵 酚酞溶液不变红色 氯化铵稳定 B 硫酸亚铁 品红溶液褪色 FeSO4 分解生成 FeO和 SO2 C 涂有石蜡油的碎瓷片 酸性高锰酸钾溶液褪色 石蜡油发生了化学变化 D 铁粉与水蒸气 肥皂水冒泡 铁粉与水蒸气发生了反应 11、某太阳能电池的工作原理如图所示。下列说法正确的是 A.光照时, b 极的电极反应式为 VO2+-e - +H2O=VO2 ++2H+ B.光照时, 毎转移 2mol 电子,有 2mol H+ 由 a 极区经质子交换膜向 b 极区迁移 C.夜间, a 极的电极反应式为 V3++e- =V2+ D.硅太阳能电池供电原理与该电池相同 12、某温度下, 0.200 mol?L-1 的 HA溶液与 0.200 mol?L-1 的 NaOH溶液等体积混合后,所 得溶液中部分微粒组分及浓度如下表,下列说法正确的是 微粒 X Y Na+ A- 浓度 / (mol·L-1 ) 8.00 10 -4 2.50 10 -10 0.10 0 9.92 10-2 A.0.1mol· L-1 HA溶液的 pH=1 B.该温度下 Kw =1.0 10 -14 C.微粒 X 表示 OH- ,Y 表示 H+ D.混合溶液中: n(A- )+n(X)=n(Na+ ) 13、X、Y、Z、W 均为短周期元素,且 Y、Z、W 在周期表的位置关系如下。已知 X 与 W 能形成最简单的有机物,则下列有关说法正确的是 W Y Z A.X 能分别与 Y、W 形成化合物,且其所含化学键类型完全相同 B.W 有多种同素异形体,且均具有高熔点、高沸点的性质 C.X 的离子半径一定小于与 Y 同族的短周期元素的离子半径 D.Y、Z 与 X 的常见稳定液态氧化物反应的剧烈程度 Y 大于 Z 第 II 卷(共 174 分) 三、非选择题:包括必考题和选考题两部分。第 22 题~第 32 题为必考题,每个试题考 生都必须作答。第 33 题 ~第 40 题为选考题,考生根据要求作答。 (一)必考题(共 129 分) 26、( 14 分)绿矾( FeSO4·7H2O)可作还原剂、着色剂、制药等,在不同温度下易分 解得各种铁的氧化物和硫的氧化物。已知 SO3 是一种无色晶体,熔点 16.8℃,沸点 44.8℃,氧化性及脱水性较浓硫酸强,能漂白某些有机染料,如品红等。回答下列 问题: (1)甲组同学按照上图所示的装置,通过实验检验绿矾的分解产物。装置 B 中可 观察到的现象是 ___________,甲组由此得出绿矾的分解产物中含有 SO2 。装置 C的 作用是 __________________。 (2)乙组同学认为甲组同学的实验结论不严谨,认为需要补做实验。乙对甲组同 学做完实验的 B 装置的试管加热,发现褪色的品红溶液未恢复红色,则可证明绿矾 分解的产物中 _____________。(填字母) A.不含 SO2B.可能含 SO2C.一定含有 SO3 (3)丙组同学查阅资料发现绿矾受热分解还可能有 O2 放出,为此,丙组同学选用 甲组同学的部分装置和下图部分装置设计出了一套检验绿矾分解气态产物的装置: ①丙组同学的实验装置中,依次连接的合理顺序为 _______________。 ②能证明绿矾分解产物中有 O2 的实验操作及现象是 _______________ 。 (4)为证明绿矾分解产物中含有三价铁,选用的实验仪器有试管、胶头滴管、 _______________ ;选用的试剂为 _______________。 27、以冶铝的废弃物铝灰为原料制取超细α - 氧化铝,既降低环境污染又可提高铝资源 的利用率。已知铝灰的主要成分为 Al2O3(含少量杂质 SiO2、FeO、Fe2O3),其制备 实验流程如下: (1)铝灰中氧化铝与硫酸反应的化学方程式为 。 (2)图中“滤渣”的主要成分为 (填化学式 )。 (3)加 30%的 H2O2 溶液发生的离子反应方程式 为 。 (4)煅烧硫酸铝铵晶体,发生的主要反应为: 4[NH4Al(SO4)2·12H2 O] 2Al2O3 + 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将 产生的气体通过下图所示的装置。 ①集气瓶中收集到的气体是 (填化学式)。 ②足量饱和 NaHSO3 溶液吸收的物质除大部分 H2O(g)外还有 (填 化学式 )。 ③KMnO4 溶液褪色( MnO4 - 还原为 Mn2+),发生的离子反应方程式 为 。 28、( 14 分)雾霾天气频繁出现,严重影响人们的生活和健康。其中首要污染物为可 吸入颗粒物 PM2.5,其主要来源为燃煤、机动车尾气等。因此,对 PM2.5、SO2、 NOx 等进行研究具有重要意义。请回答下列问题: (1)将 PM2.5 样本用蒸馏水处理制成待测试样。 若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表: 离子 K+ Na+ NH4 + SO4 2- NO3 - Cl- 浓度 mol/L 4×10-6 6×10-6 2×10-5 4×10-5 3×10 -5 2×10 -5 根据表中数据判断试样的 pH= 。 (2)汽车尾气中 NOx 和 CO 的生成: ①已知汽缸中生成 NO的反应为: N2(g)+O2(g) 2NO(g) △H>0 恒温,恒容密闭容 器中,下列说法中能说明该反应达到化学平衡状态的是 ____ A.混合气体的密度不再变化 B.混合气体的平均分子量不再变化 C.N2、O2、NO 的物质的量之比为 1∶1∶2 D.氧气的百分含量不再变化 ②汽车燃油不完全燃烧时产生 CO,有人设想按下列反应除去 CO, 2CO(g)=2C(s)+O2(g),已知该反应的△ H>0,则该设想能否实现 ______________(填 “能”或“不能” ) (3)为减少 SO2 的排放,常采取的措施有: ①将煤转化为清洁气体燃料。已知: H2(g)+ 1/2O2(g) =H2O(g) △H=-241.8kJ·mol-1 C(s)+1/2O2(g) =CO(g)△H =-110.5kJ ·mol -1 写出焦炭与水蒸气反应的热化学方程式: 。 ②洗涤含 SO2 的烟气。 (4)汽车尾气净化的主要原理: 2NO(g)+2CO(g) 2CO2(g)+N 2(g) ; △ H < 0,若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在 进行到 t1 时刻达到平衡状态的是 __(填序号) 。(如图中 v 正 、K、n、w 分别表示正 反应速率、平衡常数、物质的量、质量分数) (5)车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首” 之一。活性炭可处理大气污染物 NO。在 5L 密闭容器中加入 NO 和活性炭(假设无 杂质)。一定条件下生成气体 E和 F。当温度分别在 T1℃和 T2℃时, 测得各物质平衡 时物质的量( n/mol )如下表: 物 质 温 度 /℃ 活 性 炭 NO E F 初 始 3.000 0.10 0 0 T1 2.960 0.020 0.040 0.040 T2 2.975 0.050 0.025 0.025 (1)写出 NO 与活性炭反应的化学方程式 ______________________ ; (2)计算上述反应 T1℃时的平衡常数 K1=__________________;若 T1<T2,则该反应 的△ H_0(填“>”、“<”或“=”)。 (3)上述反应 T1℃时达到化学平衡后再通入 0.1molNO 气体,则达到新化学平衡时 NO 的转化率为 ________; 35、【化学——选修 3:物质结构与性质】 (15 分) 磷存在于人体所有细胞中,是维持骨骼和牙齿的必要物质,几乎参与所有生理上的 化学反应。回答下列问题: (1)基态 P 原子的核外电子排布式为 ______,有 ______个未成对电子。 (2)磷的一种同素异形体 —— 白磷( P4)的立体构型为 ________,其键角为 __________,推测其在 CS2 中的溶解度 ______(填“大于”或“小于” )在水中的溶 解度。 (3)两种三角锥形气态氢化物膦( PH3)和氨( NH3)的键角分别为 93.6o 和 107o, 试分析 PH3 的键角小于 NH3 的原因 ______________________________ 。 ( 4)常温下 PCl5是一种白色晶体, 其立方晶系晶体结构模型如上左图所示, 由 A、 B 两种微粒构成。将其加热至 148℃熔化,形成一种能导电的熔体。已知 A、B 两 种微粒分别与 CCl4、SF6 互为等电子体, 则 A 为______,其中心原子杂化轨道类型 为 ______,B 为______。 ( 5)磷化硼( BP)是一种超硬耐磨涂层材料,上右图为其立方晶胞,其中的每个 原子均满足 8 电子稳定结构,试判断其熔点 ______(填“高于”或“低于” )金刚 石熔点。 已知其 B— P 键长均为 x cm,则其密度为 ______g﹒cm —3 (列出计算式即可) 。 36、[化学—选修 5:有机化学基础 ] (15 分) 对乙酰氨基酚,俗称扑热息痛( Paracetamol),具有很强的解热镇痛作用,工业上 通过下列方法合成(图中 B1 和 B2、 C1 和 C2 分别互为同分异构体,无机产物略去) : 已知: ,请按要求填空: (1)写出 A 分子中官能团名称: _________;C1 的结构简式为: ___________________。 (2)写出由 D 生成扑热息痛的化学方程式: _______________________ 。 (3)学出反应③和④的反应类型:③ ______________,④ __________。 (4)工业上设计反应①、②、③,而不是只通过反应②得到 C1、C2 ,其目的是: _______。 (5)扑热息痛有很多同分异构体, 符合下列要求的同分异构体有 5 种 :(1)是对位 二取代苯; (II)苯环上两个取代基一个含氮不含碳、另一个含碳不含氮; (III)两 个氧原子与同一原子相连。其中 2 种的结构简式是 和 ,写出另 3 种同分异构体的结构简式 ____________、 ____________、____________。 7-10 DBDC 11-13 ADD 26、(1)品红溶液褪色( 2 分);吸收尾气,防止 SO2(SO3)等气体扩散到空气中污染环境 (2 分) (2) BC (2 分)(选 A 不得分,选对一个给 1 分) (3)① AFGBDH(3 分) ②把 H 中的导管移出水面,撤走酒精灯,用姆指堵住试管口,取出试管,立即把带 火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气( 3 分) (4)药匙( 1 分);盐酸, KSCN溶液( 1 分,只写一个不得分) 27、(1)Al2O3+3H2SO4 =Al2(SO4) 3+3H2O(3 分) (2)SiO2(2 分) (3)2Fe2++ H2O2+2H+=2Fe3++2H2O(3 分) (4)① N2(2 分)② SO3、NH3(2 分)③ 2MnO4 - +5SO2+2H2O=2Mn2++5SO4 2-+4H+ (3 分) 28、(1)4 (2 分) (2)① D ( 1 分)②不能( 1 分) (3)① C(s)+H2O(g)=CO(g)+H2 (g) △ H= +131.3 kJ?mol -1 ( 2 分) (4)BD( 2 分) (5)① C(s)+2NO(g)=CO2(g)+N2(g) (1 分)② 4(2 分) <(1 分)③ 80%( 2 分) 35、【化学——选修 3:物质结构与性质】 ( 15 分) (1)1s22p 63s23p3 (1 分);3(1 分) (2)正四面体形( 1 分);60°(1 分);大于( 1 分) (3)电负性 N 强于 P,中心原子的电负性越大,成键电子对离中心原子越近,成键 电子对之间距离越小,成键电子对之间的排斥力增大,键角变大。 (3 分) (4)PCl4 + (1 分);sp3 ( 1 分);PCl6 - ( 1 分) (5)低于( 1 分); 323 4454sinx221002.6 424 或 3 23 x 3 41002.6 424 (3 分) 36、【化学——选修 5:有机化学基础】( 15 分) (1)醚键( 2 分); (2 分) (2) (2 分) (3)取代反应,还原反应(各 2 分) (4)保护酚羟基不被硝酸氧化( 2 分) (5) (3 分)查看更多