2021届一轮复习人教版专题18 实验方案的设计与评价作业(江苏专用)
专题18 实验方案的设计与评价
备考篇提纲挈领
【考情探究】
课
标
解
读
考点
实验方案的设计
实验方案的评价
解读
1.能设计实验方案,正确选用实验装置
2.掌握控制实验条件的方法
3.能绘制和识别典型的实验仪器装置图
1.能评价或改进实验方案
2.能预测或描述实验现象,分析或处理实验数据,得出合理结论
考情分析
本专题的考题以难题为主。设题形式为实验题和计算题。实验题第16题侧重工业生产过程,第19题侧重实验研究,两者都常以实验流程图为载体,以生产及研究中实际问题层层递进设问,内容涉及元素化合物知识及相关实验原理,主要考查学生对框图和文字信息的整合分析、推理预测能力;计算题第18题第3小问侧重实验结果分析(常涉及守恒法),主要考查学生对实验数据的处理能力
备考指导
2021年高考备考要关注与实验有关的基本知识,如化学(离子)方程式书写、反应产物分析、反应条件控制、仪器使用、实验原理分析、实验方案设计、实验数据处理、误差分析等
【真题探秘】
基础篇固本夯基
【基础集训】
考点一 实验方案的设计
1.根据下列实验操作和现象所得到的结论正确的是( )
选项
实验操作和现象
结论
A
向K2MnO4溶液(墨绿色)中加入醋酸,溶液逐渐变为紫色且有黑色沉淀
醋酸具有氧化性
B
向Fe(NO3)2溶液中滴入HI和淀粉混合溶液,溶液变蓝
氧化性:Fe2+>I2
C
向苯酚钠溶液中通入CO2,溶液变浑浊
结合H+能力:
C6H5O->CO32->HCO3-
D
将K2CrO4滴入AgNO3溶液至不再产生沉淀,再滴加相同浓度的Na2S溶液,沉淀由红棕色转化为黑色
Ksp(Ag2CrO4)>Ksp(Ag2S)
答案 D
2.下列设计的实验方案能达到实验目的的是( )
A.制备Fe(OH)3胶体:将饱和FeCl3溶液滴加到NaOH溶液中,并煮沸片刻
B.除去Cu粉中混有的CuO:向混合粉末中加入足量稀硝酸,过滤、洗涤并干燥
C.检验木炭与浓硫酸加热产生的气体中含有CO2:将气体通入澄清石灰水中,观察现象
D.提纯含有少量KBr的KCl并回收Br2:将混合物溶于水并通入足量Cl2,用CCl4萃取、分液,水相进行蒸发结晶收集KCl,有机相进行蒸馏回收Br2和CCl4
答案 D
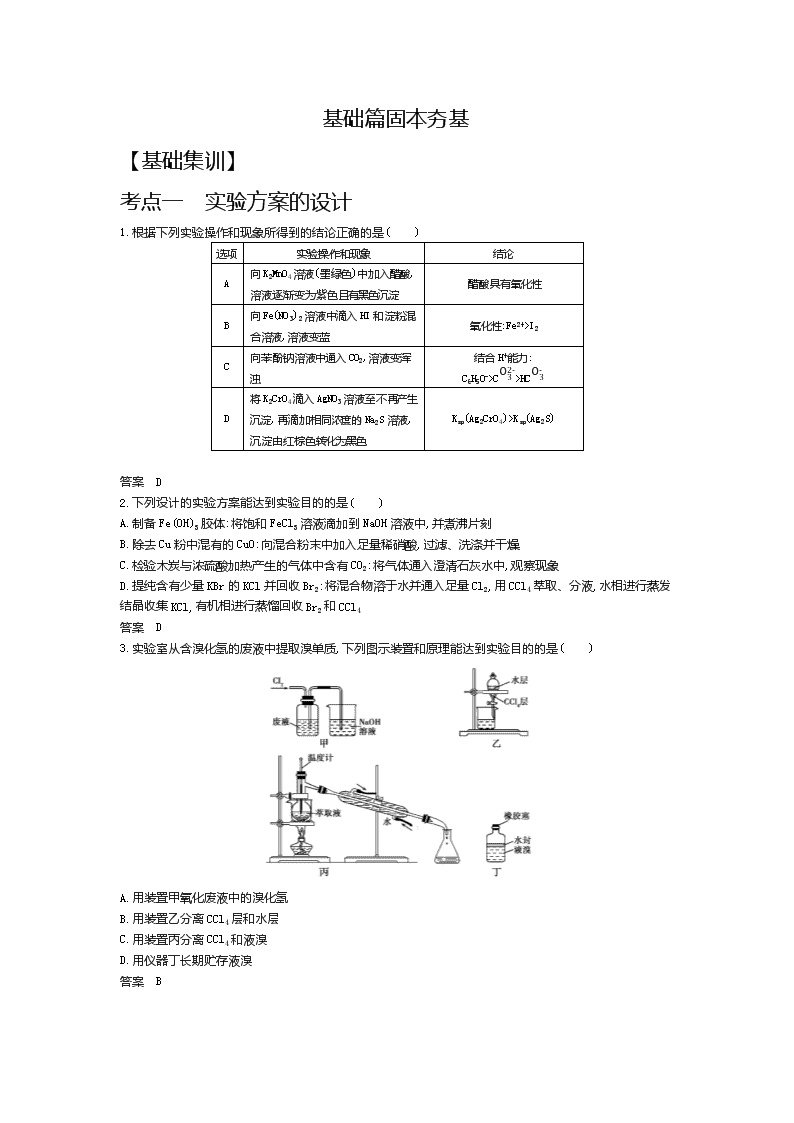
3.实验室从含溴化氢的废液中提取溴单质,下列图示装置和原理能达到实验目的的是( )
A.用装置甲氧化废液中的溴化氢
B.用装置乙分离CCl4层和水层
C.用装置丙分离CCl4和液溴
D.用仪器丁长期贮存液溴
答案 B
考点二 实验方案的评价
4.下列设计的实验方案能达到实验目的的是 ( )
实验目的
实验方案
A
配制0.010 0 mol·L-1的NaOH溶液
称取0.4 g NaOH固体于烧杯中,加入少量蒸馏水溶解,转移至1 000 mL容量瓶中定容
B
制取并纯化乙烯
将体积比为1∶3的乙醇与浓硫酸混合液(加沸石)加热至170 ℃,产生的气体依次通过NaOH溶液、碱石灰
C
比较Cl2与H2SO4氧化性强弱
向漂白粉中加入8 mol·L-1硫酸,观察有无黄绿色气体
D
探究温度对化学反应速率的影响
向2支试管中分别加入2 mL 0.01 mol·L-1 KMnO4溶液,再分别加入2 mL 0.1 mol·L-1 H2C2O4溶液,一支放入80 ℃热水中,另一支置于室温下,观察现象
答案 BD
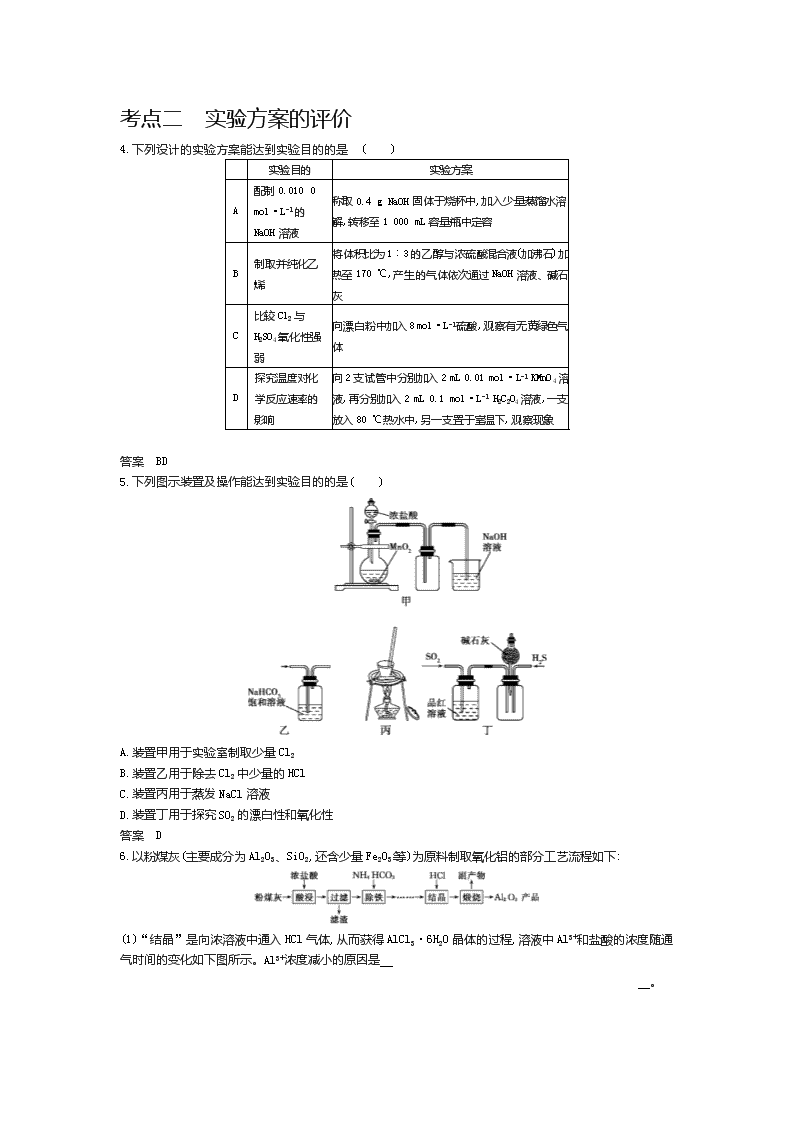
5.下列图示装置及操作能达到实验目的的是( )
A.装置甲用于实验室制取少量Cl2
B.装置乙用于除去Cl2中少量的HCl
C.装置丙用于蒸发NaCl溶液
D.装置丁用于探究SO2的漂白性和氧化性
答案 D
6.以粉煤灰(主要成分为Al2O3、SiO2,还含少量Fe2O3等)为原料制取氧化铝的部分工艺流程如下:
(1)“结晶”是向浓溶液中通入HCl气体,从而获得AlCl3·6H2O晶体的过程,溶液中Al3+和盐酸的浓度随通气时间的变化如下图所示。Al3+浓度减小的原因是
。
(2)上述流程中,可以循环利用的物质是 。
答案 (1)盐酸浓度增大,溶液中Cl-浓度增大,促进Al3+形成AlCl3·6H2O晶体析出 (2)HCl(或盐酸)
综合篇知能转换
【综合集训】
1.(2020届盐城中学学情测试一,9)下列实验操作或装置正确的是( )
A.用图1所示操作制备氢氧化铁胶体
B.用图2所示装置制取NH3
C.用图3所示装置制备Fe(OH)2,向试管中加入NaOH溶液,振荡
D.用图4装置测定中和反应的反应热
答案 B
2.(2020届南通海门中学质检一,6)下列图示装置操作规范且能达到实验目的的是( )
A.用装置甲制备少量氨气
B.用装置乙收集SO2并完成尾气处理
C.用装置丙除去粗盐水中的泥沙
D.用装置丁灼烧Al(OH)3制备Al2O3
答案 A
3.[2019扬州期中,19(1)~(3)]磷酸工业的副产品氟硅酸(H2SiF6)溶液中含少量碘,其回收方案如下。
已知:
①氟硅酸溶液中碘的可能存在形式为I2、I-、I3-;
②I2+I- I3-。
(1)K2Cr2O7、H2O2、NaClO和NaNO2都能使I-氧化为I2。NaNO2在氧化I-时会产生NO,该反应的离子方程式为 。从减少对环境污染的角度,上述氧化剂可选用的有H2O2、 。
(2)生成的I2可用热空气吹出的原因是 。
(3)在吸收时采用气-液逆流接触,则从吸收装置底部通入的是 (填“吸收液”或“含碘空气”)。吸收后的溶液需反复多次循环吸收含碘空气,其作用是:①提高SO2的利用率;② 。
答案 (1)4H++2NO2-+2I- I2+2NO↑+2H2O NaClO
(2)I2受热易升华 (3)含碘空气 增加吸收后溶液中I-浓度
4.(2018常州教育学会学业水平监测,19)以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料,制取氧化钴的流程如下:
(1)溶解:溶解后过滤,将滤渣洗涤2~3次,再将洗液与滤液合并,目的是 。
(2)氧化:在加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,其离子方程式是
。
已知:铁氰化钾化学式为K3[Fe(CN)6];亚铁氰化钾化学式为K4[Fe(CN)6]·3H2O。
3Fe2++2[Fe(CN)6]3-Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++3[Fe(CN)6]4-Fe4[Fe(CN)6]3↓(蓝色沉淀)
确定Fe2+已被完全氧化的方法是 (可供选择的试剂:铁氰化钾溶液、亚铁氰化钾溶液、铁粉、KSCN溶液)。
(3)除铁:加入适量的Na2CO3调节pH,生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出该反应的化学方程式: 。
(4)沉淀:生成沉淀碱式碳酸钴[2CoCO3·3Co(OH)2],沉淀需洗涤,洗涤的操作是
。
(5)溶解:CoCl2的溶解度曲线如图所示。向碱式碳酸钴中加入足量稀盐酸,边加热边搅拌至完全溶解后,需趁热过滤,其目的是 。
答案 (1)提高钴元素的利用率
(2)6Fe2++6H++ClO3-6Fe3++Cl-+3H2O 取氧化后的溶液少许于试管中,滴加几滴铁氰化钾溶液,若无蓝色沉淀生成,则Fe2+已全部被氧化
(3)3Fe2(SO4)3+6H2O+6Na2CO3Na2Fe6(SO4)4(OH)12↓+5Na2SO4+6CO2↑
(4)沿玻璃棒向漏斗中加入蒸馏水至浸没沉淀,静置使蒸馏水流下,重复操作2~3次
(5)防止因温度降低,CoCl2晶体析出
应用篇知行合一
【应用集训】
1.(2020届南通调研,13)下列设计的实验方案能达到实验目的的是( )
A.检验乙醇中是否含有少量水:向乙醇中投入金属钠
B.除去CO2气体中的HCl:将气体通入盛有饱和Na2CO3溶液的洗气瓶
C.比较Al和Al2O3的熔点大小:将一小块铝箔在酒精灯上加热并轻轻晃动
D.比较Cl2和Fe3+的氧化性大小:向FeCl2溶液中先滴加KSCN溶液,再通入少量Cl2
答案 CD
2.[2019苏州期末,19(3)]氯化镍(NiCl2·6H2O)常用于电镀、陶瓷等工业,某实验室以单质Ni为原料制取氯化镍晶体的实验步骤如下:
已知:①Fe(OH)3完全沉淀pH为3.2;Ni(OH)2开始沉淀pH为7.2,完全沉淀pH为9.2。
②NiCl2易水解,从溶液中获取NiCl2·6H2O须控制pH<2。
(3)在NiCO3·Ni(OH)2固体中混有少量Fe(OH)3。请补充完整由NiCO3·Ni(OH)2固体制备NiCl2·6H2O的实验方案:向NiCO3·Ni(OH)2固体中加入盐酸,边加边搅拌,
。 (NiCl2的溶解度曲线如下图所示。实验中须选用的仪器和试剂:pH计、盐酸、乙醇等)
答案 (3)用pH计测定反应液3.2
Ksp(AgI)
答案 D
2.[2014江苏单科,19(3)(4),8分]实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:
(3)氧化时,在三颈烧瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在40 ℃左右反应(实验装置如下图所示)。
实验控制在较低温度下进行的原因是 ;锥形瓶里盛放的溶液为 。
(4)已知:5SO32-+2IO3-+2H+I2+5SO42-+H2O
某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO3-中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO3-的实验方案:取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出有碘单质存在;
。
实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液。
答案 (3)使氯气在溶液中有较大的溶解度(或防止I2升华或防止I2进一步被氧化) NaOH溶液
(4)从水层取少量溶液,加入1~2 mL淀粉溶液,加盐酸酸化,滴加FeCl3溶液,若溶液变蓝,说明废水中含有I-;若溶液不变蓝,说明废水中不含有I-。另从水层取少量溶液,加入1~2 mL淀粉溶液,加盐酸酸化,滴加Na2SO3溶液,若溶液变蓝,说明废水中含有IO3-;若溶液不变蓝,说明废水中不含有IO3-
3.(2010江苏单科,15,12分)高纯MnCO3是制备高性能磁性材料的主要原料。实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:
(1)制备MnSO4溶液:在烧瓶中(装置见下图)加入一定量MnO2和水,搅拌,通入SO2和N2混合气体,反应3 h。停止通入SO2,继续反应片刻,过滤(已知MnO2+H2SO3MnSO4+H2O)。
①石灰乳参与反应的化学方程式为 。
②反应过程中,为使SO2尽可能转化完全,在通入SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施有 、 。
③若实验中将N2换成空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如下图。导致溶液中Mn2+、SO42-的浓度变化产生明显差异的原因是 。
(2)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100 ℃开始分解;Mn(OH)2开始沉淀的pH=7.7。请补充由(1)制得的MnSO4溶液制备高纯MnCO3的操作步骤[实验中可选用的试剂:Ca(OH)2、NaHCO3、Na2CO3、C2H5OH]。
① ;
② ;
③ ;
④ ;
⑤低于100 ℃干燥。
答案 (12分)(1)①Ca(OH)2+SO2CaSO3+H2O
②控制适当的温度 缓慢通入混合气体
③Mn2+催化O2与H2SO3反应生成H2SO4
(2)①边搅拌边加入NaHCO3(或Na2CO3),并控制溶液pH<7.7
②过滤,用少量水洗涤2~3次
③检验SO42-是否被洗涤除去
④用少量C2H5OH洗涤
(凡合理答案均可)
4.(2017课标Ⅰ,26,15分)凯氏定氮法是测定蛋白质中氮含量的经典方法,其原理是用浓硫酸在催化剂存在下将样品中有机氮转化成铵盐,利用如图所示装置处理铵盐,然后通过滴定测量。已知:NH3+H3BO3 NH3·H3BO3;NH3·H3BO3+HCl NH4Cl+H3BO3。
回答下列问题:
(1)a的作用是 。
(2)b中放入少量碎瓷片的目的是 。f的名称是 。
(3)清洗仪器:g中加蒸馏水;打开k1,关闭k2、k3,加热b,蒸汽充满管路;停止加热,关闭k1,g中蒸馏水倒吸进入c,原因是 ;打开k2放掉水。重复操作2~3次。
(4)仪器清洗后,g中加入硼酸(H3BO3)和指示剂。铵盐试样由d注入e,随后注入氢氧化钠溶液,用蒸馏水冲洗d,关闭k3,d中保留少量水。打开k1,加热b,使水蒸气进入e。
①d中保留少量水的目的是 。
②e中主要反应的离子方程式为 ,e采用中空双层玻璃瓶的作用是 。
(5)取某甘氨酸(C2H5NO2)样品m克进行测定,滴定g中吸收液时消耗浓度为c mol·L-1的盐酸V mL,则样品中氮的质量分数为 %,样品的纯度≤ %。
答案 (1)避免b中压强过大
(2)防止暴沸 直形冷凝管
(3)c中温度下降,管路中形成负压
(4)①液封,防止氨气逸出
②NH4++OH- NH3↑+H2O 保温使氨完全蒸出
(5)1.4cVm 7.5cVm
考点二 实验方案的评价
5.[2013江苏单科,19(4)(5),6分]柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4·7H2O)通过下列反应制备:
FeSO4+Na2CO3 FeCO3↓+Na2SO4
FeCO3+C6H8O7 FeC6H6O7+CO2↑+H2O
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
金属离子
开始沉淀的pH
沉淀完全的pH
Fe3+
1.1
3.2
Al3+
3.0
5.0
Fe2+
5.8
8.8
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体。分离过程中加入无水乙醇的目的是 。
(5)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3)出发,先制备绿矾,再合成柠檬酸亚铁。请结合下图的绿矾溶解度曲线,补充完整由硫铁矿烧渣制备FeSO4·7H2O晶体的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量烧渣中加入足量的稀硫酸充分反应,
,
得到FeSO4溶液, ,
得到FeSO4·7H2O晶体。
答案 (4)降低柠檬酸亚铁在水中的溶解量,有利于晶体析出(2分)
(5)“(过滤,)向反应液中加入足量的铁粉,充分搅拌后,滴加NaOH溶液调节反应液的pH约为5,过滤”或“过滤,向滤液中滴加过量的NaOH溶液,过滤,充分洗涤固体,向固体中加入足量稀硫酸至固体完全溶解,再加入足量的铁粉,充分搅拌后,过滤”(2分) (滴加稀硫酸酸化,)加热浓缩得到60 ℃饱和溶液,冷却至0 ℃结晶,过滤,少量冰水洗涤,低温干燥(2分)
6.(2011江苏单科,19,15分)高氯酸铵(NH4ClO4)是复合火箭推进剂的重要成分,实验室可通过下列反应制取:
NaClO4(aq)+NH4Cl(aq)NH4ClO4(aq)+NaCl(aq)
(1)若NH4Cl用氨气和浓盐酸代替,上述反应不需要外界供热就能进行,其原因是 。
(2)反应得到的混合溶液中NH4ClO4和NaCl的质量分数分别为0.30和0.15(相关物质的溶解度曲线见图1)。从混合溶液中获得较多NH4ClO4晶体的实验操作依次为(填操作名称) 、干燥。
图1
(3)样品中NH4ClO4的含量可用蒸馏法进行测定,蒸馏装置如图2所示(加热和仪器固定装置已略去),实验步骤如下:
图2
步骤1:按图2所示组装仪器,检查装置气密性。
步骤2:准确称取样品a g(约0.5 g)于蒸馏烧瓶中,加入约150 mL水溶解。
步骤3:准确量取40.00 mL约0.1 mol·L-1 H2SO4溶液于锥形瓶中。
步骤4:经滴液漏斗向蒸馏烧瓶中加入20 mL 3 mol·L-1 NaOH溶液。
步骤5:加热蒸馏至蒸馏烧瓶中剩余约100 mL溶液。
步骤6:用新煮沸过的水冲洗冷凝装置2~3次,洗涤液并入锥形瓶中。
步骤7:向锥形瓶中加入酸碱指示剂,用c mol·L-1 NaOH标准溶液滴定至终点,消耗NaOH标准溶液V1 mL。
步骤8:将实验步骤1~7重复2次。
①步骤3中,准确量取40.00 mL H2SO4溶液的玻璃仪器是 。
②步骤1~7中,确保生成的氨被稀硫酸完全吸收的实验步骤是 (填步骤序号)。
③为获得样品中NH4ClO4的含量,还需补充的实验是 。
答案 (1)氨气与浓盐酸反应放出热量
(2)蒸发浓缩、冷却结晶、过滤、冰水洗涤
(3)①酸式滴定管
②1,5,6
③用NaOH标准溶液标定H2SO4溶液的浓度(或不加高氯酸铵样品,保持其他条件相同,进行蒸馏和滴定实验)
【三年模拟】
非选择题(共80分)
1.[2020届南师附中阶段测试一,19(3)②](5分)硫化碱法是工业上制备Na2S2O3的方法之一。某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O。
(3)Na2S2O3溶液是定量实验中的常用试剂。
油脂的不饱和度可通过油脂与I2的加成反应测定,通常称为油脂的碘值。碘值越大,油脂的不饱和程度越高。碘值是指100 g油脂所能吸收的I2的质量。
称取x g某油脂,加入含y mol I2的韦氏溶液(韦氏溶液是碘值测定时使用的特殊试剂),充分振荡;过量的I2用c mol·L-1 Na2S2O3标准溶液滴定(淀粉作指示剂),消耗Na2S2O3标准溶液V mL(滴定反应为2Na2S2O3+I2 Na2S4O6+2NaI)。
②请写出从上述测定碘值实验后的含碘废液中回收碘单质(废液中含有H2O、油脂、I2、I-)的实验方案: 。(实验中须使用的试剂有:Na2SO3溶液,淀粉溶液,5% H2O2溶液,CCl4)
答案 (3)②边搅拌边向含碘废液中滴加Na2SO3溶液至取少许废液加入淀粉不变蓝时停止滴加Na2SO3溶液,静置,分层,经分液取下层溶液加入适量5% H2O2溶液,向所得溶液加入CCl4振荡静置分液,取下层液体蒸馏
2.[2020届盐城中学学情测试一,21(4)](5分)FeC2O4·2H2O(草酸亚铁)是淡黄色结晶性粉末,难溶于水,在碱性或中性溶液中不稳定。它广泛应用于新型电池材料、感光材料等。一种用钛白副产物硫酸亚铁[含TiOSO4、Al2(SO4)3、MnSO4及重金属盐]制取电池级草酸亚铁的实验步骤如下:
步骤1:将固体钛白副产物硫酸亚铁溶于水、搅拌,加热至95 ℃,并加入还原铁粉
步骤2:维持pH为4~5,静置6 h、过滤,得纯净的FeSO4溶液
步骤3:在搅拌条件下,控制温度约40 ℃,加入氨水沉铁
步骤4:将草酸溶液滴入氢氧化亚铁悬浊液中,并用硫酸调节pH约为2
步骤5:过滤、洗涤、烘干
(4)请补充实验室用废铁屑(表面含有少量油脂及Cu等杂质)制备FeSO4·7H2O的实验方案:将废铁屑放入烧杯中加入 ,搅拌,过滤取固体,用蒸馏水洗涤,向洗涤后的铁屑中加入 ,水浴加热至只有少量气泡产生,趁热过滤,将滤液加入有纯铁屑的烧杯中, ,搅拌,至溶液呈浅绿色(杯底有铁粉剩余), ,滤液隔绝空气、静置、冷却结晶,过滤、 ,干燥,得到FeSO4·7H2O(已知绿矾的溶解度曲线如图所示)。
(实验提供选用试剂:烧碱溶液,1 mol/L硫酸溶液,18.4 mol/L硫酸溶液,冰水,热水)
答案 (4)热的烧碱溶液(2分) 适量1 mol/L稀硫酸溶液(2分) 60 ℃水浴加热(2分) 趁热过滤(2分) 用冰水洗涤固体2~3次(2分)
3.[2020届连云港新海中学学情检测二,19(5)](5分)实验室以菱镁矿(主要成分为MgCO3,含少量的CaO、SiO2、Al2O3、Fe2O3)为原料生产高纯MgO,其主要实验流程如下:
(5)补充完整由滤渣(SiO2、Al2O3、Fe2O3)制备纯净的Al2(SO4)3·18H2O晶体的实验步骤:向一定量滤渣中加入足量的稀硫酸,充分反应后过滤,向滤液中滴加NaOH溶液至生成的沉淀不再减少,过滤,
,抽干,装瓶。(实验中须使用的试剂:CO2气体、稀硫酸、蒸馏水、无水乙醇)
答案 (5)向所得滤液中通入二氧化碳气体至沉淀不再增加,过滤,用蒸馏水洗涤沉淀2~3次,加入稀硫酸至沉淀完全溶解,将所得溶液蒸发浓缩、冷却结晶,过滤,用无水乙醇洗涤晶体2~3次
4.[2020届南通海门中学质检一,19(2)](5分)CuCl是石油工业中一种常见的催化剂。
(2)硫酸铜法制备CuCl
①原理:2CuSO4+Na2SO3+2NaCl+H2O 2CuCl↓+2Na2SO4+H2SO4
②步骤:向25.00 mL硫酸铜溶液中加入2.340 g NaCl固体,待溶解后向其中加入一定体积的Na2SO3溶液, 。(已知氯化亚铜的回收率随温度和pH的变化分别如图1、图2所示。请补充完整实验方案,实验中须用到的试剂和装置:20%的氢氧化钠溶液、乙醇溶液、真空干燥器)
图1
图2
答案 (2)将混合溶液加热至70 ℃左右(1分)反应一段时间后用20%的氢氧化钠溶液调节溶液的pH在3.5左右(1分),过滤(1分),用乙醇溶液洗涤沉淀2~3次(1分),将沉淀置于真空干燥器中在70 ℃左右干燥(1分)
5.[2019江苏三校联考,19(Ⅲ)](5分)钛白粉(TiO2)在涂料、油墨等工业中有重要用途。实验室利用金红石(主要成分为TiO2,含少量SiO2杂质)制备钛白粉并测定其质量分数的过程如下。
已知:①TiO2是白色粉末,不溶于水和稀酸,溶于氢氟酸和热的浓硫酸。
②有关物质的性质如下表。
物质
熔点/℃
沸点/℃
其他
CCl4
-23
76
与TiCl4互溶
TiCl4
-25
136
遇潮湿空气产生白雾
SiCl4
-70
57.6
遇潮湿空气产生白雾
Ⅲ.测定钛白粉中TiO2的质量分数:
(5)某研究小组欲测定制得的钛白粉中TiO2的质量分数,实验步骤如下,请补充完整相关步骤:
①向a g钛白粉试样中加入 ;② ,将Ti4+还原为Ti3+;③ ,记录消耗NH4Fe(SO4)2标准溶液的体积;④计算。[可选用的试剂:16 mol·L-1硫酸溶液、2 mol·L-1盐酸、铝粉、0.100 0 mol·L-1 NH4Fe(SO4)2标准溶液和0.1 mol·L-1 KSCN溶液]
答案 (5)①足量热的16 mol·L-1硫酸溶液
②再加入过量的铝粉,过滤(说明:过滤也可放在③)
③加入几滴0.1 mol·L-1 KSCN溶液,用0.100 0 mol·L-1 NH4Fe(SO4)2标准溶液滴定至溶液恰好为红色,且在半分钟内不褪色
6.[2019苏锡常镇一模,19(5)](5分)以黄铜矿(CuFeS2)、FeCl3和乳酸[CH3CH(OH)COOH]为原料可制备有机合成催化剂CuCl和补铁剂乳酸亚铁{[CH3CH(OH)COO]2Fe}。其主要实验流程如下:
(5)已知:
①CuCl为白色晶体,难溶于水和乙醇,在空气中易被氧化;可与NaCl溶液反应,生成易溶于水的NaCuCl2。
②NaCuCl2可水解生成CuCl,温度、pH对CuCl产率的影响如图2、3所示。
图2 图3
由CuCl(s)、S(s)混合物提纯CuCl的实验方案为:将一定量的混合物溶于饱和NaCl溶液中,
。(实验中须使用的试剂有:饱和NaCl溶液、0.1 mol·L-1 H2SO4、乙醇;除常用仪器外须使用的仪器有:真空干燥箱)
答案 (5)过滤,控制温度在60 ℃左右,向滤液中滴加0.1 mol·L-1 H2SO4,控制溶液的pH为2.0~2.5之间,搅拌、趁热过滤,用乙醇洗净所得固体,置于真空干燥箱中干燥
7.[2019南京、盐城一模,19(5)](5分)以SO2、软锰矿(主要成分MnO2,少量Fe、Al、Ca及Pb的化合物等)、氨水及净化剂等为原料可制备MnSO4溶液和Mn3O4,主要实验步骤如下:
图1
步骤Ⅰ:如题所示装置,将SO2通入B中的软锰矿浆液中(MnO2+SO2 MnSO4)。
步骤Ⅱ:充分反应后,在不断搅拌下依次向三口烧瓶中加入适量纯净的MnO2、MnCO3,最后加入适量Na2S沉铅等重金属。
步骤Ⅲ:过滤得MnSO4溶液。
(5)已知:①用空气氧化Mn(OH)2浊液可制备Mn3O4[6Mn(OH)2+O2 2Mn3O4+6H2O],主要副产物为MnOOH;反应温度和溶液pH对产品中Mn的质量分数的影响分别如图2、图3所示:
图2
图3
②反应温度超过80 ℃时,Mn3O4产率开始降低。
③Mn(OH)2是白色沉淀,Mn3O4呈黑色;Mn3O4、MnOOH中锰的质量分数理论值依次为72.03%、62.5%。
请补充完整由步骤Ⅲ得到的MnSO4溶液、氨水等制备较纯净的Mn3O4的实验方案: ,真空干燥6小时得产品Mn3O4。
答案 (5)将滤液加热并保温在60~80 ℃,用氨水调节溶液pH至8~9,在不断搅拌下,边通空气边滴加氨水,至有大量黑色沉淀,静置,在上层清液中继续滴加氨水至无沉淀,过滤,用去离子水洗涤沉淀直至滤液中检不出SO42-
8.[2019南通一模,19(4)](5分)磷酸二氢钾(KH2PO4)是一种高效复合肥。工业上以羟磷灰石精矿[主要成分是Ca5(PO4)3OH,还含有少量石英和氧化铁等杂质]为原料,生产磷酸二氢钾的流程如下:
(4)查阅资料可知:
①磷酸三丁酯、二(2-乙基己基)磷酸酯都是难溶于水的液态有机物。
②磷酸三丁酯对H3PO4和Fe3+有较强的萃取作用。
③二(2-乙基己基)磷酸酯仅对Fe3+有较强的萃取作用。
请根据题中信息,补充完整“提纯”步骤的实验方案:向“制酸”所得粗磷酸中加入活性炭, ,向有机层中加入蒸馏水,振荡、静置,分液取水层,得到稀磷酸。
[实验中须使用的试剂有:二(2-乙基己基)磷酸酯、磷酸三丁酯]
答案 (4)过滤;向滤液中加入适量二(2-乙基己基)磷酸酯,振荡、静置,分液取水层;在水层中加入适量磷酸三丁酯,振荡,静置,分液取有机层
9.[2019江苏四校调研,19(3)](5分)NiSO4·7H2O大量用于电镀和催化剂。以含Ni2+、Co2+的混合液,NaClO溶液,Na2CO3溶液等可制NiSO4·7H2O并回收Co,其实验流程如下:
已知:温度高于80 ℃,Ni2+大量水解,生成Ni(OH)2胶体。
(3)请补充由NiCO3制备NiSO4·7H2O的实验方案:将稀硫酸加入装有NiCO3的容器中至全部溶解,
,得到NiSO4·7H2O。
答案 (3)低于80 ℃的温度下蒸发浓缩,冷却结晶,过滤,洗涤,低温干燥
10.[2019无锡期中,19(6)](5分)醋酸亚铬水合物{[Cr(CH3COO)2]2·2H2O}是一种深红色晶体,不溶于冷水和醚,微溶于醇,易溶于盐酸,易被氧化,在气体分析中常用作氧气吸收剂。一般制备方法是先在封闭体系中利用金属锌作还原剂,将正三价铬或正六价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验步骤如下:
步骤1:如图所示搭建实验装置,检查装置的气密性。
步骤2:锥形瓶中放冷的醋酸钠溶液,烧杯中放蒸馏水。将氯化铬固体置于三颈烧瓶中,加入少量去氧蒸馏水溶解,溶液呈深绿色,再加入足量的锌粒。塞紧瓶塞,三颈烧瓶内左侧导管要伸到瓶底。
步骤3:将浓盐酸加入恒压滴液漏斗中,打开弹簧夹2,关闭弹簧夹1,旋开恒压滴液漏斗的活塞并控制好滴速,一段时间后,三颈烧瓶内的溶液由深绿色变为亮蓝色。
步骤4:……
步骤5:当出现大量红棕色晶体时,关闭恒压滴液漏斗活塞。
步骤6:过滤、洗涤和干燥,获得醋酸亚铬晶体。
已知:
①二价铬不稳定,极易被氧气氧化(反应为4Cr2++4H++O2 4Cr3++2H2O),不与锌反应。
②制备过程中发生的相关反应如下:
2Cr2+(aq)+4CH3COO-(aq)+2H2O(l) [Cr(CH3COO)2]2·2H2O(s)。
③通常情况下,溶液中Cr2+呈亮蓝色,Cr3+呈深绿色。
回答下列问题:
(6)已知:pH>12时Cr(OH)3能溶于NaOH溶液生成[Cr(OH)4]-;pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1 mol·L-1计算)。
金属离子
开始沉淀的pH
沉淀完全的pH
Cr2+
6.6
8.6
Cr3+
4.3
5.6
Zn2+
6.2
8.2
镀锌工业中(电解液为ZnCl2溶液)会产生大量含铬杂质(主要以Cr3+形式存在,含少量Cr2+),结合题给信息,请补充完整由该电解液制备ZnO的实验方案:向电解液中加入适量1 mol·L-1 HCl溶液酸化,边鼓入空气边搅拌,使其充分反应;
;900 ℃煅烧。
(实验中可选用的试剂:1 mol·L-1 HCl溶液、1.0 mol·L-1 HNO3溶液、1.0 mol·L-1 NaOH溶液)
答案 (6)滴加1.0 mol·L-1 NaOH溶液,调节溶液pH约为6(或5.6≤pH<6.2),过滤,向滤液中滴加1.0 mol·L-1 NaOH溶液,调节溶液pH约为10(或8.2≤pH≤11),过滤、洗涤、干燥
11.[2019常州教育学会学业水平监测,19(4)](5分)某兴趣小组用铝箔制备Al2O3、AlCl3·6H2O及明矾大晶体,具体流程如下:
已知:①AlCl3·6H2O易溶于水、乙醇及乙醚;
②明矾在水中的溶解度如下表。
温度/℃
0
10
20
30
40
60
80
90
溶解度/g
3.00
3.99
5.90
8.39
11.7
24.8
71.0
109
请回答:
(4)已知:在不同温度下向一定量的氯化铝溶液中通入HCl气体,其通入量对AlCl3·6H2O结晶量和结晶效率的影响如图,请补充完整由胶状固体制备AlCl3·6H2O晶体的实验方案:向胶状固体滴加一定浓度盐酸,直至恰好完全溶解,
。
答案 (4)在45 ℃以下(或冷水浴条件下)通入HCl气体,至有大量晶体析出,过滤,用浓盐酸洗涤2~3次,低温(或减压)干燥,得到AlCl3·6H2O晶体
12.[2019徐州、淮安、连云港调研,19(5)](5分)实验室用红土镍矿(主要成分为NiS、FeS、CaS和SiO2等)为原料制备NiSO4·6H2O的流程如下:
已知:①CaF2难溶于水,NiSO4易溶于水,不溶于乙醇;②Ni溶于稀H2SO4。
(5)NiSO4质量分数随温度变化曲线如图,请补充流程中“过滤”后得到NiSO4·6H2O晶体的实验方案:将滤渣 ,得到NiSO4·6H2O晶体(实验中须使用的试剂有1 mol·L-1 H2SO4溶液,乙醇)。
答案 (5)溶于适当过量的1 mol·L-1 H2SO4溶液,过滤;将滤液蒸发浓缩,降温至28 ℃结晶;趁热过滤;用乙醇洗涤,低温干燥。
13.[2019南京、盐城二模,19(4)](5分)硫酸镍是电镀工业必不可少的化工原料。从不锈钢废渣(主要含Fe 42.35%、Cr 9.67%、Ni 5.1%、C 4.7%、Si 3.39%等)中制取硫酸镍晶体的工艺流程如下:
已知:①Cr3+与氨水反应时有少量[Cr(NH3)6]3+生成,但加热时该配合物易分解。Ni2+与氨水反应生成[Ni(NH3)6]2+,该配合物加热时稳定,用硫酸酸化时生成相应的硫酸盐。
②Na2CrO4溶液中加酸调节pH为3.5时,CrO42-转化为Cr2O72-。
③相关物质在不同温度时溶解度如下表:
温度溶解度/g物质
20 ℃
30 ℃
40 ℃
60 ℃
80 ℃
90 ℃
Na2SO4
19.5
40.8
48.8
45.3
43.7
42.7
Na2Cr2O7
183
198
215
269
376
405
(4)“过滤”时产生的滤渣可用于制备Na2Cr2O7晶体。
①滤渣经干燥后与Na2CO3混合在空气中煅烧生成Na2CrO4和CO2,此反应的化学方程式为
。
②请补充完整上述煅烧后混合物制备Na2Cr2O7晶体(橙红色)的实验方案:水浸,过滤,
,得Na2Cr2O7晶体(必须使用的试剂有:硫酸,蒸馏水)。
答案 (4)①4Cr(OH)3+4Na2CO3+3O2 4Na2CrO4+4CO2+6H2O
②向滤液中加入硫酸调节pH至3.5,将溶液加热到90 ℃(以上)蒸发结晶,有大量无色晶体析出,至有少量橙红色晶体析出时趁热过滤,滤液降温至40 ℃结晶,过滤,用蒸馏水洗涤,干燥
14.[2019泰州一模,19(3)](5分)二氧化氯(ClO2)和臭氧(O3)均具有强氧化性,可用于水处理。ClO2是一种易溶于水的黄绿色气体,其体积分数超过10%时易引起爆炸;O3是一种微溶于水的蓝色气体,其体积分数超过25%时容易引起爆炸。
(3)某科研机构经多次实验,利用O3、KCl和工业废渣(主要成分为NaNO3和NaNO2)制得KNO3,相关工艺参数如图1和图2[浓缩蒸发水量=m(反应液蒸发的水量)/m(反应液的总质量)]。
请选择最佳实验方案,参与完成他们的制备:将100 g废渣加入80 mL热水中,充分搅拌,
,在50 ℃恒温水浴锅中充分反应后,过滤, ,趁热过滤, ,过滤得KNO3粗品,再重结晶提纯得到KNO3(需使用的试剂及用量:60 L 0.008 g·L-1 O3和80 g KCl固体)。
图1
图2
答案 (3)通入60 L 0.008 g·L-1 O3充分反应,再加入80 g KCl固体充分反应 然后将溶液浓缩蒸发水量25% 将滤液冷却到10 ℃结晶
15.[2019扬州一模,19(5)](5分)以高氯冶炼烟灰(主要成分为铜锌的氯化物、氧化物、硫酸盐,少量铁元素和砷元素)为原料,可回收制备Cu和ZnSO4·H2O,其主要实验流程如下:
已知:①Fe3+完全沉淀pH为3.2,此时Zn2+、Cu2+未开始沉淀;
②K3[Fe(CN)6]可用于检验Fe2+:3Fe2++2[Fe(CN)6]3- Fe3[Fe(CN)6]2↓(深蓝色);
③砷元素进入水体中对环境污染大,可通过沉淀法除去。
(5)已知H3AsO3的还原性强于Fe2+,Ksp(FeAsO3)>Ksp(FeAsO4)=5.7×10-21。测得酸浸液中杂质铁元素(以Fe2+存在)、砷元素(以H3AsO3存在)的浓度分别为1.15 g·L-1、0.58 g·L-1,可采用“氧化中和共沉淀”法除去,请设计实验方案: {实验中须使用的试剂有:30%双氧水、0.001 mol·L-1 K3[Fe(CN)6]溶液、回收的铜锌沉淀物}。
答案 (5)向酸浸液中加入过量30%双氧水(1分),搅拌使其充分反应,取样滴加0.001 mol·L-1 K3[Fe(CN)6]溶液(1分),无深蓝色沉淀时加入回收的铜锌沉淀物(1分)并搅拌,调节pH为3.2(1分),静置,过滤(1分),取滤液
16.[2018南京、盐城一模,18(5)](5分)PbCrO4是一种黄色颜料,制备PbCrO4的一种实验方法如下:
6 mol·L-1NaOH溶液 6%H2O2溶液
↓ ↓
CrCl3溶液→制NaCrO2(aq)→氧化→煮沸→冷却液→…→PbCrO4
小火加热
已知:①Cr(OH)3(两性氢氧化物)呈绿色且难溶于水;
②Pb(NO3)2、Pb(CH3COO)2均易溶于水,Ksp(PbCrO4)=2.8×10-13,Pb(OH)2开始沉淀时pH为7.2,完全沉淀时pH为8.7;
③六价铬在溶液中物种分布分数与pH关系如图所示;
④PbCrO4可由沸腾的铬酸盐溶液与铅盐溶液作用制得,含PbCrO4晶种时更易生成。
(5)请设计用“冷却液”制备PbCrO4的实验方案:
[实验中须使用的试剂有6 mol·L-1的醋酸溶液、0.5 mol·L-1的Pb(NO3)2溶液、pH试纸]。
答案 (5)在不断搅拌下,向“冷却液”中加入6 mol·L-1的醋酸溶液至用pH试纸测溶液pH为7,将溶液加热至沸腾,先加入一滴0.5 mol·L-1 Pb(NO3)2溶液,搅拌片刻产生少量沉淀,然后继续滴加0.5 mol·L-1 Pb(NO3)2溶液至有大量沉淀产生,静置,向上层清液中滴入0.5 mol·L-1Pb(NO3)2溶液,若无沉淀生成,停止滴加,静置、过滤、洗涤、干燥