- 2021-07-08 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020-2021学年高二化学新教材人教版必修第二册教师用书:第五章 化工生产中的重要非金属元素 Word版含解析
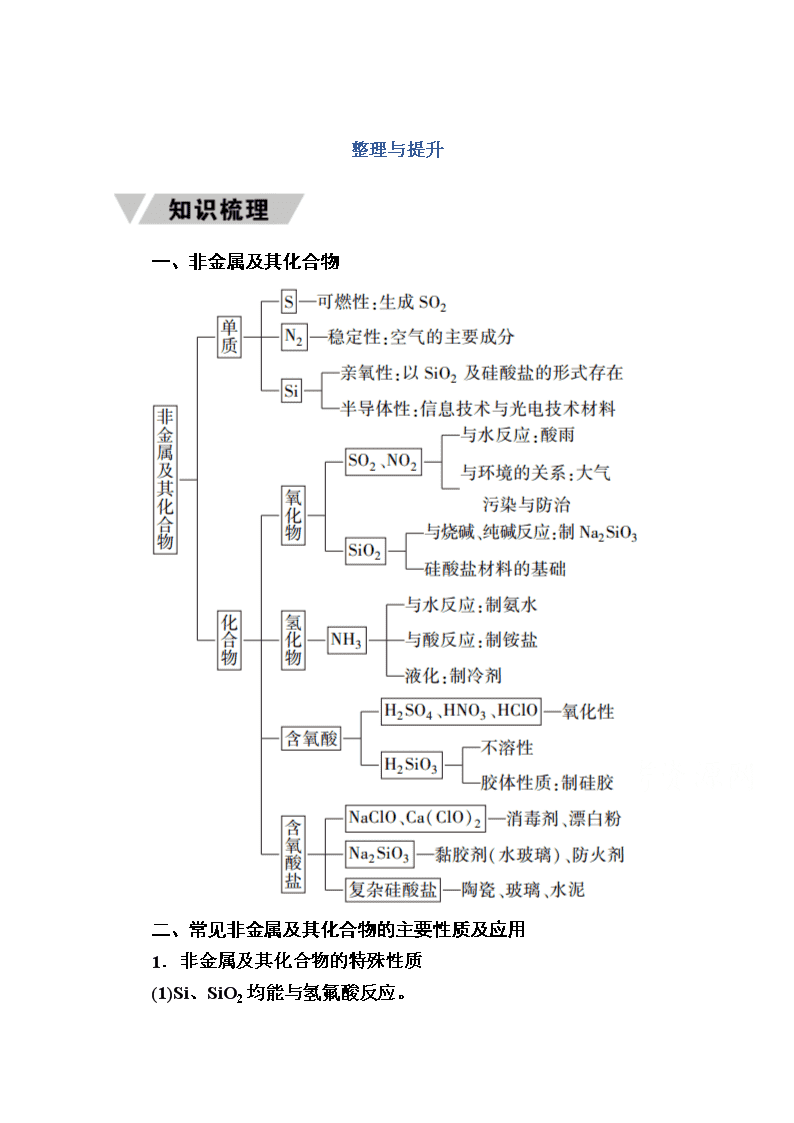
www.ks5u.com 整理与提升 一、非金属及其化合物 二、常见非金属及其化合物的主要性质及应用 1.非金属及其化合物的特殊性质 (1)Si、SiO2均能与氢氟酸反应。 (2)氯水具有多种性质:酸性、漂白性、强氧化性。 (3)SO2具有漂白性、较强的还原性,可被卤水、酸性KMnO4氧化。 (4)浓硫酸具有三大特性:吸水性、脱水性、强氧化性。 (5)NH3的水溶液呈碱性。 (6)稀硝酸、浓硝酸都具有强氧化性,与金属反应均不生成H2。 (7)硅酸的酸性弱于碳酸,但可发生反应 SiO2+Na2CO3Na2SiO3+CO2↑,SiO2+CaCO3 CaSiO3+CO2↑。 2.特征反应 (1)特征反应条件 (2)同一反应,条件不同,产物不同 ①浓度不同,产物不同 如稀硝酸与Cu反应生成NO,浓硝酸与Cu反应生成NO2。 ②温度不同,产物不同 如氯气与NaOH溶液,常温下生成NaClO,加热时生成NaClO3。 3.特征转化关系 一、实验室中气体的制备、净化收集及尾气处理 1.气体的发生装置 (1)加热固体药品制取气体(图①),如制取氨气。 (2)固体与液体反应不加热制取气体(图②),如制取二氧化碳。 (3)固体与液体或液体与液体反应加热制取气体(图③),如制取氯气。 2.气体的净化干燥装置 结合气体杂质的性质,如果想用液体试剂来除杂就选用图A装置,如果想用固体试剂来除杂就选用图B、C装置。 3.气体的收集装置 气体的收集装置的选择要根据气体的水溶性是否与氧气反应及气体的密度。一般有排空气法、排液(水)法,也可将气体直接装入贮气袋中。 (1)排空气法: (2)排液(水)法: 4.尾气处理装置 对于有毒或对空气有污染的气体,要进行尾气处理。结合气体的性质可以选择用吸收剂吸收、燃烧或装袋集中处理的方法。 1.如图中a、b、c表示相应仪器中加入的试剂,可用图中装置制取、净化、收集的气体是( B ) 编号 气体 a b c A NH3 浓氨水 生石灰 碱石灰 B CO2 盐酸 碳酸钙 饱和NaHCO3溶液 C NO 稀硝酸 铜屑 H2O D NO2 浓硝酸 铜屑 NaOH溶液 解析:A项NH3应采用向下排空气法收集,且固体干燥剂一般用干燥管或U形管盛装;B项,CaCO3+2HCl===CaCl2+CO2↑+H2O,CO2中的HCl可用饱和NaHCO3溶液除去,并用向上排空气法收集CO2;C项,NO不能用排空气法收集;D项,NO2能被NaOH溶液吸收。 二、氮的氧化物溶于水的计算方法 NO2和NO有如下反应: 3NO2+H2O===2HNO3+NO① 2NO+O2===2NO2② 4NO2+O2+2H2O===4HNO3③ 4NO+3O2+2H2O===4HNO3④ 1.NO和NO2的混合气体 NO、NO2的混合气体溶于水时仅涉及反应①: 可利用气体体积变化差值进行计算 V剩=V(NO)原+V(NO2) 2.NO2和O2的混合气体 NO2和O2的混合气体溶于水时涉及反应③: 其计算如下表: x= 0查看更多