- 2021-07-08 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019-2020学年山东省济南市历城二中高一(上)期末化学试卷
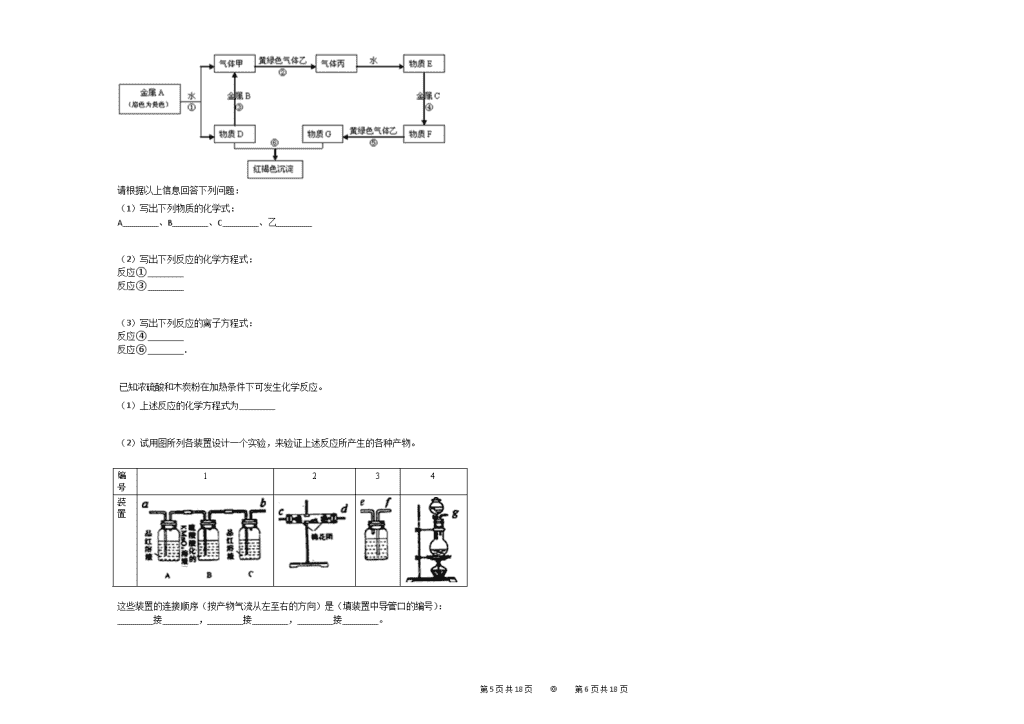
2019-2020学年山东省济南市历城二中高一(上)期末化学试卷 一、选择题(共20小题,每小题3分,满分60分) 1. 保护环境是每一个公民的责任和义务.下列做法中,有利于保护环境的是( ) ①在农田中焚烧植物秸秆;②城市生活污水处理后排放;③推广使用燃煤脱硫技术,防治SO2污染;④限制使用一次性塑料方便袋;⑤集中掩埋废旧电池. A.①②③ B.②③④ C.①②⑤ D.①④⑤ 2. 苹果汁是人们常喝的饮料,此饮料中含有Fe2+,现榨的苹果汁在空气中会由淡绿色变为棕黄色,若榨汁时加入维生素C,可有效防止这种现象发生.这说明维生素C具有( ) A.氧化性 B.还原性 C.碱性 D.酸性 3. 用NA表示阿伏加德罗常数的值,下列叙述中正确的是( ) A.常温常压下,11.2 L CO和CO2混合气体中含有的碳原子数目为0.5NA B.标准状况下,7.1 g氯气与足量氢氧化钠溶液反应转移的电子数为2NA C.92 g NO2和N2O4的混合气体中含有的原子总数为6NA D.100 g 17%的氨水,溶液中含有的NH3分子数为NA 4. 下列反应中属于氧化还原反应,且水作为氧化剂的是( ) A.Cl2+H2O=HCl+HClO B.2Na+2H2O=2NaOH+H2↑ C.2F2+2H2O=4HF+O2 D.2Na2O2+2H2O=4NaOH+O2↑ 5. “纳米材料”是指微粒直径为几纳米(1nm=1×10−9m)到几十纳米的材料.如将不同纳米材料分散到水中,得到的分散系具有的性质中,不可能有下列的( ) A.一定能通过半透膜 B.一定能通过滤纸 C.有丁达尔现象 D.有电泳现象 6. 在0.5L某浓度的NaCl溶液中含有0.5molNa+,下列对该溶液的说法中,正确的是( ) A.该溶液中含有58.5gNaCl B.配制100mL该溶液需用托盘天平称取5.85gNaCl C.量取100mL该溶液倒入烧杯中,烧杯中Na+的物质的量为0.1mol D.将0.5molNaCl溶于0.5L水中可得到该溶液 7. 下列状态的物质,既能导电又属于电解质的是( ) A.NaCl溶液 B.液态 HCl C.熔融的KOH D.铜 8. 试管中盛有少量白色固体,确认其是铵盐的方法是( ) A.加水,将湿润的红色石蕊试纸放在试管口 B.加氢氧化钠溶液,加热,滴入紫色石蕊试剂 C.加氢氧化钠溶液,加热,滴入酚酞试剂 D.加氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在试管口 9. 下列化学反应的离子方程式正确的是( ) A.用小苏打治疗胃酸过多:HCO3−+H+=CO2↑+H2O B.往碳酸钙粉末上滴加稀盐酸:CO32−+2H+=CO2↑+H2O C.少量金属钠放入水中:Na+2H2O=Na++20H−+H2 D.将二氧化碳气体通入澄清石灰水中:20H−+CO2=CO32−+H2O 10. 被称为万能还原剂的NaBH4溶于水并和水反应:NaBH4+2H2O=NaBO2+4H2↑,下列说法中正确的是(NaBH4中H为−1价)( ) A.NaBH4既是氧化剂又是还原剂 B.NaBH4是氧化剂,H2O是还原剂 C.NaBH4中硼元素被氧化,氢元素被还原 D.被氧化的元素与被还原的元素质量之比为1:1 11. 下列实验能达到预期目的是( ) A.向某无色溶液中加BaCl2溶液产生白色沉淀,说明原溶液中一定有SO42− B.向某无色溶液中加入盐酸,有无色无味的气体产生,则说明原溶液中-定有CO32− C.向某溶液中滴加KSCN溶液,溶液不变红,再滴加氯水,溶液变红,说明原溶液有Fe2+ D.配制一定物质的量的浓度溶液定容时,用胶头滴管向容量瓶里逐滴加入蒸馏水,到凹液面恰好与刻线相切 12. 某碳酸钠和碳酸氢钠的混合物跟足量盐酸反应,消耗H+和产生CO2的物质的量之比为5:4,该混合物中碳酸钠和碳酸氢钠的物质的量之比为( ) A.1:3 B.2:3 C.3:4 D.4:5 13. 下列各种物质中,常温下能持续发生反应,且产生多量气体的是( ) A.铁跟浓硫酸 B.碳跟稀硫酸 C.铜跟稀盐酸 D.铜跟浓硝酸 第17页 共18页 ◎ 第18页 共18页 14. 现有下列反应式,据两式判断,下列各组离子中,还原性由强到弱的排列顺序正确的是( ) (1)2Fe3++2I−=2Fe2++I2 (2)Br2+2Fe2+=2Fe3++2Br−. A.Br−>Fe2+>I− B.I−>Fe2+>Br− C.Br−>I−>Fe2+ D.Fe2+>I−>Br− 15. 下列各组离子中,能在溶液中大量共存的是( ) A.Na+、Cu2+、Cl−、OH− B.H+、Ca2+、HCO3−、NO3− C.Fe2+、H+、SO42−、NO3− D.Na+、CO32−、OH−、K+ 16. 下列各组反应中,硝酸既表现了氧化性,又表现了酸性的是( ) A.C+HNO3 B.H2S+HNO3 C.Fe(OH)3+HNO3 D.Cu+HNO3 17. 把SO2通入下列各组物质的混合溶液中,肯定有白色沉淀生成的是( ) A.Ba(NO3)2,HCl B.BaCl2,NaCl C.NH3⋅H2O,CaCl2 D.MgCl2,(NH4)2SO4 18. 在标准状况下,有同质量的SO2和SO3,则下列各项说法中,正确的是( ) A.所占体积相同 B.含硫原子数比为1:1 C.含硫元素的质量比为5:4 D.含氧原子个数比为2:3 19. 把4.48L CO2通过一定量的固体过氧化钠后收集到3.36L气体(气体的测量均在标准状况下),则这3.36L气体的质量是( ) A.6.0g B.5.6g C.4.8g D.3.8g 20. 下列各组中,浓度均为0.1mol⋅L−1的三种物质的溶液等体积混合,充分反应后,没有沉淀物质存在的一组是( ) A.BaCl2溶液、NaNO3溶液、AgNO3溶液 B.Ba(OH)2溶液、CuCl2溶液、Na2SO4溶液 C.FeCl3 溶液、NaCl 溶液、NaOH溶液 D.Na2CO3溶液、FeCl2溶液、H2SO4溶液 二、(本题包括5小题,共40分) (1)在12g某二价金属的硫酸盐中,含有0.4mol氧原子,此硫酸盐的摩尔质量为________g⋅mol−1. (2)质量分数为49%的硫酸溶液,其密度为1.8g/cm3,则其物质的量浓度为________mol⋅L−1. 将铁粉、铜粉、氯化铁溶液、氯化亚铁溶液和氯化铜溶液,混合于容积合适的烧杯内,充分反应后,试填写下列空白。 (1)若铁粉有剩余,则溶液中不可能含有的离子是________(从Fe3+、Cu2+、Fe2+中选填)。 (2)若溶液中氯化铁和氯化铜都有剩余,则不可能有的金属单质是________(从Fe、Cu中选填)。 (3)若铜粉有剩余,溶液中不可能含有的离子是________(从Fe3+、Cu2+、Fe2+中选填) 对于氨气的催化氧化反应:4NH3+502=4NO+6H2O (1)该反应中的还原剂是________,被还原的元素是________; (2)用单线桥标出该反应中电子转移的方向和数目;4NH3+502=4NO+6H2O________ (3)若反应转移了2mol电子,则产生的气体在标准状态下体积约为________。 (1)某实验需要1mol/LNaOH溶液500mL.配制该溶液所需要的玻璃仪器有烧杯、玻璃棒、________和________。 配制实验操作步骤有: a.在天平上称量NaOH固体,加水溶解,冷却至室温。 b.把制得的溶液小心地注入一定容积容量瓶中。 c.继续向容量瓶中加水至距刻度线lcm〜2cm处,改用胶头滴管加水至刻度线。 d.用少量水洗涤烧杯和玻璃棒2〜3次,每次将洗涤液转入容量瓶,并摇匀。 e.将容量瓶塞塞紧,充分摇匀。填写下列空白: (2)操作步骤和正确顺序为________。 (3)该配制过程中两次用到玻璃棒,其作用分别是________,________。 (4)定容时,若俯视刻度线,会使结果________(填“偏高”、“偏低”或“无影响”)。 现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出). 第17页 共18页 ◎ 第18页 共18页 请根据以上信息回答下列问题: (1)写出下列物质的化学式: A________、B________、C________、乙________ (2)写出下列反应的化学方程式: 反应①________ 反应③________ (3)写出下列反应的离子方程式: 反应④________ 反应⑥________. 已知浓硫酸和木炭粉在加热条件下可发生化学反应。 (1)上述反应的化学方程式为________ (2)试用图所列各装置设计一个实验,来验证上述反应所产生的各种产物。 编号 1 2 3 4 装置 这些装置的连接顺序(按产物气流从左至右的方向)是(填装置中导管口的编号): ________接________,________接________,________接________。 第17页 共18页 ◎ 第18页 共18页 参考答案与试题解析 2019-2020学年山东省济南市历城二中高一(上)期末化学试卷 一、选择题(共20小题,每小题3分,满分60分) 1. 【答案】 B 【考点】 常见的生活环境的污染及治理 【解析】 ①焚烧植物秸秆能产生大量有害物质判断; ②根据水污染的来源判断; ③根据防止空气污染的措施判断; ④树木能通过光合作用吸收二氧化碳,减缓温室效应,同时生产一次性筷子需要消耗能源; ⑤掩埋废旧电池会污染土壤和水资源. 【解答】 ①焚烧植物秸秆能产生大量有害物质判断,如产生大量黑烟、CO、CO2等,故①错误; ②城市生活含有大量有害物质,如不处理直接排放会污染水源,故②正确; ③SO2污染空气导致酸雨,推广使用燃煤脱硫技术可减少SO2的排放,故③正确; ④树木能通过光合作用吸收二氧化碳,减缓温室效应,同时生产一次性筷子需要消耗能源,故④正确; ⑤废旧电池中含有大量的重金属,掩埋废旧电池会污染土壤和水资源,故⑤错误。 2. 【答案】 B 【考点】 氧化还原反应 【解析】 根据苹果汁在空气中会由淡绿色变为棕黄色,可知铁元素的化合价升高被氧化,而加入维生素C,能使铁元素的化合价降低,并利用氧化还原反应来分析. 【解答】 在空气中,氧气能够把+2价铁氧化成+3价,而加入维生素C则能防止这种氧化,说明维生素C具有还原性,与三价铁发生氧化还原反应,故选B. 3. 【答案】 C 【考点】 阿伏加德罗常数 【解析】 A、常温常压下气体摩尔体积大于22.4L/mol; B、求出氯气的物质的量,然后根据1mol氯气与氢氧化钠转移1mol电子来分析; C、NO2和N2O4的最简式均为NO2; D、氨水中存在平衡:NH3+H2O⇌NH3⋅H2O; 【解答】 A、常温常压下气体摩尔体积大于22.4L/mol,故11.2L混合物的物质的量小于0.5mol,则含有的碳原子个数小于0.5NA个,故A错误; B、7.1g氯气的物质的量为0.1mol,而1mol氯气与氢氧化钠转移1mol电子,故0.1mol氯气中转移0.1mol电子即0.1NA个,故B错误; C、NO2和N2O4的最简式均为NO2,故92g混合物中含有的NO2的物质的量为2mol,则含有6mol原子即6NA个,故C正确; D、氨水中存在平衡:NH3+H2O⇌NH3⋅H2O,故溶液中含有的氨气分子个数小于NA个,故D错误。 4. 【答案】 B 【考点】 氧化还原反应 【解析】 有元素化合价变化的反应是氧化还原反应,化合价降低元素所在的反应物是氧化剂. 【解答】 A、反应物水中氢、氧元素的化合价均未发生变化,水既不是氧化剂也不是还原剂,故A错误; B、2Na+2H2O=2NaOH+H2↑中,Na元素的化合价升高,H元素的化合价降低,属于氧化还原反应,且水作氧化剂,故B正确; C、水中的氧元素化合价升高,所以水作还原剂,故C错误; D、过氧化钠与水的反应中发生化合价变化的只有过氧化钠中的氧元素,水中氢、氧元素的化合价均未发生变化,水既不是氧化剂也不是还原剂,故D错误。 5. 【答案】 A 【考点】 分散系、胶体与溶液的概念及关系 【解析】 根据胶体的性质判断, 【解答】 胶体有以下性质: 1、胶体能产生丁达尔效应; 2、能透过滤纸不能透过半透膜; 3、胶粒带有电荷,能产生电泳现象; 6. 【答案】 C 【考点】 物质的量浓度的相关计算 【解析】 0.5L某浓度的NaCl溶液中含有0.5mol Na+,钠离子浓度为0.5mol0.5L=1mol/L, A、钠离子物质的量等于氯化钠的物质的量,根据m=nM计算判断; B、托盘天平只能读到小数点后一位; C、根据n=cV计算; D、将0.5molNaCl溶于0.5L水中,所得溶液的体积不是0.5L。 第17页 共18页 ◎ 第18页 共18页 【解答】 A.该溶液中含有NaCl的质量为1.0mol/L×0.5L×58.5g/mol=29.25g,故A错误; B.托盘天平只能读到小数点后一位,故B错误; C.量取100mL该溶液倒入烧杯中,烧杯中Na+的物质的量n=cV=1.0mol/L×0.1L=0.1mol,故C正确; D.将0.5molNaCl溶于0.5L水中,所得溶液的体积不是0.5L,所以溶液的浓度不是1.0mol/L,故D错误。 7. 【答案】 C 【考点】 电解质与非电解质 【解析】 在水溶液或熔化状态下能导电的化合物为电解质,而存在自由移动的离子或电子的物质能导电,以此来解答. 【解答】 A.氯化钠溶液导电,属于电解质溶液,是混合物不是电解质,故A错误; B.液态的氯化氢溶于水导电,本身不能电离出自由移动的电子,不能导电,HCl是电解质,故B错误; C.熔融的KOH为电解质,有自由移动的离子能导电,故C正确; D、铜能导电,但是单质不是化合物,不是电解质,故D错误; 8. 【答案】 D 【考点】 铵盐 【解析】 A.铵盐和水混合不会产生氨气; B.氢氧化钠和氨水均能使石蕊试液显示蓝色; C.氢氧化钠和氨水均能使酚酞显示红色; D.氨气具有碱性,能使湿润的红色石蕊试纸变蓝; 【解答】 A.铵盐和水混合不会产生氨气,将湿润的红色石蕊试纸放在试管口无任何变化,不能检验,故A错误; B.氢氧化钠和氨水均是碱性的,均能使石蕊试液显示蓝色,如果氢氧化钠相对于氨水过量则会干扰检验,故B错误; C.氢氧化钠和氨水均是碱性,氢氧化钠会干扰氨气的检验,故C错误; D.铵根离子与碱反应生成氨气,氨气具有碱性,能使湿润的红色石蕊试纸变蓝,故D正确; 9. 【答案】 A 【考点】 离子方程式的书写 【解析】 A.二者反应生成氯化钠和水、二氧化碳; B.碳酸钙为沉淀,应保留化学式; C.电荷不守恒; D.二者反应生成碳酸钙和水。 【解答】 A.用小苏打治疗胃酸过多,离子方程式:HCO3−+H+=CO2↑+H2O,故A正确; B.往碳酸钙粉末上滴加稀盐酸,离子方程式:CaCO3+2H+=CO2↑+H2O+Ca2+,故B错误; C.少量金属钠放入水中,离子方程式:2Na+2H2O=2Na++20H−+H2↑,故C错误; D.将二氧化碳气体通入澄清石灰水中:Ca2++20H−+CO2=CaCO3↓+H2O,故D错误; 10. 【答案】 D 【考点】 氧化还原反应 【解析】 在NaBH4+2H2O=NaBO2+4H2↑反应中,NaBH4中H元素的化合价为−1价,H2O中H元素的化合价为+1价,二者发生氧化还原反应,其中NaBH4是还原剂,H2O是氧化剂. 【解答】 在NaBH4+2H2O=NaBO2+4H2↑反应中,NaBH4中H元素的化合价为−1价,H2O中H元素的化合价为+1价,二者发生氧化还原反应,其中NaBH4是还原剂,H2O是氧化剂, 反应中B元素的化合价没有发生变化,反应中氧化剂和还原剂中化合价变化的数值相等,则被氧化的元素与被还原的元素质量比为1:1, 11. 【答案】 C 【考点】 常见离子的检验 【解析】 A.白色沉淀可能为氯化银或硫酸钡; B.该气体为二氧化碳,能够与稀盐酸反应生成二氧化碳的离子不一定为碳酸根离子; C.三价铁离子遇到硫氰酸根会生成血红色溶液,用于三价铁离子的检验; D.定容时,当液面离刻度线1∼2cm处,改用胶头滴管加蒸馏水。 【解答】 A.向某无色溶液中加BaCl2溶液产生白色沉淀,原溶液中可能有SO42−,可能有Ag+等,故A错误; B.向某无色溶液中加入盐酸,有无色无味的气体产生,该气体为二氧化碳,原溶液中可能有CO32−,可能有HCO3−,故B错误; C.向某溶液中滴加KSCN溶液,溶液不变红,说明溶液中不含有Fe3+,再滴加氯水,溶液变红,则此时溶液中含有Fe3+,从而说明原溶液中含有Fe2+,故C正确; D.定容时,当液面离刻度线1∼2cm处,改用胶头滴管加蒸馏水,到凹液面恰好与刻线相切,故D错误。 12. 【答案】 A 【考点】 有关混合物反应的计算 钠的重要化合物 【解析】 令碳酸钠和碳酸氢钠的物质的量分别为xmol、ymol,根据碳元素守恒表示出二氧化碳的物质的量,故方程式可知碳酸钠与盐酸按1:2反应,碳酸氢钠与盐酸按1:1反应,据此表示出消耗的氢离子物质的量,再根据消耗H+和产生CO2的物质的量之比为5:4解答. 【解答】 解:令碳酸钠和碳酸氢钠的物质的量分别为xmol、ymol, 第17页 共18页 ◎ 第18页 共18页 根据碳元素守恒可知,n(CO2)=(x+y)mol, 由化学方程式可知碳酸钠与盐酸按1:2反应,碳酸氢钠与盐酸按1:1反应,故消耗n(H+)=2xmol+ymol=(2x+y)mol, 消耗H+和产生CO2的物质的量之比为5:4,则:(2x+y)mol:(x+y)mol=5:4,整理得x:y=1:3, 故选A. 13. 【答案】 D 【考点】 浓硫酸的性质 硝酸的化学性质 【解析】 A.常温下铁跟浓硫酸发生钝化反应; B.碳和稀硫酸不反应; C.铜和稀盐酸不反应; D.常温下,铜和浓硝酸反应. 【解答】 A.常温下铁跟浓硫酸发生钝化反应,不能持续发生反应且产生多量气体,故A错误; B.稀硫酸氧化性较弱,与碳不反应,故B错误; C.铜为不活泼金属,不与盐酸反应,故C错误; D.浓硝酸具有强氧化性,在常温下就能与铜反应生成二氧化氮气体,能持续发生反应且产生多量气体,故D正确。 14. 【答案】 B 【考点】 氧化性、还原性强弱的比较 【解析】 根据元素的化合价升高来判断还原剂,利用氧化还原反应中还原剂的还原性大于还原产物的还原性来解答. 【解答】 2Fe3++2I−=2Fe2++I2中,I元素的化合价升高,由还原剂的还原性大于还原产物的还原性,则还原性I−>Fe2+, Br2+2Fe2+=2Fe3++2Br−中,Fe元素的化合价升高,由还原剂的还原性大于还原产物的还原性,则还原性Fe2+>Br−, 所以离子的还原性由强到弱的顺序为I−>Fe2+>Br−, 15. 【答案】 D 【考点】 离子共存问题 【解析】 根据离子的性质,判断离子之间是否发生复分解反应、络合反应、氧化还原反应以及相互促进的水解反应,如不反应,则能共存. 【解答】 A.Cu2+与OH−反应生成Cu(OH)2沉淀而不能大量共存,故A错误; B.H+与HCO3−反应生成CO2气体,不能共存,故B错误; C.在酸性条件下Fe2+与NO3−发生氧化还原反应而不能大量共存,故C错误; D.离子之间不发生任何类型的反应,能大量共存,故D正确。 16. 【答案】 D 【考点】 硝酸的化学性质 【解析】 根据硝酸中N元素的化合价降低,则表现氧化性,生成硝酸盐,则表现酸性,以此来解答. 【解答】 A、C+HNO3中N元素的化合价全由+5降低为+4,则只表现硝酸的氧化性,故A错误; B、H2S+HNO3中N元素的化合价全由+5降低为+4,则只表现硝酸的氧化性,故B错误; C、Fe(OH)3+HNO3中各元素的化合价在反应前后不变,生成硝酸铁,只表现酸性,故C错误; D、Cu+HNO3中N元素部分化合价降低,部分不变,化合价降低时表现氧化性,生成硝酸铜时表现酸性,故D正确; 17. 【答案】 A 【考点】 二氧化硫的化学性质 【解析】 A.SO2通入Ba(NO3)2、HCl溶液中,发生氧化还原反应生成硫酸钡沉淀; B.亚硫酸酸性比盐酸弱,除去SO2与水反应外,物质之间均不发生反应,不生成沉淀; C.如二氧化硫过量,则生成亚硫酸氢钙; D.亚硫酸酸性比硫酸弱,除去SO2与水反应外,物质之间均不发生反应,不生成沉淀。 【解答】 A.SO2通入Ba(NO3)2、HCl溶液中,反应为:3SO2+2NO3−+2H2O=3SO42−+2NO+4H+,Ba2++SO42−=BaSO4↓,发生氧化还原反应生成硫酸钡沉淀,故A选; B.SO2通入BaCl2、NaCl混合溶液中,除去SO2与水反应外,没有沉淀反应发生,故B不选; C.若少量SO2通入NH3⋅H2O、CaCl2混合溶液中,会生成CaSO3白色沉淀,但若SO2过量,则起初生成的CaSO3又会溶解,生成Ca(HSO3)2,故C不选; D.SO2通入MgCl2、(NH4)2SO4混合溶液中,除去SO2与水反应外,没有沉淀反应发生,故D不选; 18. 【答案】 C 【考点】 物质的量的相关计算 阿伏加德罗定律及推论 【解析】 根据n=NNA=mM=VVm结合SO2和SO3的分子组成计算. 【解答】 A、在标准状况下,SO2为气体,SO3为液体,二者体积不同,故A错误; B、设质量都为mg,则相同质量时,n(SO2):n(SO3)=m64:m80=5:4,含硫原子数比为5:4,故B错误; C、设质量都为mg,则相同质量时,n(SO2):n(SO3)=m64:m80=5:4 第17页 共18页 ◎ 第18页 共18页 ,含硫元素的质量比为5:4,故C正确; D、设质量都为mg,则相同质量时,n(SO2):n(SO3)=m64:m80=5:4,含氧原子个数比为(5×2):(4×3)=5:6,故D错误。 19. 【答案】 A 【考点】 钠的重要化合物 化学方程式的有关计算 【解析】 根据气体的体积差,通过差量法计算参加反应的二氧化碳体积、生成的氧气的体积,判断3.36L气体的组成及各成分的体积,再根据n=VVm计算各组分气体的物质的量,利用m=nM计算质量. 【解答】 令参加反应的CO2气体的体积为a,生成的O2的体积为b,则: 2CO2+2Na2O2=2Na2CO3+O2,气体体积减小△V 2 1 1 a b 4.48L−3.36L=1.12L 解得:a=2.24L,b=1.12L, 生成氧气的体积1.12L,小于3.36L,故二氧化碳有剩余, 所以:3.36L气体中CO2体积为4.48L−2.24L=2.24L,O2的体积为1.12L, 所以4.48L气体的质量为2.24L22.4L/mol×44g/mol+1.12L22.4L/mol×32g/mol=6.0g。 20. 【答案】 D 【考点】 离子反应发生的条件 【解析】 三种物质等浓度等体积的混合,说明三种物质的物质的量相等,充分反应后没有沉淀生成,说明溶液中的溶质都是可溶性的. 【解答】 A.氯离子和银离子反应生成难溶性的氯化银沉淀,所以有沉淀生成,故A错误; B.钡离子和硫酸根离子反应生成难溶性的硫酸钡沉淀,铜离子和氢氧根离子反应生成氢氧化铜蓝色沉淀,所以有沉淀生成,故B错误; C.铁离子和氢氧根离子反应生成难溶性的氢氧化铁沉淀,所以有沉淀生成,故C错误; D.等物质的量的硫酸和碳酸钠恰好反应生成硫酸钠、水和二氧化碳,氯化亚铁和硫酸钠不反应,所以充分反应后没有沉淀生成,故D正确; 二、(本题包括5小题,共40分) 【答案】 120 9 【考点】 物质的量的相关计算 物质的量浓度的相关计算 【解析】 (1)二价金属的硫酸盐的物质的量等于硫酸根的物质的量,n(SO42−)=14n(O),再根据M=mn计算; (2)根据c=1000ρωM计算该硫酸的物质的量浓度. 【解答】 n(SO42−)=14n(O)=14×0.4mol=0.1mol,二价金属的硫酸盐的物质的量等于硫酸根的物质的量为0.1mol,故该硫酸盐的摩尔质量为12g0.1mol=120g/mol, 故答案为:120; 质量分数为49%的硫酸溶液,其密度为1.8g/cm3,该硫酸的物质的量浓度c=1000ρωM=1000×1.8×49%98mol/L=9mol/L, 故答案为:9. 【答案】 Fe3+、Cu2+ Cu、Fe Fe3+ 【考点】 铁的化学性质 【解析】 根据反应的先后顺序:先是铁与氯化铁反应,接着是铁与氯化铜反应,最后是铜与氯化铁反应。 【解答】 铁粉有剩余,根据反应顺序判断:氯化铁、氯化铜已全部反应,铜未反应,溶液中只有氯化亚铁,即溶液中只有Fe2+,故答案为:(1)Fe3+、Cu2+; 溶液中氯化铁和氯化铜都有剩余,根据反应顺序判断:Cu、Fe已全部反应,故答案为:Cu、Fe; 铜粉有剩余,根据反应顺序判断:铁已完全反应,一定有氯化亚铁,可能有氯化铜,不可能有氯化铁, 故答案为:Fe3+。 【答案】 NH3(氨气),O(氧或氧元素) 8.96L 【考点】 氧化还原反应的计算 【解析】 反应4NH3+502=4NO+6H2O中,NH3的−3价N元素升高到+2价,O2中的O元素由0价降低到−2价。 (1)该反应中,还原剂是含有化合价降低元素的反应物,被还原的元素是反应物中化合价降低的元素; (2)用单线桥标出该反应中的电子转移方向,是从反应物中化合价升高元素指向化合价降低元素,数目是得电子总数或失电子总数; 第17页 共18页 ◎ 第18页 共18页 (3)确定本反应的电子转移数目,然后建立NO与电子转移数目关系式,利用反应转移的2mol电子,算出生成NO的物质的量,从而算出其在标准状态下体积。 【解答】 该反应中,NH3的−3价N元素升高到+2价,O2中的O元素由0价降低到−2价,还原剂是含有化合价降低元素的反应物,则还原剂是NH3(氨气),被还原的元素是反应物中化合价降低的O(氧或氧元素)素; 故答案为:NH3(氨气);O(氧或氧元素); 反应4NH3+502=4NO+6H2O中,NH3的−3价N元素升高到+2价,O2中的O元素由0价降低到−2价,用单线桥标出该反应中的电子转移和数目为, 故答案为:; 由可得关系式:NO∼5e−,若反应转移了2mol电子子,则n(NO)=2mol5=0.4mol,产生的气体在标准状态下体积约:V(NO)=0.4mol×22.4L/mol=8.96L, 故答案为:8.96L。 【答案】 500ml容量瓶,胶头滴管 abdce 搅拌,引流 偏高 【考点】 配制一定物质的量浓度的溶液 【解析】 (1)根据配制步骤是计算、称量、溶解、洗涤、定容、摇匀、装瓶来分析需要的仪器,依据容量瓶规格及所配溶液体积选择合适容量瓶; (2)配制一定物质的量浓度溶液的基本操作步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等,据此排序; (3)该配制过程中,溶解和移液两次用到玻璃棒,溶解操作用玻璃棒搅拌,移液操作用玻璃棒引流; (4)定容时,若俯视刻度线,则溶液的液面低于刻度线,依据c=nV进行误差分析。 【解答】 配制一定物质的量浓度溶液的操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解。冷却后转移到容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2−3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1∼2cm时,改用胶头滴管滴加,最后定容颠倒摇匀。所以所需仪器有托盘天平、烧杯、玻璃棒、容量瓶、胶头滴管,配制1mol/LNaOH溶液500mL,应选择500mL容量瓶,故所需的仪器还有510mL容量瓶和胶头滴管, 故答案为:250mL容量瓶、胶头滴管; 配制一定物质的量浓度溶液的基本操作步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等,所以正确的操作顺序为:abdce; 故答案为:abdce; 该配制过程中,溶解和移液两次用到玻璃棒,溶解操作用玻璃棒搅拌,移液操作用玻璃棒引流; 故答案为:搅拌;引流; 定容时,若俯视刻度线导致溶液体积偏小,依据c=nV可知溶液浓度偏高; 故答案为:偏高。 【答案】 Na,Al,Fe,Cl2 2Na+2H2O=2NaOH+H2↑,2NaOH+2H2O+2Al=2NaAlO2+3H2↑ Fe+2H+=Fe2++H2↑,Fe3++30H−=Fe(OH)3↓ 【考点】 无机物的推断 【解析】 金属A焰色反应为黄色,故A为金属Na,乙是黄绿色气体,乙为Cl2,红褐色沉淀为Fe(OH)3; 由反应①Na→气体甲+D,为Na与水的反应,生成甲为H2,D为NaOH,由NaOH+金属B→H2可知,B为金属Al,由甲+乙→丙,故丙为HCl,HCl溶于水的物质E,故E为盐酸; G+NaOH→Fe(OH)3,G含有Fe3+,由E(盐酸)→CF→Cl2G可知,盐酸与金属C反应,生成的产物F还能继续与氯气反应,则金属B为变价金属,应为Fe,所以F为FeCl2,G为FeCl3,结合物质的性质解答该题. 【解答】 由以上分析可知,A为Na,B为Al,C为Fe,乙为Cl2,故答案为:Na;Al;Fe;Cl2; 反应①为钠和水的反应,生成氢氧化钠和氢气,反应的方程式为2Na+2H2O=2NaOH+H2↑, 反应③是铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应的方程式为2NaOH+2H2O+2Al=2NaAlO2+3H2↑, 故答案为:2Na+2H2O=2NaOH+H2↑;2NaOH+2H2O+2Al=2NaAlO2+3H2↑; 反应④为铁和盐酸的反应,生成氯化亚铁和氢气,反应的离子方程式为Fe+2H+=Fe2++H2↑, 反应⑥为氯化铁与氢氧化钠的反应,反应生成红褐色氢氧化铁沉淀,反应的离子方程式为Fe3++30H−=Fe(OH)3↓, 故答案为:Fe+2H+=Fe2++H2↑;Fe3++30H−=Fe(OH)3↓. 【答案】 C+2H2SO4(浓)△CO2↑+2SO2↑+2H2O g,c(或d),d(或c),a,b,f 【考点】 浓硫酸的性质实验 【解析】 (1)C与浓硫酸在加热条件下反应,生成二氧化碳、二氧化硫和水; (2)装置1的作用分别是检验SO2的存在、除去SO2、检验SO2是否除尽;装置2的作用是检验水蒸气的存在;装置3的作用是检验CO2的存在;装置4的作用是制取SO2,因为检验SO2、CO2都需经过溶液,所以检验反应产生的水蒸气,应在检验SO2、CO2之前进行,据此解答。 【解答】 第17页 共18页 ◎ 第18页 共18页 C与浓硫酸在加热条件下反应,生成CO2、SO2和水,该反应的化学方程式为:C+2H2SO4(浓)△CO2↑+2SO2↑+2H2O, 故答案为:C+2H2SO4(浓)△CO2↑+2SO2↑+2H2O; 装置1的作用分别是检验SO2的存在、除去SO2、检验SO2是否除尽;装置2的作用是检验水蒸气的存在;装置3的作用是检验CO2的存在;装置4的作用是制取SO2,因为检验SO2、CO2都需经过溶液,所以检验反应产生的水蒸气,应在检验SO2、CO2之前进行,则装置的连接顺序为:制取SO2、检验水蒸气的存在、检验SO2的存在、检验CO2的存在,由此确定仪器接口的连接顺序为:g接c(或d),d(或c)接a,b接f, 故答案为:g;c(或d);d(或c);a;b;f。 第17页 共18页 ◎ 第18页 共18页查看更多