- 2021-07-08 发布 |
- 37.5 KB |
- 13页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学一轮复习弱电解质的电离平衡学案
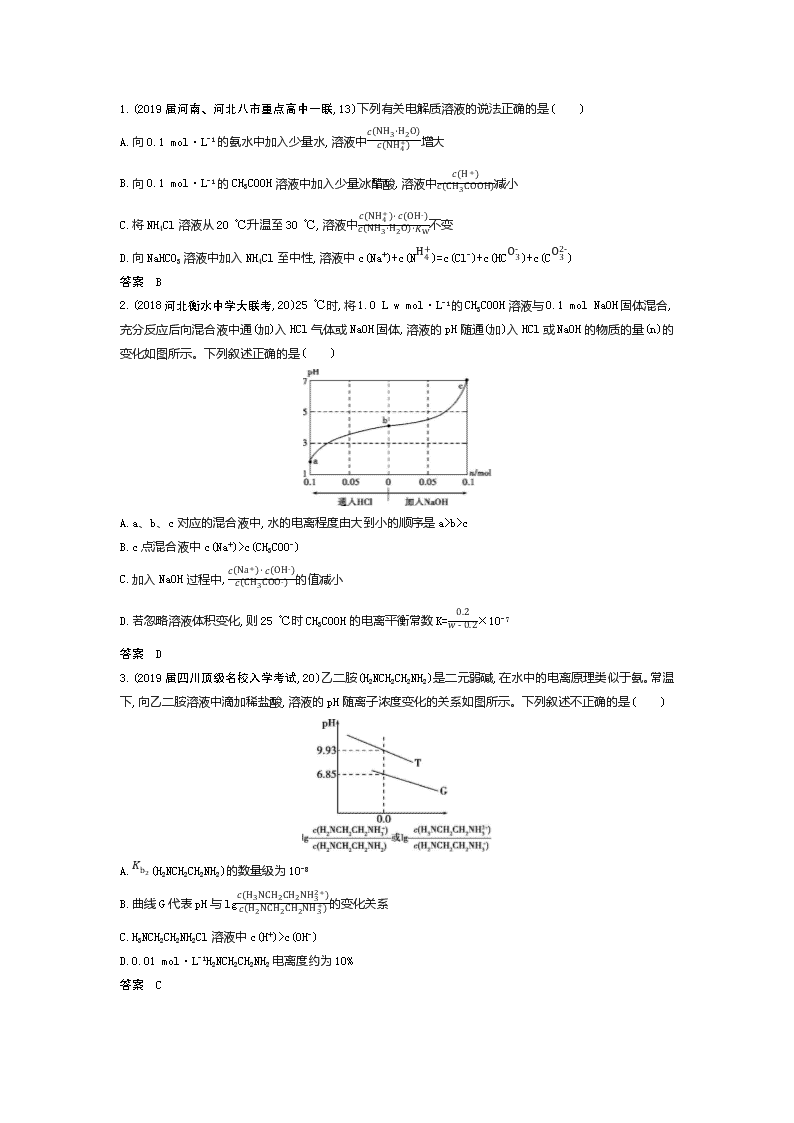
专题八 弱电解质的电离平衡 挖命题 【考情探究】 考点 内容解读 5年考情 预测热度 考题示例 难度 关联考点 弱电解质的电离平衡 1.理解弱电解质在水中的电离平衡 2.了解强电解质和弱电解质的概念 3.理解电解质在水中的电离以及电解质溶液的导电性 2015课标Ⅰ,13,6分 中 溶液碱性强弱的判断 ★★ 电离平衡常数及其应用 能利用电离平衡常数进行相关计算 2017课标Ⅱ,12,6分 中 溶液pH与c(H+)之间的换算 ★★ 分析解读 弱电解质的电离是中学化学基本理论中的重要组成部分,也是在学习中比较难理解的内容,更是近几年高考命题的必考内容,赋分一般为4~6分。命题形式以选择题或与中和反应及盐类水解相结合以主观题形式出现,高考命题热点主要有影响弱电解质电离平衡的因素,通过图像分析强、弱电解质,电离常数和电离度,比较微粒浓度大小和pH的相关计算等,命题时与水解相结合又增加了试题难度,预计在今后的高考中出现的几率仍较大。 【真题典例】 破考点 【考点集训】 考点一 弱电解质的电离平衡 1.(2019届山西顶级名校月考,6)下列说法正确的一组是( ) ①不溶于水的盐(CaCO3、BaSO4等)都是弱电解质 ②盐都是强电解质 ③所有0.5 mol·L-1的一元酸溶液中氢离子浓度都是0.5 mol·L-1 ④强酸溶液中氢离子浓度一定大于弱酸溶液中氢离子浓度 ⑤电解质溶液导电的原因是溶液中有自由移动的阴、阳离子 ⑥熔融的电解质都能导电 A.①③⑤⑥ B.②④⑤⑥ C.只有⑤ D.只有⑥ 答案 C 2.(2017山西五校一联,6)下列关于醋酸性质的描述,不能证明它是弱电解质的是( ) A.1 mol·L-1的醋酸溶液中H+浓度约为10-3 mol·L-1 B.醋酸溶液中存在CH3COOH分子 C.10 mL pH=1的醋酸溶液与足量锌粉反应生成H2 112 mL(标准状况) D.10 mL 0.1 mol·L-1的醋酸溶液与10 mL 0.1 mol·L-1的NaOH溶液恰好完全中和 答案 D 3.(2017河南信阳、三门峡联考,9)次磷酸(H3PO2)是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。下列有关说法正确的是( ) A.H3PO2溶于水的电离方程式为:H3PO2 H++H2PO2- B.H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2+3OH- PO23-+3H2O C.将H3PO2溶液加入酸性高锰酸钾溶液中,H3PO2的还原产物为H3PO4 D.用惰性电极电解NaH2PO2溶液,其阳极反应式为:2H2O-4e- O2↑+4H+ 答案 A 4.(2018浙江“七彩阳光”联盟期初联考,18)常温下,0.1 mol·L-1 BOH溶液的pH=10。下列说法正确的是( ) A.该溶液中c(H+)>c(OH-) B.该溶液中c(BOH)+c(B+)=0.1 mol·L-1 C.BOH的电离方程式为BOH B++OH- D.B2SO4溶液呈碱性 答案 B 5.(2017四川成都五校联考,13)能证明乙酸是弱酸的实验事实是( ) A.CH3COOH溶液与Zn反应放出H2 B.0.1 mol/L CH3COONa溶液的pH大于7 C.CH3COOH溶液与Na2CO3反应生成CO2 D.0.1 mol/L CH3COOH溶液可使紫色石蕊变红 答案 B 考点二 电离平衡常数及其应用 1.(2019届河南、河北八市重点高中一联,13)下列有关电解质溶液的说法正确的是( ) A.向0.1 mol·L-1的氨水中加入少量水,溶液中c(NH3·H2O)c(NH4+)增大 B.向0.1 mol·L-1的CH3COOH溶液中加入少量冰醋酸,溶液中c(H+)c(CH3COOH)减小 C.将NH4Cl溶液从20 ℃升温至30 ℃,溶液中c(NH4+)·c(OH-)c(NH3·H2O)·KW不变 D.向NaHCO3溶液中加入NH4Cl至中性,溶液中c(Na+)+c(NH4+)=c(Cl-)+c(HCO3-)+c(CO32-) 答案 B 2.(2018河北衡水中学大联考,20)25 ℃时,将1.0 L w mol·L-1的CH3COOH溶液与0.1 mol NaOH固体混合,充分反应后向混合液中通(加)入HCl气体或NaOH固体,溶液的pH随通(加)入HCl或NaOH的物质的量(n)的变化如图所示。下列叙述正确的是( ) A.a、b、c对应的混合液中,水的电离程度由大到小的顺序是a>b>c B.c点混合液中c(Na+)>c(CH3COO-) C.加入NaOH过程中,c(Na+)·c(OH-)c(CH3COO-)的值减小 D.若忽略溶液体积变化,则25 ℃时CH3COOH的电离平衡常数K=0.2w-0.2×10-7 答案 D 3.(2019届四川顶级名校入学考试,20)乙二胺(H2NCH2CH2NH2)是二元弱碱,在水中的电离原理类似于氨。常温下,向乙二胺溶液中滴加稀盐酸,溶液的pH随离子浓度变化的关系如图所示。下列叙述不正确的是( ) A.Kb2(H2NCH2CH2NH2)的数量级为10-8 B.曲线G代表pH与lgc(H3NCH2CH2NH32+)c(H2NCH2CH2NH3+)的变化关系 C.H3NCH2CH2NH2Cl溶液中c(H+)>c(OH-) D.0.01 mol·L-1H2NCH2CH2NH2电离度约为10% 答案 C 4.(2018河南豫北、豫南第二次联考,14)已知:25 ℃时,Kb(NH3·H2O)=1.8×10-5。该温度下,用0.100 mol·L-1的氨水滴定10.00 mL 0.100 mol·L-1的一元酸HA的溶液,滴定过程中加入氨水的体积(V)与溶液中lgc(H+)c(OH-)的关系如图所示。下列说法中不正确的是( ) A.HA为强酸 B.a=10 C.25 ℃时,NH4+的水解平衡常数为59×10-9 D.当滴入20 mL氨水时,溶液中存在c(NH4+)>c(A-) 答案 B 5.(2017湖南长沙长郡统考,16)已知下列有关信息: 弱酸 CH3COOH HCN H2CO3 电离平衡 常数(常温) K=1.8×10-5 K=4.9×10-10 K1=4.3×10-7 K2=5.6×10-11 Ksp(CaCO3)=2.8×10-9 下列判断正确的是( ) A.在Na2CO3溶液中滴入酚酞溶液,溶液变红,原因是CO32-+2H2O H2CO3+2OH- B.常温时,CH3COOH与CH3COONa的混合溶液pH=6,则c(CH3COOH)c(CH3COO-)=18 C.在NaHCO3溶液中,c(OH-)-c(H+)=c(H2CO3)-c(CO32-) D.浓度为2×10-4mol·L-1的Na2CO3溶液与CaCl2溶液等体积混合出现沉淀,则CaCl2溶液的浓度一定是5.6×10-5 mol·L-1 答案 C 炼技法 方法集训 方法 电解质强弱的判断方法 1.甲酸的下列性质中,可以证明它是弱电解质的是( ) A.1 mol·L-1的甲酸溶液中c(H+)=0.01 mol·L-1 B.甲酸能与水以任意比例互溶 C.10 mL 1 mol·L-1甲酸恰好与10 mL 1 mol·L-1 NaOH溶液完全反应 D.甲酸溶液的导电性比盐酸的弱 答案 A 2.(2018湖北荆州第一次质量检查,14)关于相同体积、pH均为3的醋酸溶液和盐酸,下列说法中正确的是( ) A.稀释至10倍后,两者的pH变化醋酸溶液大于盐酸 B.用同浓度的氢氧化钠溶液中和,消耗氢氧化钠的物质的量盐酸大于醋酸溶液 C.加入一定量的锌粉,产生气体的体积相同,则醋酸溶液一定过量 D.加入足量的锌粉,产生氢气的速率随时间的变化如图所示 答案 C 3.(2018广东揭阳学业水平考试,28)二氧化碳是导致温室效应的主要气体,其对应的水溶液是可乐等饮料的主要成分之一。回答下列问题: (1)下列事实中,能证明碳酸是弱酸的是 。 A.碳酸不稳定,易分解为二氧化碳和水 B.用氢氧化钠溶液中和等浓度的碳酸溶液,需要氢氧化钠溶液的体积是碳酸溶液体积的2倍 C.相同条件下,碳酸溶液的导电能力低于相同浓度的硫酸溶液 D.常温下,5.0×10-6 mol·L-1的碳酸溶液pH为6 (2)煤的燃烧也是导致温室效应的原因之一,其燃烧有下列两种途径: 途径Ⅰ:C(s)+O2(g)CO2(g) ΔH=Q1 kJ·mol-1 途径Ⅱ: 先制水煤气:C(s)+H2O(g) CO(g)+H2(g) ΔH=Q2 kJ·mol-1 再燃烧水煤气:CO(g)+12O2(g) CO2(g) ΔH=Q3 kJ·mol-1 H2(g)+12O2(g) H2O(g) ΔH=Q4 kJ·mol-1 则Q1、Q2、Q3、Q4的关系式是 。 (3)常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.6,c(H2CO3)=1.5×10-5 mol·L-1。 ①若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的平衡常数K1= ,该步电离的电离度α= (已知:10-5.6=2.5×10-6,保留一位小数); ②常温下,0.10 mol·L-1 NaHCO3溶液的pH等于8.0,则此时溶液中c(H2CO3) c(CO32-)(填“>”“=”或“<”),原因是 (用离子方程式和必要的文字说明); ③向饱和碳酸溶液中分别加入下列物质,能使碳酸的第一步电离平衡向右移动的是 。 A.HCl气体 B.NaOH固体 C.Na单质 D.苯酚钠溶液 答案 (1)CD (2)Q1=Q2+Q3+Q4 (3)①4.2×10-7 14.3% ②> HCO3- CO32-+H+、HCO3-+H2O H2CO3+OH-,HCO3-的水解程度大于其电离程度 ③BCD 过专题 【五年高考】 A组 统一命题·课标卷题组 考点一 弱电解质的电离平衡 (2015课标Ⅰ,13,6分)浓度均为0.10 mol·L-1、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lgVV0的变化如图所示。下列叙述错误的是( ) A.MOH的碱性强于ROH的碱性 B.ROH的电离程度:b点大于a点 C.若两溶液无限稀释,则它们的c(OH-)相等 D.当lgVV0=2时,若两溶液同时升高温度,则c(M+)c(R+)增大 答案 D 考点二 电离平衡常数及其应用 B组 自主命题·省(区、市)卷题组 考点一 弱电解质的电离平衡 1.(2018北京理综,8,6分)下列化学用语对事实的表述不正确的是( ) A.硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OHC17H35COOC2H5+H218O B.常温时,0.1 mol·L-1氨水的pH=11.1:NH3·H2ONH4++OH- C.由Na和Cl形成离子键的过程: D.电解精炼铜的阴极反应:Cu2++2e-Cu 答案 A 2.(2016北京理综,11,6分)在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。 下列分析不正确的是( ) A.①代表滴加H2SO4溶液的变化曲线 B.b点,溶液中大量存在的离子是Na+、OH- C.c点,两溶液中含有相同量的OH- D.a、d两点对应的溶液均显中性 答案 C 3.(2015山东理综,13,5分)室温下向10 mL 0.1 mol·L-1 NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是( ) A.a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) B.a、b两点所示溶液中水的电离程度相同 C.pH=7时,c(Na+)=c(A-)+c(HA) D.b点所示溶液中c(A-)>c(HA) 答案 D 4.(2014天津理综,5,6分)下列有关电解质溶液中粒子浓度关系正确的是( ) A.pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) B.含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) C.CO2的水溶液:c(H+)>c(HCO3-)=2c(CO32-) D.含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] 答案 A 5.(2014广东理综,12,4分)常温下,0.2 mol·L-1的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( ) A.HA为强酸 B.该混合液pH=7 C.图中X表示HA,Y表示OH-,Z表示H+ D.该混合溶液中:c(A-)+c(Y)=c(Na+) 答案 D 考点二 电离平衡常数及其应用 6.(2018天津理综,3,6分)下列叙述正确的是( ) A.某温度下,一元弱酸HA的Ka越小,则NaA的Kh(水解常数)越小 B.铁管镀锌层局部破损后,铁管仍不易生锈 C.反应活化能越高,该反应越易进行 D.不能用红外光谱区分C2H5OH和CH3OCH3 答案 B 7.(2015浙江理综,12,6分)40 ℃,在氨-水体系中不断通入CO2,各种离子的变化趋势如图所示。下列说法不正确的是( ) A.在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COO-)>c(CO32-) B.不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-) C.随着CO2的通入,c(OH-)c(NH3·H2O)不断增大 D.在溶液pH不断降低的过程中,有含NH2COO-的中间产物生成 答案 C C组 教师专用题组 考点一 弱电解质的电离平衡 1.(2013广东理综,12,4分)50 ℃时,下列各溶液中,离子的物质的量浓度关系正确的是( ) A.pH=4的醋酸中:c(H+)=4.0 mol·L-1 B.饱和小苏打溶液中:c(Na+)=c(HCO3-) C.饱和食盐水中:c(Na+)+c(H+)=c(Cl-)+c(OH-) D.pH=12的纯碱溶液中:c(OH-)=1.0×10-2 mol·L-1 答案 C 2.(2013重庆理综,2,6分)下列说法正确的是( ) A.KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 B.25 ℃时,用醋酸溶液滴定等浓度NaOH溶液至pH=7,V醋酸查看更多
相关文章
- 当前文档收益归属上传用户