- 2021-07-08 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学键化学反应与能量第一节化学键与化学反应第2课时化学键与化学反应中的能量变化课后提升练习含解析鲁科版必修2
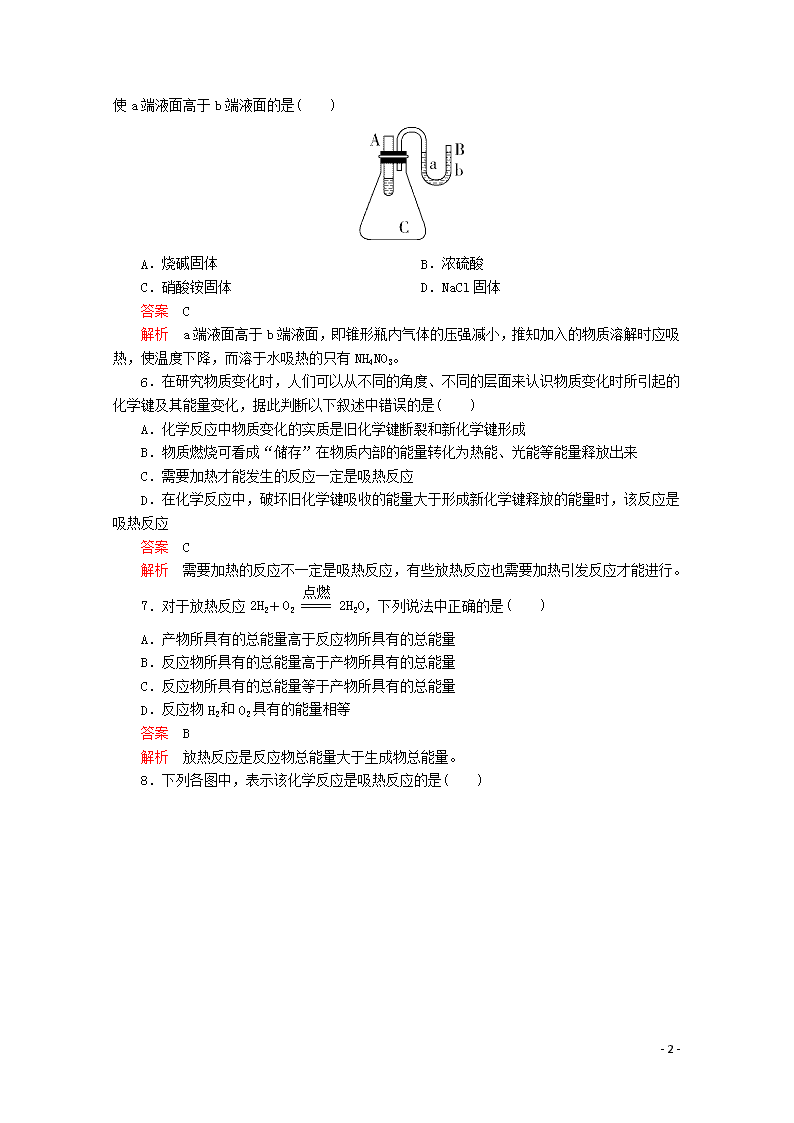
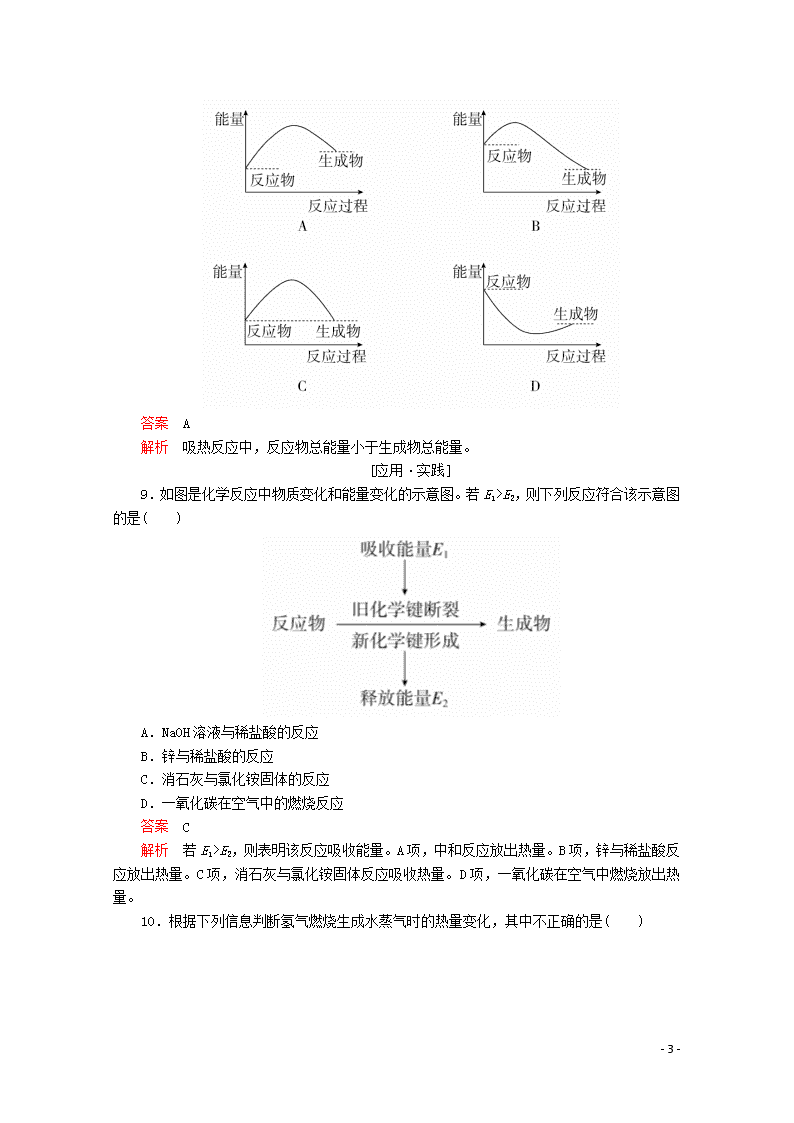
化学键与化学反应中的能量变化 [学习·理解] 1.下列对化学反应的认识中错误的是( ) A.会引起化学键的变化 B.会产生新的物质 C.必然引起物质状态的变化 D.必然伴随着能量的变化 答案 C 解析 化学反应不一定引起物质状态的变化,如气相反应:氮气与氢气化合生成氨气无状态变化。 2.下列说法中正确的是( ) A.化合反应均是放热反应,分解反应均是吸热反应 B.燃料的燃烧反应是放热反应 C.干冰的升华是吸热反应 D.需要点燃或加热的化学反应一定是吸热反应 答案 B 解析 C+CO22CO是化合反应,但需要吸热,2H2O2===2H2O+O2↑是分解反应,但放出热量,A错误;物质之所以被用作燃料,就是因为它易燃烧并放出热量,B正确;吸热反应属于化学反应的一个类别,干冰升华不是化学反应,C错误;化学反应的热量变化与反应条件无关,D错误。 3.下列反应既属于氧化还原反应,又属于吸热反应的是( ) A.铝粉与稀硫酸的反应 B.灼热的木炭与CO2反应 C.甲烷在氧气中的燃烧反应 D.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应 答案 B 解析 铝粉与稀硫酸的反应、甲烷的燃烧反应均是放热反应,A、C两项不符合;Ba(OH)2·8H2O晶体与NH4Cl晶体的反应是吸热反应,但是一个非氧化还原反应,D项不符合;灼热的木炭与CO2的反应既是吸热反应,又是氧化还原反应,B项符合。 4.“即食即热型快餐”适合外出旅行时使用,其内层是用铝箔包裹并用已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线使这两种化学物质反应放出热量便可对食物进行加热,这两包化学物质最合适的选择是( ) A.浓硫酸和水 B.生石灰和水 C.熟石灰和水 D.氯化钠和水 答案 B 解析 D项不是放热过程,不合适;内层有金属易与硫酸反应,且浓硫酸有强腐蚀性,存在安全隐患;熟石灰与水放出的热量远小于生石灰与水,且生石灰价格便宜、容易得到。 5. - 7 - 如图所示,在锥形瓶上放置装有水的小试管,往小试管中分别加入下列物质,其中能使a端液面高于b端液面的是( ) A.烧碱固体 B.浓硫酸 C.硝酸铵固体 D.NaCl固体 答案 C 解析 a端液面高于b端液面,即锥形瓶内气体的压强减小,推知加入的物质溶解时应吸热,使温度下降,而溶于水吸热的只有NH4NO3。 6.在研究物质变化时,人们可以从不同的角度、不同的层面来认识物质变化时所引起的化学键及其能量变化,据此判断以下叙述中错误的是( ) A.化学反应中物质变化的实质是旧化学键断裂和新化学键形成 B.物质燃烧可看成“储存”在物质内部的能量转化为热能、光能等能量释放出来 C.需要加热才能发生的反应一定是吸热反应 D.在化学反应中,破坏旧化学键吸收的能量大于形成新化学键释放的能量时,该反应是吸热反应 答案 C 解析 需要加热的反应不一定是吸热反应,有些放热反应也需要加热引发反应才能进行。 7.对于放热反应2H2+O22H2O,下列说法中正确的是( ) A.产物所具有的总能量高于反应物所具有的总能量 B.反应物所具有的总能量高于产物所具有的总能量 C.反应物所具有的总能量等于产物所具有的总能量 D.反应物H2和O2具有的能量相等 答案 B 解析 放热反应是反应物总能量大于生成物总能量。 8.下列各图中,表示该化学反应是吸热反应的是( ) - 7 - 答案 A 解析 吸热反应中,反应物总能量小于生成物总能量。 [应用·实践] 9.如图是化学反应中物质变化和能量变化的示意图。若E1>E2,则下列反应符合该示意图的是( ) A.NaOH溶液与稀盐酸的反应 B.锌与稀盐酸的反应 C.消石灰与氯化铵固体的反应 D.一氧化碳在空气中的燃烧反应 答案 C 解析 若E1>E2,则表明该反应吸收能量。A项,中和反应放出热量。B项,锌与稀盐酸反应放出热量。C项,消石灰与氯化铵固体反应吸收热量。D项,一氧化碳在空气中燃烧放出热量。 10.根据下列信息判断氢气燃烧生成水蒸气时的热量变化,其中不正确的是( ) - 7 - A.反应中断裂和形成的化学键均为共价键 B.该反应过程释放能量 C.断裂1 mol液态水中的化学键需吸收930 kJ能量 D.2 mol O(g)形成1 mol O2(g)释放498 kJ能量 答案 C 解析 O2、H2、H2O中的化学键均为共价键,A项正确;由图示可知该反应过程中形成化学键释放的能量大于断裂化学键吸收的能量,故该反应过程释放能量,B项正确;断裂1 mol 水蒸气中的化学键需吸收930 kJ能量,C项错误;断裂 mol O2(g)中的化学键吸收249 kJ能量,则2 mol O(g)形成1 mol O2(g)释放498 kJ 能量,D项正确。 11.下列关于反应能量的说法中正确的是( ) A.化学反应中的能量变化,都表现为热量的变化 B.化学键的断裂和形成是化学反应中能量变化的主要原因 C.已知反应:Zn(s)+CuSO4(aq)===ZnSO4(aq)+Cu(s)为放热反应,则反应物总能量<生成物总能量 D.相同条件下,如果1 mol氢原子所具有的能量为E1,1 mol氢分子所具有的能量为E2,则2E1=E2 答案 B 解析 化学反应中的能量变化,不是都表现为热量的变化,还可能有其他能量的变化,如光能等,故A不正确;放热反应中反应物的总能量大于生成物的总能量,故C不正确;分子变成原子需要破坏化学键,吸收能量,故2E1>E2,故D不正确。 12.下列图示变化为吸热反应的是( ) - 7 - 答案 A 解析 A项中生成物的总能量高于反应物的总能量,只能通过吸收能量才能实现;B项则恰好相反;C项中浓硫酸溶于水要放出热量,且此过程是物理变化,没有发生化学反应;D项是典型的放热反应。 13.化学反应A2+B2===2AB的能量变化如图所示,则下列说法正确的是( ) A.该反应是吸热反应 B.1 mol A—A键和1 mol B—B键断裂能放出x kJ的能量 C.2 mol A—B键断裂需要吸收y kJ的能量 D.2 mol AB的总能量高于1 mol A2和1 mol B2的总能量 答案 C 解析 由图知,1 mol A2和1 mol B2的总能量高于2 mol AB的能量,所以该反应放热,A、D两项不正确;化学键断裂时需吸收能量,B项不正确;2 mol A—B键断裂变成2 mol A原子和2 mol B原子吸收y kJ的能量,C项正确。 14.如图所示,在小试管里加入2 g新制备的无水硫酸铜,把小试管套在具支试管内。在U形管内加入少量红墨水。打开T形管螺旋夹,使U形管内两边的液面处于同一水平面。再夹紧螺旋夹,把水滴入小试管内,白色的无水硫酸铜完全变成蓝色的五水硫酸铜晶体,可观察到U形管右侧的液面立即下降,左侧的液面上升。 - 7 - (1)①写出上述反应的化学方程式:_______________________________。 ②该反应是________(填“吸热”或“放热”)反应。 ③反应中的硫酸铜和水具有的总能量________(填“大于”或“小于”)硫酸铜晶体的总能量。 (2)如果U形管内两边的液面处于同一水平面后,在小试管内先加入Ba(OH)2·8H2O晶体,再加入NH4Cl固体,用玻璃棒不断搅拌,则可观察到U形管中的现象为______________________。 答案 (1)①CuSO4+5H2O===CuSO4·5H2O ②放热 ③大于 (2)U形管右侧液面上升,左侧液面下降 解析 (1)滴入水后,CuSO4+5H2O===CuSO4·5H2O,由现象U形管右侧液面下降,左侧液面上升,可知是具支试管内气体受热膨胀,压强增大所致,所以此反应是放热反应,CuSO4和H2O的总能量大于CuSO4·5H2O的总能量。 (2)Ba(OH)2·8H2O+2NH4Cl===BaCl2+2NH3↑+10H2O,反应吸热,导致具支试管内气体压强减小,U形管中右侧液面上升,左侧液面下降 [迁移·创新] 15.(1)在25 ℃、101 kPa的条件下, 请回答下列有关问题: ①由H+H―→H2,当生成1 mol H2时,要________(填“吸收”或“放出”,下同)436 kJ的能量;由Cl2―→Cl+Cl,当断裂1 mol Cl2中的共价键时,要__________243 kJ的能量。 ②对于反应H2(g)+Cl2(g)===2HCl(g),测得生成2 mol HCl(g)时,反应过程中放出183 kJ的热量,则断开1 mol H—Cl键所需的能量是________kJ。 ③有两个反应:a.H2(g)+Cl2(g)2HCl(g), - 7 - b.H2(g)+Cl2(g)2HCl(g)。这两个反应的能量转化方式主要是________能转化为________能,相同物质的量的H2(g)、Cl2(g)反应生成相同质量的HCl(g) 时,放出的能量________(填“相等”或“不相等”)。 (2)根据图示的能量转化关系判断,生成16 g CH3 OH(l)________(填“吸收”或“放出”)________kJ能量。 答案 (1)①放出 吸收 ②431 ③化学 热 相等 (2)放出 45.5 解析 (1)①断裂化学键需要吸收能量,形成化学键需要释放能量。②断裂1 mol H—H键与1 mol Cl—Cl键吸收的能量之和,即436 kJ+243 kJ=679 kJ。设断开1 mol H—Cl所吸收的总能量为E(H—Cl) kJ,则生成2 mol H—Cl所释放的总能量为2×E(H—Cl) kJ,则有2×E(H—Cl) kJ -(436 kJ+243 kJ)=183 kJ,所以E(H—Cl)=431 kJ。③两个反应的能量转化形式主要是化学能转化为热能,一个具体反应释放能量的多少与反应条件无关,而与断开旧化学键和形成新化学键的能量变化有关,所以生成等量的产物所释放的能量相等。 (2)根据图示变化可知,反应物的总能量高于生成物的总能量,所以该反应属于释放能量的反应,生成1 mol CH3OH(l)放出的能量为510 kJ-419 kJ=91 kJ,16 g CH3OH的物质的量为0.5 mol,故生成16 g CH3OH(l)放出的能量为45.5 kJ。 - 7 -查看更多