- 2021-07-02 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020高中化学第二章化学键化学反应与能量第二节化学反应的快慢和限度第2课时化学反应的限度教案鲁科版必修2
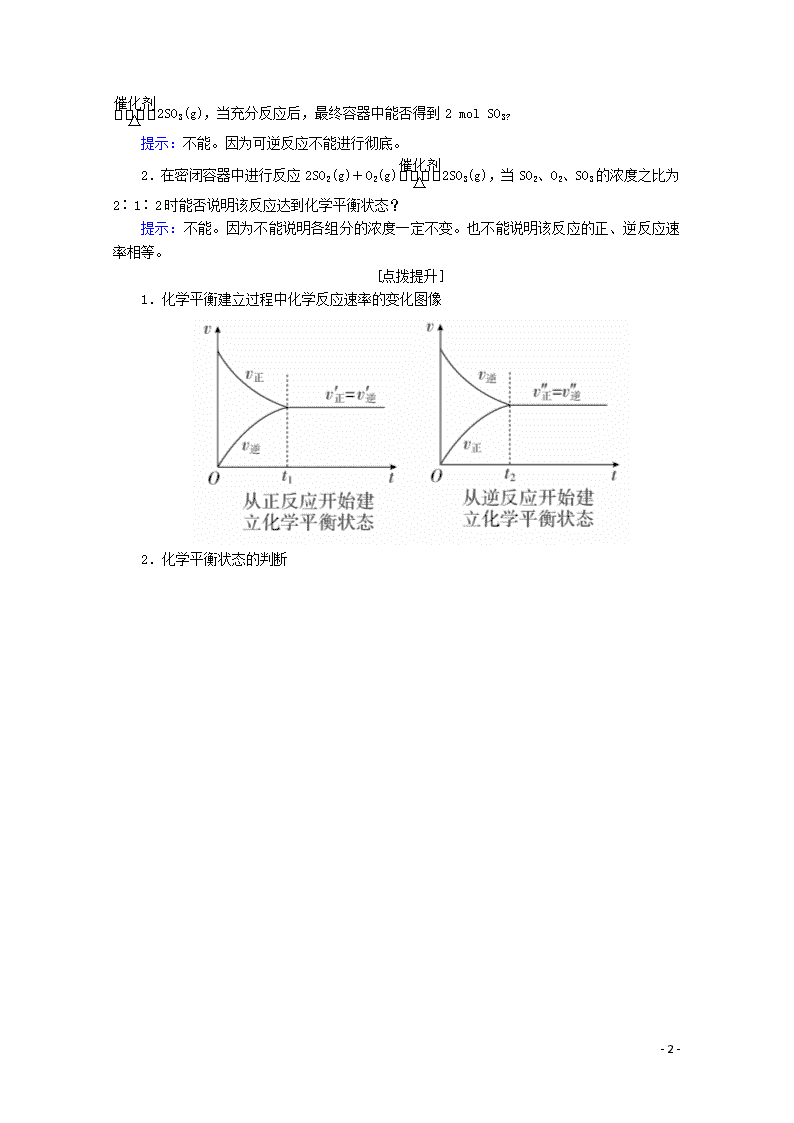
第2课时 化学反应的限度 [学习目标] 1.知道化学反应的限度、可逆反应和化学平衡的含义,认识当一定的外界条件改变时化学反应限度可能发生改变。2.认识化学平衡的特征,会判断化学平衡状态,会分析判断化学平衡的移动。 一、化学反应的限度 [自主学习] 1.可逆反应 (1)定义:在相同条件下同时向正、反两个方向进行的反应。 (2)表示方法:书写可逆反应的化学方程式时不用“===”而用“”。 (3)特点 ①正向反应和逆向反应同时进行。 ②正向反应和逆向反应的条件相同。 ③在一定条件下,反应物不可能全部转化为生成物,反应只能进行到一定的程度,即化学反应的限度。 2.化学平衡 (1)化学平衡状态的概念:在一定条件下可逆反应进行到一定程度时,反应物的浓度与生成物的浓度不再随时间的延长而发生变化,正反应速率与逆反应速率相等,这种状态称为化学平衡状态,简称化学平衡。 (2)化学平衡状态的特征: 1.在密闭容器中充入2 mol SO2和1 mol O2,在一定条件下发生反应2SO2(g)+O2(g) - 8 - 2SO3(g),当充分反应后,最终容器中能否得到2 mol SO3? 提示:不能。因为可逆反应不能进行彻底。 2.在密闭容器中进行反应2SO2(g)+O2(g)2SO3(g),当SO2、O2、SO3的浓度之比为2∶1∶2时能否说明该反应达到化学平衡状态? 提示:不能。因为不能说明各组分的浓度一定不变。也不能说明该反应的正、逆反应速率相等。 [点拨提升] 1.化学平衡建立过程中化学反应速率的变化图像 2.化学平衡状态的判断 - 8 - - 8 - [练习与活动] 1.在密闭容器中进行反应:2SO2(g)+O2(g)2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1。当反应达到平衡时,可能存在的数据是( ) A.SO2为0.4 mol·L-1,O2为0.2 mol·L-1 B.SO2为0.25 mol·L-1 C.SO2、SO3均为0.15 mol·L-1 D.SO3为0.4 mol·L-1 答案 B 解析 该反应为可逆反应,当SO2和O2完全转化为SO3时,c(SO2)=c(O2)=0,c(SO3)=0.4 mol·L-1;当SO3完全转化为SO2和O2时,c(SO3)=0,c(SO2)=0.4 mol·L-1,c(O2)=0.2 mol·L-1。根据可逆反应的特点:可逆反应不可能进行到底,故平衡时,0查看更多
相关文章
- 当前文档收益归属上传用户