- 2021-07-08 发布 |
- 37.5 KB |
- 13页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学备考中等生百日捷进提升系列专题20以框图为基础的无机推断题含解析
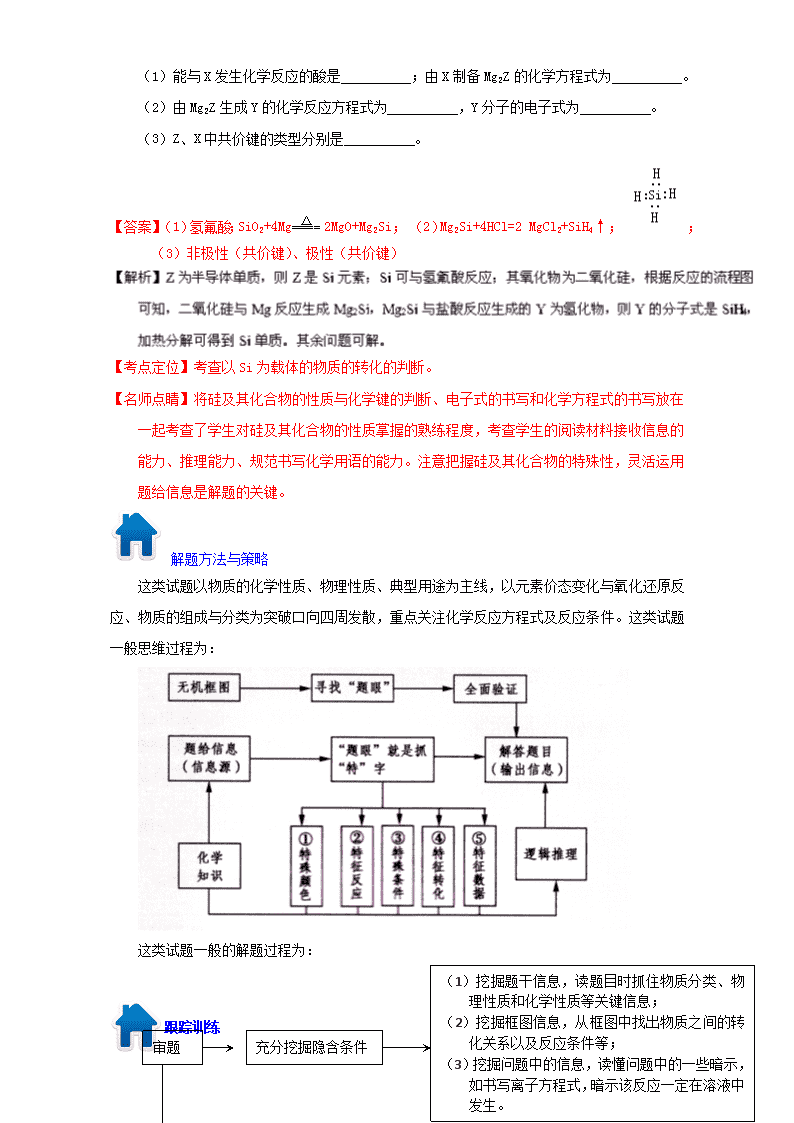
专题二十 以框图为基础的无机推断题解题方法策略 考试方向 以框图为基础的无机推断题主要考查钠、铁、铝、铜、硫、氯、氮、硅等元素的单质及其 化合物。从题型上看,主要以元素及其化合物的综合推断为主,联系基本概念、基本理论命题, 也可以通过无机化工流程图考查元素及化合物知识。从联系上看,可以从社会、科技、环境等 角度联系元素化合物知识,还可以将实验、化学反应原理等结合起来进行综合考查。 经典题例析 【例题 1】【2015 新课标Ⅰ卷】硼及其化合物在工业上有许多用途。以铁硼矿(主要成分为 Mg2B2O5·H2O 和 Fe3O4,还有少量 Fe2O3、FeO、CaO、Al2O3 和 SiO2 等)为原料制备硼酸(H3BO3) 的工艺流程如图所示: 回答下列问题: (1)写出 Mg2B2O5·H2O 与硫酸反应的化学方程式_____________。为提高浸出速率,除适当 增加硫酸浓度浓度外,还可采取的措施有_________(写出两条)。 (2)利用 的磁性,可将其从“浸渣”中分离。“浸渣”中还剩余的物质是______ (写化学式)。 (3)“净化除杂”需先加 H2O2 溶液,作用是_______。 然后再调节溶液的 pH 约为 5,目的 是________。 (4)“粗硼酸”中的主要杂质是 (填名称)。 (5)以硼酸为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂,其电子式为 _______。 (6)单质硼可用于生成具有优良抗冲击性能硼钢。以硼酸和金属镁为原料可制备单质硼, 用化学方程式表示制备过程___________。 【答案】(1) Mg2B2O5·H2O+2H2SO4 2MgSO4+2H3BO3;减小铁硼矿粉粒径、提高反应温度。 (2) Fe3O4; SiO2 和 CaSO4;(3)将 Fe2+氧化为 Fe3+;使 Al3+与 Fe3+形成氢氧化物而除 去。 (4)(七水)硫酸镁 (5) (6) 2H3BO3 B2O3+3HO B2O3+3Mg 3MgO+2B 【考点定位】元素及其化合物知识;化学工艺常识;物质结构。本题是以化学工艺为素材,选 材冷僻,试题难度为很难等级。 【名师点晴】我认为这道题是一道好题,层次分明,有区分度。本题有考查“双基”——提速 措施;四氧化三铁的磁性;制单质硼的反应。也有考查知识综合运用能力——Mg2B2O5·H2O 与硫酸反应;净化除杂两步实验操作的作用;两处成分的判断。甚至还有思维最近发展区 的考查——硫酸镁的结晶水数目(如果将结晶水作为计分点的话);硼氢化钠的电子式。考 生都有可能得分,但完全闯过三关的考生应该不多。(2)问中四氧化三铁的考查,命题者 做了一种很高级的处理——去理想化。中学化学里学到四氧化三铁(象铁丝在纯氧中燃烧 所得的无定形产物)和酸可以反应,但是天然的四氧化三铁和酸是不反应的。命题者的这 种处理不会影响大部分考生的得分,因为问题情景中只有四氧化三铁有磁性(中学双基)。 【例题 2】(【2015 海南卷】单质 Z 是一种常见的半导体材料,可由 X 通过如下图所示的路线制 备,其中 X 为 Z 的氧化物,Y 为氢化物,分子结构与甲烷相似,回答下列问题: (1)能与 X 发生化学反应的酸是 ;由 X 制备 Mg2Z 的化学方程式为 。 (2)由 Mg2Z 生成 Y 的化学反应方程式为 ,Y 分子的电子式为 。 (3)Z、X 中共价键的类型分别是 。 【答案】(1)氢氟酸;SiO2+4Mg=====△ 2MgO+Mg2Si;(2)Mg2Si+4HCl=2 MgCl2+SiH4↑; ; (3)非极性(共价键)、极性(共价键) 【考点定位】考查以 Si 为载体的物质的转化的判断。 【名师点睛】将硅及其化合物的性质与化学键的判断、电子式的书写和化学方程式的书写放在 一起考查了学生对硅及其化合物的性质掌握的熟练程度,考查学生的阅读材料接收信息的 能力、推理能力、规范书写化学用语的能力。注意把握硅及其化合物的特殊性,灵活运用 题给信息是解题的关键。 解题方法与策略 这类试题以物质的化学性质、物理性质、典型用途为主线,以元素价态变化与氧化还原反 应、物质的组成与分类为突破口向四周发散,重点关注化学反应方程式及反应条件。这类试题 一般思维过程为: 这类试题一般的解题过程为: 跟踪训练 充分挖掘隐含条件审题 (1)挖掘题干信息,读题目时抓住物质分类、物 理性质和化学性质等关键信息; (2)挖掘框图信息,从框图中找出物质之间的转 化关系以及反应条件等; (3)挖掘问题中的信息,读懂问题中的一些暗示, 如书写离子方程式,暗示该反应一定在溶液中 发生。 1.【2015 浙江卷】Ⅰ.(6 分) 请回答: (1)H2O2 的电子式___________。 (2)镁燃烧不能用 CO2 灭火,用化学方程式表示其理由________________。 (3)在 AgCl 沉淀中加入 KBr 溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方程式 _____________。 (4)完成以下氧化还原反应的离子方程式: ( )MnO4 -+( )C2O4 2-+______=( )Mn2++( )CO2↑+________ Ⅱ.(12 分) 化合物甲和 NaAlH4 都是重要的还原剂。一定条件下金属钠和 H2 反应生成甲。 甲与水反应可产生 H2,甲与 AlCl3 反应可得到 NaAlH4。将 4.80g 甲加热至完全分解,得到 金属钠和 2.24 L(已折算成标准状况)的 H2。 请推测并回答: (1)甲的化学式__________。 (2)甲与 AlCl3 反应得到 NaAlH4 的化学方程式__________。 (3)NaAlH4 与水发生氧化还原反应的化学方程式__________。 (4)甲在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为 Fe2O3),脱锈过程 发生反应的化学方程式 。 (5)某同学认为:用惰性气体赶尽反应体系中的空气,将铁和盐酸反应后的气体经浓硫酸 干燥,再与金属钠反应,得到固体物质即为纯净的甲;取该固体物质与水反应,若能 产生 H2,即可证明得到的甲一定是纯净的。 判断该同学设想的制备和验纯方法的合理性并说明理由___________。 【答案】Ⅰ.(1) (2)2Mg+CO2 2MgO+C (3) AgCl + Br-== AgBr + Cl- (4) 2MnO4 - + 5C2O4 2- + 16H+ == 2Mn2+ + 10CO2↑+ 8H2O Ⅱ.(1)NaH (2) 4NaH+AlCl3==NaAlH4+3NaCl (3)NaAlH4+2H2O==NaAlO2+4H2↑ (4) 3NaH+Fe2O3==2Fe+3NaOH (5)制备过程不合理,因为盐酸易挥发,H2 中混有 HCl,导致产物中有 NaCl 验纯方法不合理,如果有 Na 残留,Na 与水反应也产生 H2;没有考虑混入的 NaCl 【考点定位】本题主要是考查化学基本概念、电子式、离子反应、氧化还原反应、考查无机物 的推断,新情境下化学方程式的书写,实验方案的评价等。涉及双氧水、镁、CO2、卤化银、 钠、铝及其化合物等。 【名师点晴】本题要求根据物质的性质及其计算进行推理,考查了化学式、电子式、化学方程 式的正确书写,根据题给信息设计实验的能力,并要求根据物质的组成判断物质的化学性 质。定性与定量相结合推断物质,重点考查学生分析问题与解决问题的能力。将计算与物 质的性质紧密联系起来,可培养学生的逻辑推理能力。无机推断是高考命题的一种经典题 型,既能考查学生掌握元素及其化合物知识的熟悉程度,又能考查学生分析间题、逻辑推 理及灵活运用知识的能力,因而无机推断对学生的学科素质要求较高,同时无机推断也是 历年高考的难点之一,随着高考注重基础、凸显能力的命题趋势,无机推断更侧重于物质 结构知识的考查、侧重于元素周期表周期律的考查、侧重于元素化合物性质的考查。同时 化学实验出现在无机推断题、中化学计算分散在无机推断题中、与科技有关的化学物质出 现在推断中。 2.【2014 浙江卷】某研究小组为了探究一种无机矿物质 X(仅含四种元素)的组成和性质,设计 并完成如下实验: 另取 10.80gX 在惰性气流中加热至完全分解,得到 6.40g 固体 1.请回答如下问题: (1)画出白色沉淀 1 中金属元素的原子结构示意图_______,写出气体甲的电子式_______。 (2)X 的化学式是______,在惰性气流中加热 X 至完全分解的化学反应方程式为_______。 (3)白色沉淀 2 在空气中变成红褐色沉淀的原因是_______(用化学反应方程式表示)。 (4)一定条件下,气体甲与固体 1 中的某种成分可能发生氧化还原反应,写出一个可能的 化学反应方程式_______,并设计实验方案验证该反应的产物_______。 【答案】(1) ; (2)CaFeC2O6;CaFeC2O6====△ CaO+FeO+2CO2↑ (3)4Fe(OH)2+O2+2H2O=4Fe(OH)3 (4)2FeO+CO2====△ Fe2O3+CO;检验方法:Fe2O3:将固体用盐酸溶解,加入 KSCN 溶液,若显 红色,证明产物有 Fe(Ⅲ);检测 CO:将气体通过灼烧 CuO,黑色固体变为红色。 +20 2 8 8 2 【考点定位】本题主要是考查了无机物推断。 【名师点晴】本题属于无机框图题推断,涉及物质结构、物质的性质、电子式、方程式、离子 的检验等知识点,熟练掌握常见元素以及化合物的性质以及明确知道流程图中每一步发生 的化学反应及反应现象是解本题关键,平时注意特殊反应、实验现象等有关知识的积累。 该类试题重点考查学生对知识的了解、应用能力,意在考查学生分析、归纳问题、解决问 题的能力。 3.A、B、C、D 为四种单质,常温时,A、B 是气体,C、D 是固体。E、F、G、H、I 为五种化合 物,F 不溶水,E 为气体且极易溶水成为无色溶液,G 溶于水得黄棕色溶液。这九种物质间 反应的转化关系如图所示 (1)写出四种单质的化学式 A________ B_______ C______ D______ (2)写出 H+B→G 的离子方程式 ; ( 3 ) 写 出 G+I→H+D+E 的 化 学 方 程 式 ; (4)某工厂用 B 制漂白粉。 ①写出制漂白粉的化学方程式 。 ②为测定该工厂制得的漂白粉中有效成分的含量,某该小组进行了如下实验:称取漂 白粉 3.0g,研磨后溶解,配置成 250mL 溶液,取出 25.00mL 加入到锥形瓶中,再加 入 过 量 的 KI 溶 液 和 过 量 的 硫 酸 ( 此 时 发 生 的 离 子 方 程 式 为: ),静置。待完全反应后,用 0.2mol·L-1 的 Na2S2O3 溶液 做标准溶液滴定反应生成的碘,已知反应式为:2Na2S2O3+I2 =Na2S4O6+2NaI,共用去 Na2S2O3 溶液 20.00mL。则该漂白粉中有效成分的质量分数为 保 留到小数点后两位)。 【答案】21、(14 分) (1)A H2 B Cl2 C Fe D S (2)2Fe2++Cl2 = 2Fe3++2Cl- (3)2FeCl3 +H2S =2FeCl2+S↓+2HCl (4)①2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O ②2H++2I-+ClO-=I2+Cl-+H2O 47.67% 考点:考查无机物的推断,常见物质的化学性质,氧化还原滴定等知识。 4.下列各物质的转化关系如下图所示,其中 C 是一种日常生活中常见的单质,D 是一种棕红色 固体。 回答下列问题: ⑴C 的名称为 ;J 的化学式为 。 ⑵写出由 A 生成 H 的离子反应方程式: 。 ⑶某气体能使品红溶液褪色,但加热后又恢复,该气体通入 J 溶液中发生反应的离子方程 式: 。 【答案】(1)铝 Fe2(SO4)3(各 2 分) (2)Al2O3+2OH-=2AlO2 -+H2O(2 分) (3)2Fe3+ +SO2 +2H2O=2Fe2+ +SO4 2- +4H+ (2 分) 【解析】 试题分析: A 能与酸、碱都能反应,且 A 熔融电解可得日常生活中常见的单质 C,可判断 A 为 Al2O3,D 是一种棕红色固体,为 Fe2O3,则可知道 B 是 O2,C 是 Al,E 是铁,H 是偏铝酸钠, I 是硫酸铝,F 是硫酸亚铁,G 是氢氧化铁,J 为 Fe2(SO4)3。⑶小问中的某气体能使品红溶 液褪色,但加热后又恢复,则该气体为 SO2,被 Fe3+氧化为 SO4 2-。 考点:无机物的推断;常见金属元素的单质及其化合物的综合应用。 【名师点晴】本题是一道典型的无机框推断题,题目难度中等,本题不仅考查对元素化合物基 础知识的掌握,还主要考查学科内知识间的综合推理能力,答题时注意根据物质的颜色和 反应的条件进行推断。 5.如下图所示:化合物 A 只含两种元素,C 为白色胶状沉淀,B、F 为刺激性气体,且 F 能使品 红溶液褪色,E 为金属单质,J、K 为非金属单质,化合物 H 和 L 为常见化工产品,化合物 I 常温下为液态,H 的浓溶液与 K 加热能生成 F 和无色无味气体 M(图中反应条件和部分产 物已略去)。 试回答下列问题: (1)写出 A、M 的化学式:A_____;M__ _。 (2)写出反应①、②的化学方程式: __ __;_ _ _。 (3)写出 E→D 反应的离子方程式:_ __。 【答案】(1)Al2S3(1 分)__; CO2(1 分)。 (2)Al2S3+6H2O===2Al(OH)3↓+3H2S↑; C+2H2SO4(浓)=====△ CO2↑+2SO2↑+2H2O。(3)2Al+2H2O+2OH-===2AlO- 2 +3H2↑ 成二氧化碳二氧化硫和水,方程式为:C+2H2SO4(浓)=====△ CO2↑+2SO2↑+2H2O。(3)E 到 D 的反应为铝和氢氧化钠和水反应生成偏铝酸钠和氢气,离子方程式为:2Al+2H2O+2OH- ===2AlO- 2 +3H2↑。 【考点定位】本题主要是考查无机推断 【名师点睛】无机推断的突破口之一:颜色:铁:铁粉是黑色的;一整块的固体铁是银白色的。 Fe2+——浅绿色 Fe3O4——黑色晶体 Fe(OH)2——白色沉淀 Fe3+——黄色 Fe (OH)3—— 红褐色沉淀 Fe (SCN)3——血红色溶液 FeO——黑色的粉末 Fe (NH4)2(SO4)2——淡 蓝绿色 Fe2O3——红棕色粉末 FeS——黑色固体;铜:单质是紫红色 Cu2+——蓝色 CuO——黑色 Cu2O——红色 CuSO4(无水)—白色 CuSO4·5H2O——蓝色 Cu2 (OH)2CO3 —绿色 Cu(OH)2——蓝色 [Cu(NH3)4]SO4——深蓝色溶液 BaSO4 、BaCO3 、Ag2CO3 、 CaCO3 、AgCl 、 Mg (OH)2 、三溴苯酚均是白色沉淀 Al(OH)3 白色絮状沉淀 H4SiO4 (原硅酸)白色胶状沉淀 Cl2、氯水——黄绿色 F2——淡黄绿色气体 Br2——深红棕 色液体 I2——紫黑色固体 HF、HCl、HBr、HI 均为无色气体,在空气中均形成白雾 CCl4——无色的液体,密度大于水,与水不互溶 KMnO4--——紫色 MnO4 -——紫色 Na2O2—淡黄色固体 Ag3PO4—黄色沉淀 S—黄色固体 AgBr—浅黄色沉淀 AgI—黄色沉淀 O3—淡蓝色气体 SO2—无色,有剌激性气味、有毒的气体 SO3—无色 固体(沸点 44.8 0C) 品红溶液——红色 氢氟酸:HF——腐蚀玻璃 N2O4、NO——无色气 体 NO2——红棕色气体 NH3——无色、有剌激性气味气体 6.A、B、C 三种物质中均含有同一种元素,它们之间有如右图所示的转化关系(部分反应物质 已略去)。 Ⅰ.(1)若 A 是一种两性氧化物,B 的水溶液呈酸性,请写出反应④的离子方程式: ______________,B 溶液显酸性的原因(用离子方程式表示)_____________。 (2)若反应①为置换反应,反应④为化合反应,C 物质大量存在于海水中,是人体生理 活动不可缺少的物质。工业上可以用 C 来制取 A 或 B,保存少量单质 A 的方法 是 __________,A 在氧气中燃烧产物所含的化学键有_______;用 C 来制取 B 反应的化 学方程式为_______________。 (3)若反应①②③均为化合反应,反应④为置换反应。当 A 为一种金属单质时,请写出反 应③可能的离子方程式________________________。若只用一种试剂鉴别 B、C,可以选 的试剂是_____________。 【答案】(1)Al2O3+2OH-=2AlO2 -+H2O Al3++3H2O Al(OH)3+3H+ (2)保存在煤油里 2NaCl+2H2O 2NaOH+Cl2↑+H2↑(3)2Fe2++Cl2=2Fe3++2Cl- KSCN 溶液 【考点定位】本题考查无机物的推断,侧重于物质的性质的考查。 【名师点晴】本题考查无机物的推断,题目难度中等,此类题的解答一般有以下步骤:思维起 点的选择:思维起点是指开始时的思维指向、思维对象或思维角度,推断题中的思维起点 应是最具特征的某个条件(包括文字叙述或某个变化过程);思维过程的展开:解题者在确 定思维起点的基础上,利用题目所给信息,结合已有的化学知识和解题经验,不断地缩小 问题状态与目标状态的距离;思维过程的检验:将上述思维过程的结果代入题中,检查一 下是否符合题中条件;本题可从两性氧化物及海水中的无机盐,展开思维的空间,寻找目 标答案。查看更多