- 2021-07-08 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021版高考化学一轮复习核心素养微专题8有关水溶液中曲线的解题策略练习含解析新人教版
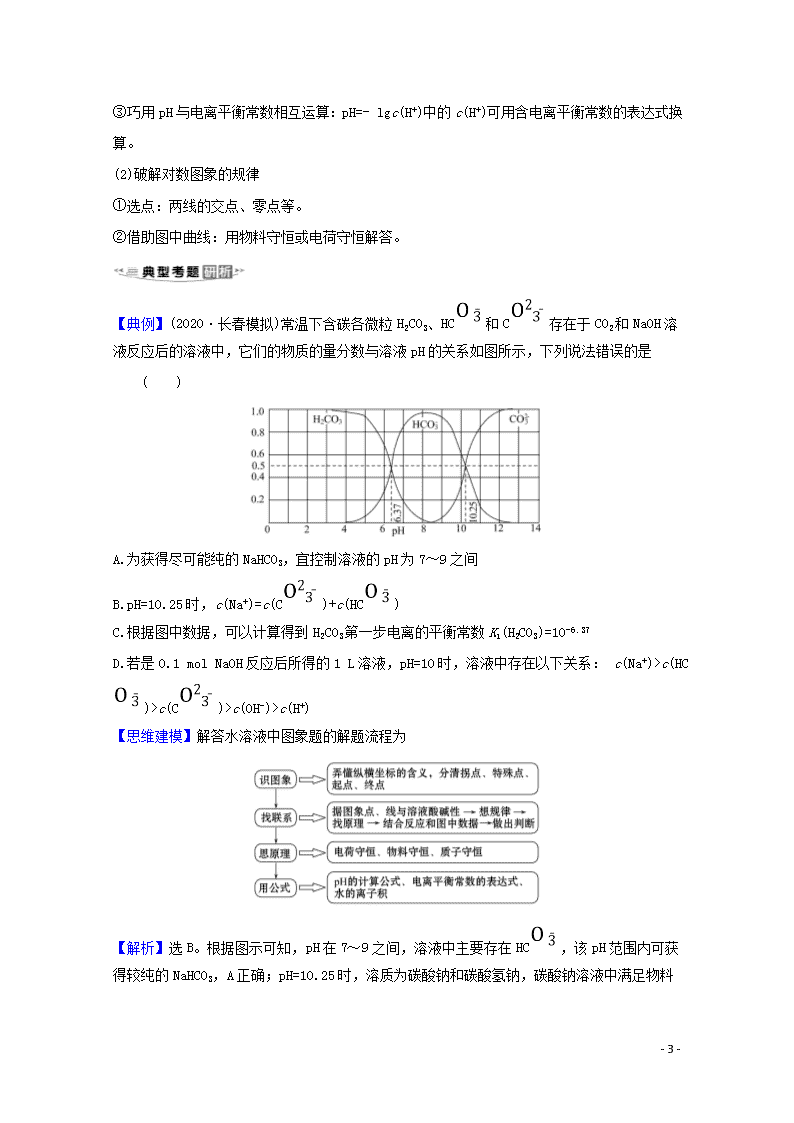
有关水溶液中曲线的解题策略 1.分析解答水溶液中曲线图象问题要注意几点: (1)读图, 弄清图象含义,通过观察弄清横坐标、纵坐标的含义及单位:搞清特殊点的意义,如坐标轴的原点,曲线的起点、终点、交叉点、极值点、转折点等;分析曲线的变化趋势如斜率的大小及升降。 (2)识图,进行信息提取,挖掘隐含信息、排除干扰信息、提炼有用信息,在统摄信息的基础上进行逻辑推理或运用数据计算。 (3)用图,联想化学原理解答问题。 2.三种常见类型 (1)强、弱电解质溶液加水稀释的变化曲线 (2)中和滴定曲线 ①思路分析 - 8 - ②巧抓“四点”,突破“粒子”浓度关系 a.抓反应“一半”点,判断是什么溶质的等量混合。 b.抓“恰好”反应点,生成什么溶质,溶液呈什么性,是什么因素造成的。 c.抓溶液“中性”点,生成什么溶质,哪种反应物过量或不足。 d.抓反应“过量”点,溶质是什么,判断谁多、谁少还是等量。 (3)溶解平衡曲线 3.对数图象的解决办法 (1)破解对数图象的数据 ①运算法则:lgab= lga+lgb、lg=lga-lgb、lg1=0,若 K=·(K只与温度有关) ,得lgK= mlgc1 + nlgc2。 ②运算突破点:如lg=0的点有c(A)=c(B);lgc(D)=0的点有c(D)=1 mol·L-1。 - 8 - ③巧用pH与电离平衡常数相互运算:pH=- lgc(H+)中的c(H+)可用含电离平衡常数的表达式换算。 (2)破解对数图象的规律 ①选点:两线的交点、零点等。 ②借助图中曲线:用物料守恒或电荷守恒解答。 【典例】(2020·长春模拟)常温下含碳各微粒H2CO3、HC和C存在于CO2和NaOH溶液反应后的溶液中,它们的物质的量分数与溶液pH的关系如图所示,下列说法错误的是 ( ) A.为获得尽可能纯的NaHCO3,宜控制溶液的pH为7~9之间 B.pH=10.25时,c(Na+)=c(C)+c(HC) C.根据图中数据,可以计算得到H2CO3第一步电离的平衡常数K1(H2CO3)=10-6.37 D.若是0.1 mol NaOH反应后所得的1 L溶液,pH=10时,溶液中存在以下关系: c(Na+)>c(HC)>c(C)>c(OH-)>c(H+) 【思维建模】解答水溶液中图象题的解题流程为 【解析】选B。根据图示可知,pH在7~9之间,溶液中主要存在HC,该pH范围内可获得较纯的NaHCO3,A正确;pH=10.25时,溶质为碳酸钠和碳酸氢钠, - 8 - 碳酸钠溶液中满足物料守恒:c(Na+)=2c(C)+2c(HC)+2c(H2CO3),碳酸氢钠溶液中存在物料守恒:c(Na+)=c(C)+c(HC)+c(H2CO3),则混合液中c(Na+)>c(C)+c(HC),B错误;根据图象曲线可知,pH=6.37时,H2CO3和HC的浓度相等,碳酸的第一步电离的平衡常数K1(H2CO3)==10-6.37,C正确;pH=10时的溶液为碱性,则c(OH-)>c(H+),溶质为碳酸钠和碳酸氢钠,c(Na+)最大,结合图象曲线变化可知:c(HC)>c(C),此时离子浓度大小为c(Na+)>c(HC)>c(C)>c(OH-)>c(H+),D正确。 【延伸探究】(1)K2(H2CO3)=________。 提示:由图知,pH=10.25时c(HC)=c(C) K2(H2CO3)==c(H+)=10-10.25。 (2)由图知pH>8之后的主要反应的离子方程式为________________。 提示:HC+OH-C+H2O 1.常温下,向20 mL 0.05 mol·L-1的某稀酸H2B溶液中滴入0.1mol·L-1氨水,溶液中由水电离出氢离子浓度随滴入氨水体积变化如图。下列分析正确的是 ( ) A.NaHB溶液可能为酸性,也可能为碱性 B.A、B、C三点溶液的pH是逐渐减小,D、E、F三点溶液的pH是逐渐增大 C.E点溶液中离子浓度大小关系:c(N)>c(B2-)>c(OH-)>c(H+) D.F点溶液c(N)=2c(B2-) - 8 - 【解析】选D。未加入氨水前,溶液的水电离出的OH-浓度为10-13 mol·L-1,所以溶液中c(H+)=0.1 mol·L-1,该酸的浓度为0.05 mol·L-1,所以该酸为二元强酸。酸、碱对水的电离起抑制作用,可水解的盐对水的电离起促进作用,随着氨水的不断滴入,溶液中水电离的c(H+)逐渐增大,当两者恰好完全反应生成(NH4)2B时水的电离程度达最大(图中D点),继续加入氨水,水电离的c(H+)逐渐减小。NaHB属于强酸的酸式盐,NaHB溶液应该呈酸性,A项错误;向酸溶液中逐渐加入碱发生中和反应,混合溶液的pH是逐渐增大的,B项错误; E点溶液由(NH4)2B和氨水混合而成,由于水电离的c(H+)>1×10-7mol·L-1,溶液中H+全部来自水电离,则E点水溶液显酸性,所以c(H+)>c(OH-),C项错误; F点溶液由(NH4)2B和氨水混合而成,由于水电离的c(H+)=1×10-7mol·L-1,溶液中H+全部来自水电离,则F点水溶液呈中性,此时溶液中的电荷守恒有c(N)+c(H+)=c(OH-)+2c(B2-),因c(H+)=c(OH-),所以有c(N)=2c(B2-),D项正确。 2.常温下,分别取浓度不同、体积均为20.00 mL的3种HCl溶液,分别滴入浓度为1.000 mol·L-1,0.100 0 mol·L-1和0.010 00 mol·L-1的NaOH溶液,测得3个反应体系的pH随V(NaOH)的变化的曲线如图,在V(NaOH)=20.00 mL前后出现突跃。 下列说法不正确的是 ( ) A.3种HCl溶液的c(HCl):最大的是最小的100倍 B.曲线a、b、c对应的c(NaOH):a>b>c C.当V(NaOH)=20.00 mL时,3个体系中均满足:c(Na+)=c(Cl-) D.当V(NaOH)相同时,pH突跃最大的体系中的c(H+)最大 【解析】选D。根据图象可知,曲线a、b、c对应HCl溶液的pH分别为0、1、2,所以c(HCl)最大的是最小的100倍,A正确;曲线a、b、c对应的c(NaOH)是1.00 0 mol·L-1,0.100 0 mol·L-1和0.010 00 mol·L-1,a>b>c,B正确;当V(NaOH)=20.00 mL时,3个体系中溶质都为氯化钠,均满足:c(Na+)=c(Cl-),C正确;当V(NaOH)相同时,pH突跃最大的体系是a,c(H+)最小,D错误。 - 8 - 3.某温度下,HNO2和CH3COOH的电离常数分别为5.0×10-4和1.7×10-5。将pH和体积均相同的两种酸溶液分别稀释,其pH随加水体积的变化如图所示。下列叙述正确的是 ( ) A.曲线Ⅰ代表HNO2溶液 B.溶液中水的电离程度:b点>c点 C.从c点到d点,溶液中保持不变(其中HA、A-分别代表相应的酸和酸根离子) D.相同体积a点的两溶液分别与NaOH恰好中和后,溶液中n(Na+)相同 【解析】选C。酸越弱,稀释越能促进电离,稀释后pH变化小,曲线Ⅰ代表醋酸,A错误;两种酸溶液,pH越小酸性越强,水的电离程度越小,c点水电离程度大于b点,B错误;c、d的温度相同,==,其中Ka表示酸的电离平衡常数,由于水的离子积常数和酸的电离平衡常数均只与温度有关,该比值不变,C正确;二者酸的pH相同,但酸的浓度不同,体积相同的两种酸溶液,需要NaOH的物质的量不同,D错误。 4.常温下,将AgNO3溶液分别滴加到浓度均为0.01 mol·L-1的NaBr、Na2SeO3溶液中,所得的沉淀溶解平衡曲线如图所示(Br-、Se用Xn-表示,不考虑Se的水解)。下列叙述正确的是 ( ) A.Ksp(Ag2SeO3)的数量级为10-10 - 8 - B.d点对应的AgBr溶液为不饱和溶液 C.所用AgNO3溶液的浓度为10-3 mol·L-1 D.Ag2SeO3(s)+2Br-(aq)2AgBr(s)+Se(aq)平衡常数为109.6,反应趋于完全 【解析】选D。由图象可知-lgc(Se)=5.0时,-lgc(Ag+)=4,则Ksp(Ag2SeO3)=c2(Ag+)×c(Se)=10-13,数量级为10-13,A错误;由图象可知d点对应的c(Ag+)偏大,应生成沉淀,B错误;由图象可知起始时,-lg c(Ag+)=2,则所用AgNO3溶液的浓度为10-2 mol·L-1,C错误;Ag2SeO3(s)+2Br-(aq)2AgBr(s)+Se(aq)平衡常数为K====109.6>105,反应趋于完全,D正确。 5.25 ℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数-lg c(M2+)与溶液pH的变化关系如图所示,已知:该温度下,Ksp[Cu(OH)2]查看更多