- 2021-07-08 发布 |
- 37.5 KB |
- 5页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
选修3第二章第一节 共价键1
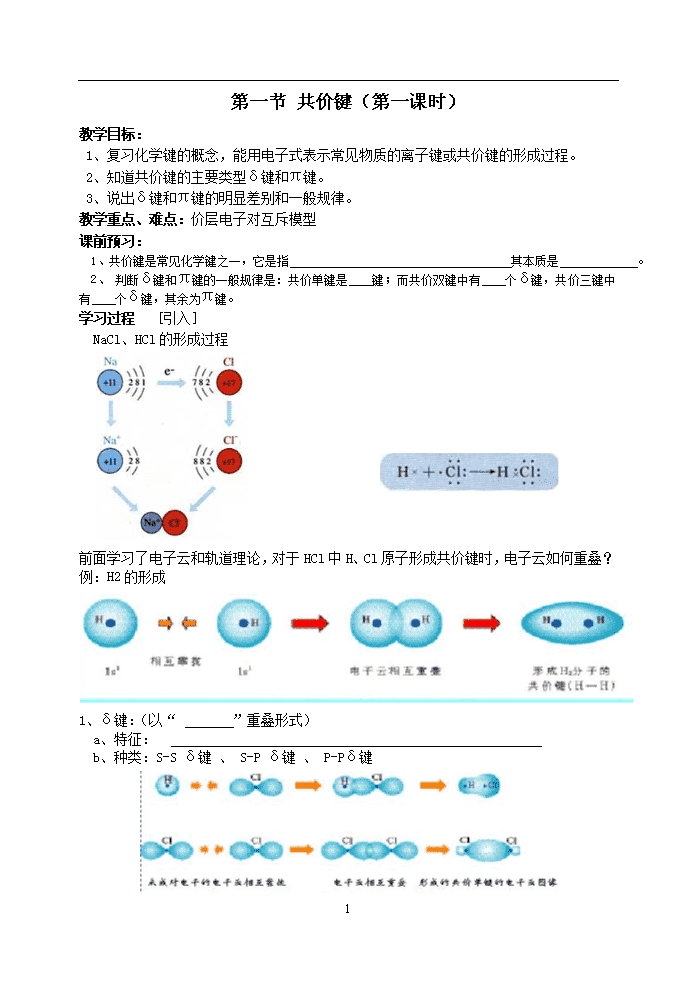
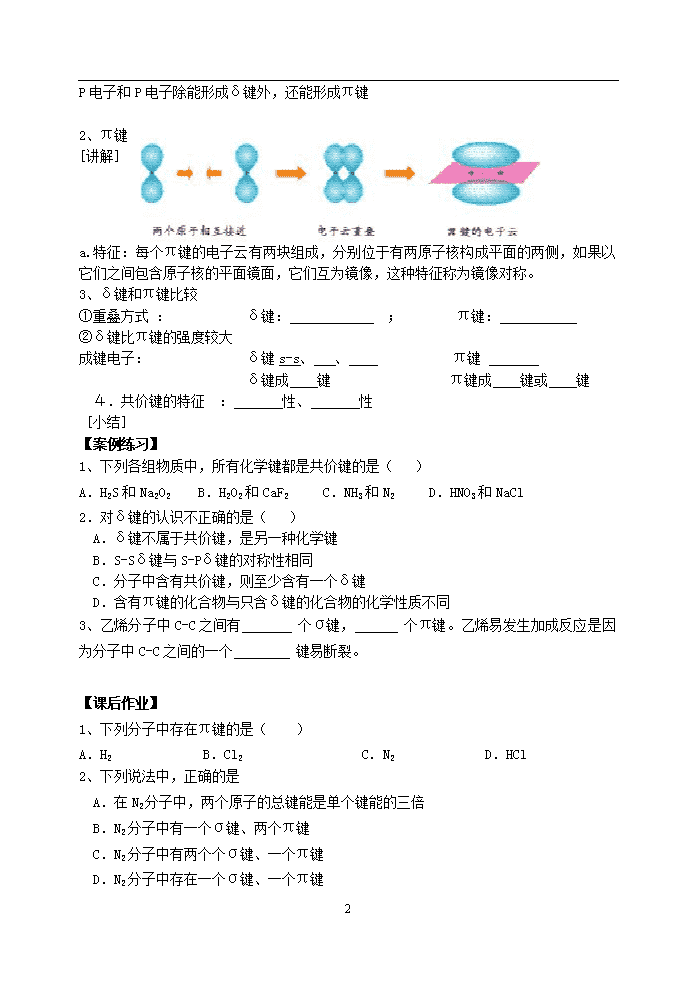
第一节 共价键(第一课时) 教学目标: 1、复习化学键的概念,能用电子式表示常见物质的离子键或共价键的形成过程。 2、知道共价键的主要类型δ键和π键。 3、说出δ键和π键的明显差别和一般规律。 教学重点、难点:价层电子对互斥模型 课前预习: 1、共价键是常见化学键之一,它是指 其本质是 。 2、 判断δ键和π键的一般规律是:共价单键是 键;而共价双键中有 个δ键,共价三键中有 个δ键,其余为π键。 学习过程 [引入] NaCl、HCl的形成过程 前面学习了电子云和轨道理论,对于HCl中H、Cl原子形成共价键时,电子云如何重叠? 例:H2的形成 1、δ键:(以“ ”重叠形式) a、特征: b、种类:S-S δ键 、 S-P δ键 、 P-Pδ键 5 P电子和P电子除能形成δ键外,还能形成π键 2、π键 [讲解] a.特征:每个π键的电子云有两块组成,分别位于有两原子核构成平面的两侧,如果以它们之间包含原子核的平面镜面,它们互为镜像,这种特征称为镜像对称。 3、δ键和π键比较 ①重叠方式 : δ键: ; π键: ②δ键比π键的强度较大 成键电子: δ键s-s、 、 π键 δ键成 键 π键成 键或 键 4.共价键的特征 : 性、 性 [小结] 【案例练习】 1、下列各组物质中,所有化学键都是共价键的是( ) A.H2S和Na2O2 B.H2O2和CaF2 C.NH3和N2 D.HNO3和NaCl 2.对δ键的认识不正确的是( ) A.δ键不属于共价键,是另一种化学键 B.S-Sδ键与S-Pδ键的对称性相同 C.分子中含有共价键,则至少含有一个δ键 D.含有π键的化合物与只含δ键的化合物的化学性质不同 3、乙烯分子中C-C之间有 个σ键, 个π键。乙烯易发生加成反应是因为分子中C-C之间的一个 键易断裂。 【课后作业】 1、下列分子中存在π键的是( ) A.H2 B.Cl2 C.N2 D.HCl 2、下列说法中,正确的是 A.在N2分子中,两个原子的总键能是单个键能的三倍 B.N2分子中有一个σ键、两个π键 C.N2分子中有两个个σ键、一个π键 D.N2分子中存在一个σ键、一个π键 5 3、下列分子中,含有非极性键的化合物的是 A.H2 B.CO2 C.H2O D.C2H4 4、在HCl分子中,由H原子的一个 轨道与Cl原子的一个 轨道形成一个 键;在Cl2分子中两个Cl原子以 轨道形成一个 键。 第二课时 教学目标: 1、认识键能、键长、键角等键参数的概念 2、能用键参数――键能、键长、键角说明简单分子的某些性质 3、知道等电子原理,结合实例说明“等电子原理的应用” 教学难点、重点:键参数的概念,等电子原理 课前预习: 1、键参数通常包括 、 与 2、等电子原理的概念: 3、互为等电子体的物质其 (填“物理”或“化学”,下同)性质相近,而 性质差异较大。 学习过程 N2与H2在常温下很难反应,必须在高温下才能发生反应,而F2与H2在冷暗处就能发生化学反应,为什么? [讨论] 二、键参数 1.键能 ①概念: ②单位: [阅读书33页,表2-1] 1、键能大小与键的强度的关系? 2、键能与化学反应的能量变化的关系? 2.键长 ①概念: ②单位: ③键长越短,共价键越 ,形成的物质越 多原子分子的形状如何?就必须要了解多原子分子中两共价键之间的夹角。 3.键角: 例如:CO2结构为O=C=O,键角为 °,为 形分子。 H2O 键角105°V形 CH4 键角109°28′正四面体 [小结] 键能、键长、键角是共价键的三个参数 键能、键长决定了共价键的稳定性;键长、键角决定了分子的空间构型。 [板书] 5 三、等电子原理 1.等电子体: 如:CO和N2,CH4和NH4+ 2.等电子体性质相似 [阅读课本表2-3] [小结] 【案例练习】 1、下列各说法中正确的是 ( ) A.分子中键能越高,键长越大,则分子越稳定 B.元素周期表中的ⅠA族(除H外)和ⅦA族元素的原子间不能形成共价键 C.水分子可表示为HO—H,分子中键角为180° D.H—O键键能为463KJ/mol,即18克H2O分解成H2和O2时,消耗能量为2×463KJ 2.下列说法中,错误的是 ( ) A.键长越长,化学键越牢固 B.成键原子间原子轨道重叠越多,共价键越牢固 C.对双原子分子来讲,键能越大,含有该键的分子越稳定 D.原子间通过共用电子对所形成的化学键叫共价键 3、下列分子中键角最大的是 ( ) A.CH4 B.NH3 C.H2O D.CO2 4.与NO3-互为等电子体的是( ) A.SO3 B.BF3 C.CH4 D.NO2 5.由课本表2-1可知.H-H的键能为436kJ/mol.它所表示的意义是___________.如果要使1molH2分解为2molH原子,你认为是吸收能量还是放出能量?____.能量数值____.当两个原子形成共价键时,原子轨道重叠的程度越大,共价键的键能____,两原子核间的平均距离――键长____. 【课后作业】 1、下列说法中正确的是 ( ) A.双原子分子中化学键键能越大,分子越牢固 B.双原子分子中化学键键长越长,分子越牢固 C.双原子分子中化学键键角越大,分子越牢固 D.在同一分子中,σ键要比π键的分子轨道重叠程度一样多,只是重叠的方向不同 2、下列物质属于等电子体一组的是( ) A.CH4和NH4+ B.B3H6N3和C6H6 C.F-和Mg D.H2O和CH4 5 3、三氯化磷分子的空间构型是三角锥形而不是平面正三角形,下列关于三氯化磷分子空间构型理由的叙述,不正确的是 ( ) A.PCl3分子中三个共价键的键长,键角都相等 B.PCl3分子中的P-Cl键属于极性共价键 C.PCl3分子中三个共价键键能,键角均相等 D.PCl3是非极性分子 4、下列单质分子中,键长最长,键能最小的是( ) A.H2 B.Cl2 C.Br2 D.I2 5查看更多