- 2021-07-08 发布 |
- 37.5 KB |
- 13页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
山东省济宁市2019-2020学年高二下学期期末考试化学试卷 Word版含答案
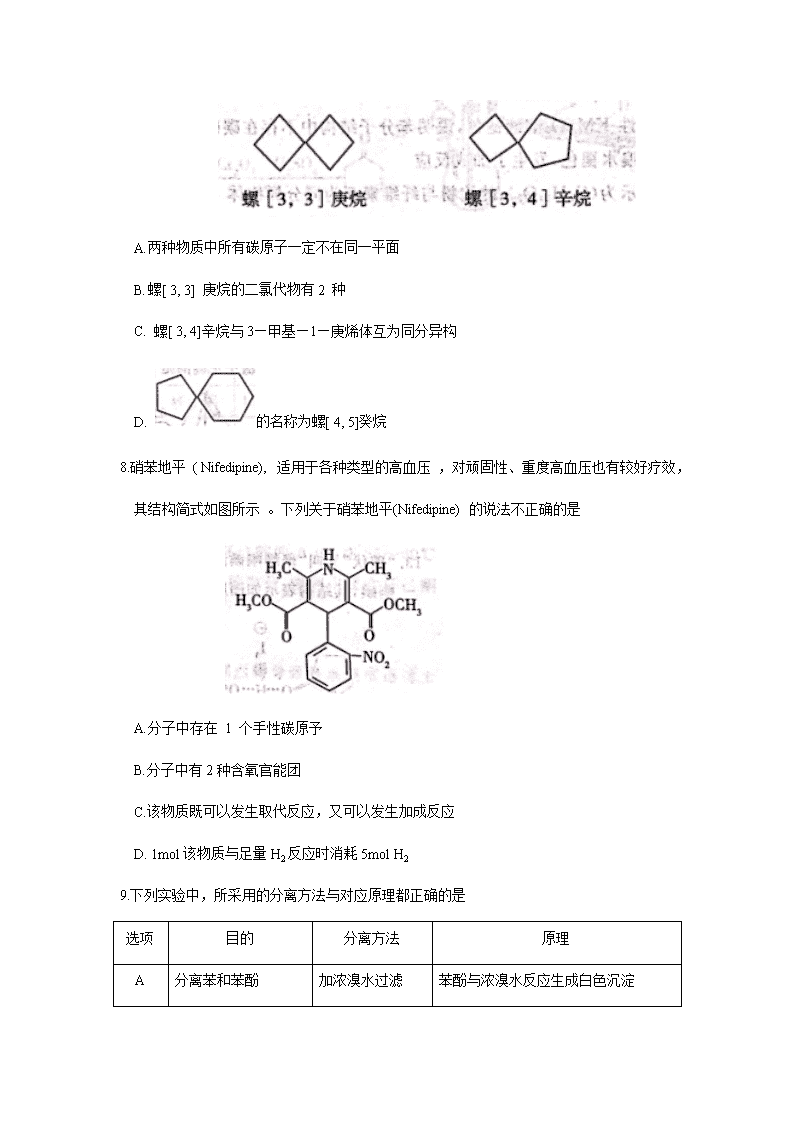
济宁市2019-2020 学年度第二学期质量检测 高二化学试题 注意事项: ①答题前,考生先将自己的姓名、考生号、座号填写在相应位置,认真核对条形码上的 姓名、考生号和座号,并将条形码粘贴在指定位置上。 ② 选择题答案必须使用 2B 铅笔(按填涂样例)正确填涂;非选择题答案必须使用0. 5 毫米黑色签宇笔书写,字体工整、笔迹清楚。 ③请按照题号在各题目的答题区域内作答 ,超出答题区域书写的案答无效;在草稿纸、 试题卷上答题无效。保持卡面清洁,不折叠、不破损。 可能用到的相对原子质量:H:l C:12 O:16 Zn: 65 Se:79 第I卷选择题(共20分) — 、选择题:本题共 10 小题,每小题 2 分,共 20 分。每小题只有一个选项符合题意。 1.生活中有很多化学问题。下列判断正确的是 A.新型冠状病毒由 C、H 、O三种元素组成 B.可乐饮料中含有的兴奋性物质咖啡因( C8H10O2N4)属于有机物 C.石墨烯是一种新型有机材料 D.油脂在人体内水解为氨基酸和甘油等小分子后被人体吸收 2.某元素基态原子最外层的电子排布式如下 ,其中能表示该元素一定为主族元素的是 A.3s2 3p6 B. ns2 C.4s24p1 D. 4s1 3.下列各组元素的性质正确的是 A. 第一电离能:N>O>C B.非金属性:F>N>O C. 最高正价: F> S> Si D.原子半径:P>N> C 4.下列关于范德华力与氢键的叙述中正确的是 A. 任何物质中都存在范德华力,而氢键只存在于含有 N、O、F的物质中 B. 氢键是比范德华力作用强的化学键 C. 范德华力或氢键决定由分子构成物质的物理性质 D. 范德华力与氢键的强弱都只与相对分子质量有关 5.下列关于物质结构的说法错误的是 A. 晶格能: NaF>NaCl>NaBr B. 基态碳原子有三种能量不同的电子 C.CH4和NH4+都是正四面体结构,键角均为109º28ˊ D. 甲醛( HCHO) 和光气(COCl2) 分子中的键角 ∠H—C—H<∠Cl—C—Cl 6.下列关于2-环己基丙烯()和2—苯基丙烯()的说法中不正确的是 A.碳原原子的杂化方式都只有sp2和sp3杂化, B. 两种物质均有 5种 不同化学环境的氢 C.二者均可发生加聚反应和氧化反应 D.2—苯基丙烯分子中所有碳原子可能共平面 7.2020 年 1 月南开大学周其林团队因《高效手性螺环催化剂的发现》获得国家自然科学一等奖。下面为两种简单碳螺环化合物,相关的说法不正确的是 A. 两种物质中所有碳原子一定不在同一平面 B. 螺[ 3, 3] 庚烷的二氯代物有2 种 C. 螺[ 3, 4]辛烷与3—甲基—1—庚烯体互为同分异构 D. 的名称为螺[ 4, 5]癸烷 8.硝苯地平 ( Nifedipine), 适用于各种类型的高血压 ,对顽固性、重度高血压也有较好疗效, 其结构简式如图所示 。下列关于硝苯地平(Nifedipine) 的说法不正确的是 A. 分子中存在 1 个手性碳原予 B.分子中有2种含氧官能团 C.该物质既可以发生取代反应,又可以发生加成反应 D. 1mol该物质与足量H2反应时消耗5mol H2 9.下列实验中,所采用的分离方法与对应原理都正确的是 选项 目的 分离方法 原理 A 分离苯和苯酚 加浓溴水过滤 苯酚与浓溴水反应生成白色沉淀 B 分离乙酸乙酯和乙醇 分液 乙酸乙酯和乙醇的密度不同 C 除去乙烯中混有的 SO2 酸性 KMnO4溶液洗气 SO2能被酸性KMnO4溶液氧化生成SO42- D 除去丁醇中的乙醚 蒸馏 丁醇与乙醚的沸点相差较大 10.科学家合成出了一种用于分离镧系金属的化合物 A( 如图所示),短周期元素X、Y、Z 原子序数依次增大,其中 Z 位于第三周期;Z与Y2可以形成分子ZY6 ,该分子常用作高压电气设备的绝缘介质.下列关于X、Y 、Z的叙述不正确的是 A. Z原子核外电子的空间运动状态的数目与原子序数一致 B.该物质中含有极性键、配位键和离子键 C.X最高价含氧酸晶体在冷水中的溶解度小于热水中的溶解度 D. 化合物 A 中,X、Y、Z 最外层都达到 8 电子稳定结构 二、本题共5小题,每小题4分,共20分。每小题有1个或2个选项符合题意,全都选对得4分,选对但不全的得 2 分,有选错的得 0分 。 11.下列与有机物有关的说法错误的是 A. 苯不能使酸性 KMnO4溶液褪色,说明苯分子结构中不存在碳碳双键 B. 植物油能使溴水褪色,发生了加成反应 C. 组成均可表示为(C6H10O5 )n 的淀粉与纤维素互为同分异构 体 D. 分子式为C15H18O2 的同分异构体中可能含有联苯()结构单元 12.第V A 族元素的原子 R 与Cl原子结合形成RCl3气态分子, 其立体结构呈三角锥形。 RCl5在气态和液态时,分子结构如图所示,下列关于RCl5 分子的说法中正确的是 A. 每个原子都达到8 电子稳定结构 B. 键角( Cl一R一Cl)有 90°、120°、180° 三种 C. RCl5受热后会解分生成分子立体结构呈三角锥形的RCl3 D. 分子中 5 个R一Cl键键能均不相同 13 . “碘伏”又叫“聚维酮碘溶液”。聚维酮通过氢键与HI3 形成聚维酮碘,其结构表示如图所示.下列说法正确的是 A. 合成聚维酮的单体有两种 B. 聚维酮碘中含有离子键、共价键、氢键等化学键 C. 聚维酮易溶于水的原因是与水分子形成氢键 D. 聚维酮碘是纯净物 14.香子兰酸甲酯(甲)、甲醇、甲基丙烯酸甲酯(丙)、有机物(乙)、有机物(丁)存在下列转化关系;下列说法正确的是 A: 丙的分子式为C5H10O2 B. 乙→丁的反应类型为加成反应 C. 乙、丁中的官能团种类均为3 种` D.甲的同分异构体中含有苯环且取代基与甲完全相同有9种 15.有机物甲的结构简式为:,它可以通过下列路线合成(分离方法和其他产物已经略去): 下列说法不正确的是 A. 甲可以发生取代反应、加成反应和缩聚反应 B.步 骤I 的反应方程式是: + C. 步骤IV 的反应类型是取代反应 D.步骤 I 和 IV 在合成甲过程中的目的是保护氨基不被氧化 第II卷 非选择题(共60分) 注意事项: 1.考生务必在答题卡(纸)上规定的地方,将学校、班级、姓名、考号、座号填写清楚。 2. 考生将笫 II 卷的答案用黑色中性笔直接写在答题纸上。考试结束后,只收答题卡。 16. (1 2 分)丁二酮肟可用于镍的检验和测定,其结构式如图: (l ) Ni 元素基态原子价层电子排布图为 , 核外电子占据最高能层的符号为 。 ( 2) N 原子中能量最高的是 电子(填能级符号),其电子云在空间有 的 伸展方向。 ( 3 ) 丁二酮肟镍分子内含有的作用力有 (填字母) 。 a. 配位键 b. 离子键 c. 氢键 d. 范德华力 ( 4) H 和 N 可以形成多种化合物。 ①已知联氨(N2H4)的熔沸点与水 接近,其原因是 ; ②计算表明:N4H62+ 的一种结构如图所示,氢原子只有一种化学环境,氮原子有两种环境 ,其中的大π键可表示为 (已知苯的大π键可以表示为 )。 (5)Ni(CO)4常用于制备纯镍,写出与配体互为等电子体的阴离子 (任写一种)。某镍白铜的晶胞如图所示,其化学式为 。元素铜与镍的第二电离能分别为:ICu=1958kJ·mol-1、INi=1753kJ·mol-1,ICu > INi的原因是 。 17.(10分)糖类、油脂和蛋白质都是生命中重要的有机物质。 (1 ) 淀粉在硫酸作用下发生水解反应,证明淀粉水解产物中含有醛基: 试剂 X 为 ,试管C的 实验现象为 。 ( 2 ) 某油脂A 的结构简式为 。从酯的性质看,油脂A在酸性条件下和碱 性条件下均能发生水解, 水解的共同产物是 (写结构简式) ( 3) 某科学杂志刊载如图所示 A ( 多肤)B、物质(图中“一~一”是长链省略符号) 图中的 B 是由A 与甲醛(HCHO)反应得到 ,假设“一~一”部分没有反应 ,1 molA消耗甲醛 mol, 该过程称为蛋白质的 。天然蛋白质水解生成的最简单的氨基酸的结构简式 ,该氨基酸形成的二肽的结构简式是 。 ( 4 ) 聚丙烯酸钠、涤纶的结构简式如下: 聚丙烯酸 涤纶 合成聚丙烯酸钠的单体的结构简式是 ;合成涤纶有两种单体;其中能和 Na HCO3反应的单体的结构简式是 。 18.(13分 )环己酮是重要化工原料,是制造尼龙的主要中间体,也是重要的工业溶剂,实验室利用如下反应原理和实验装置(部分夹持装置略去)制备环己酮: 有关物质的物理性质见下表 。 物质 沸点(℃) 密度(g·cm-3 溶解性 ,20℃) 环己醇 161.1(97.8)* 0.96 能溶于水和醚 环己酮 155.6(95.0)* 0.95 微溶于水,能溶于醚 水 100.0 1.0 *括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点。 实验中通过装置 B 将酸性 Na2Cr2O7溶液加到盛有10mL 环己醇的A中, 在 55~60℃进行反应。反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮粗品和水的混合物。 (1 ) 装置 D 的的名称是为 。 (2) 酸性 Na2Cr2O7溶液氧化环己醇反应的ΔH<0,反应剧烈将导致系体温度迅速上升 ,副反应增多。简述滴加酸性 Na2Cr2O7 溶液的方法 ;A中发生反应的离子方程式为 。 ( 3 ) 环己酮的提纯需要经过以下一系列的操作: a. 蒸馏、除去乙醚后,收集 151~156℃馏分 b. 水层用乙醚(乙醚沸点34.6℃易燃烧)萃取,萃取液并入有机层 c.过滤、 d. 往液体中加入NaCl 固体至饱和,静置,分液 e. 加入无水 MgSO4固体,除去有机物中少量的水 ①上述提纯步骤的正确顺序是 ; ② d中往液体中加入 NaCl 固体的目的是 ; ③ 上述操作 c、d 中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外 ,还需要的玻璃仪器有 。 ( 4) 恢复至室温时,分离得到纯产品体积为 8 rnL , 则环己酮的产率为. ( 保留三个有效数字)。 19.(13 分)锗石是自然界中含有锗元素的一类矿石的统称,锗石含有人体所需的硒 、 锌、镍、钴、锰 、镁、钙等 30 多种对人体有益的微量元素。回答下列问题 : (1)基态Ge原子核外简化电子排布式为 ,Ge 原子的电子发生跃迁时会吸收或发出不同的光,可用光谱分析仪获得 光谱(填“连续”或“线状”),鉴定Ge 元素的存在。 ( 2 ) 锗与碳同族,性质和结构有一定的相似性 ,锗元素能形成无机化合物(如锗酸钠: Na2GeO3;二锗酸钠:Na2Ge2O5 等),也能形成类似于烷烃的锗烷( GenH2n+2)。 ①Na2GeO3 中锗原子的杂化方式是 。 ②推测l mol GenH2n+2 中含有的σ 键的数目是 (用NA 表示阿伏加德罗常数值)。 ( 3) 利用离子液体 [EMIM] [ AlCl4]可电沉积还原金属Ge,其熔点只有 7℃其中EMIM+ 结构如图所示。 ①该物质的晶体类型是 。 ②EMIM+离子中组成元素的电负性由小到大的顺序是 。 ( 4) 独立的 NH3分子中 H - N- H 的键角为 107. 3° ,[ Zn ( NH3)6 ]2+离子中H - N- H 的键角 107. 3° ( 填“大于”、“ 小于”或“等于”)。 (5)硒化锌( ZnSe ) 是一种重要的半导体材料, 其晶胞结构如图甲所示,该晶胞中硒原子的配位数是 ;已知晶胞边长为 a pm,乙图为甲图的俯视图 ,若原子坐标 A 为(0 ,0,0),B 为 (,1,),则D 原子坐标为 ;若该晶胞密度为ρg·cm-3 ,则阿伏加德罗常数 NA 为 。 20 . 化合物H是合成抗胆碱药的一种中间体,合成路线如下,回答下列问题: 已知: 1. 2. 烯烃与酸性高锰酸钾溶液反应的氧化产物有如下的对应关系: (1)化合物A的结构简式是 ,H 含氧官能团的名称为 。 (2)G→H的反应类型是 , 可证明G 已经完全转化为H物质是 (填 代号)。 a. 溴水 b.酸性KMnO4 溶液 c. 四氯化碳 d. 钠 (3 ) D →E 的化学方程式为 。 ( 4 ) 写出符合下列条件的E的一种同分异构体的结构简式 。 ①含氧官能团与E不同; ②与NaOH 溶液完全反应时,二者的物质的量之比为1:2 ③苯环上有两种不同化学环境的氢,取代基上共有三种不同化学环境的氢。 ④ 除苯环外,无其它环状结构 ( 5 ) 写出以环己烯和乙醇为原料合成 的合成路线( 其它试剂任选) 。 查看更多