- 2021-07-08 发布 |
- 37.5 KB |
- 11页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020高中化学课时跟踪训练5元素周期律含解析 人教版选修3
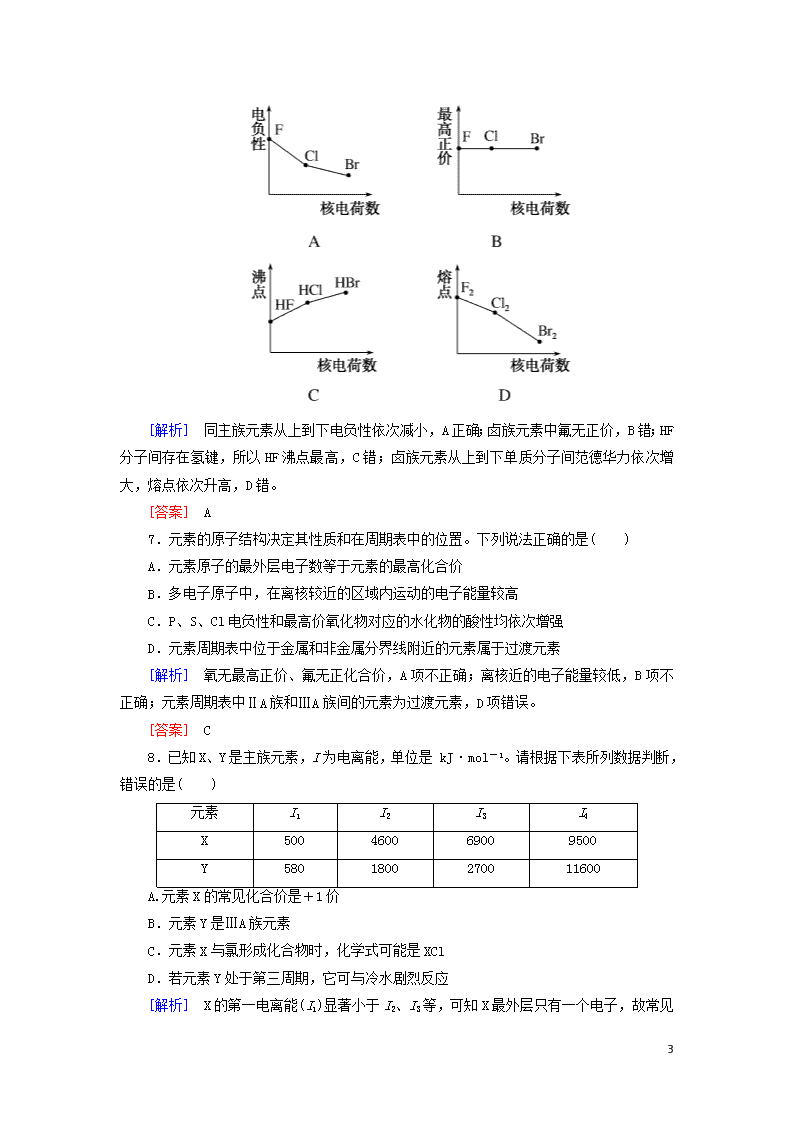
课时跟踪训练(五) [基础巩固] 1.具有下列电子排布式的原子中,半径最大的是( ) A.1s22s22p3 B.1s22s22p1 C.1s22s22p63s23p1 D.1s22s22p63s23p4 [解析] 依据原子的电子排布式确定具体元素:A为氮(N)、B为硼(B)、C为铝(Al)、D为硫(S)。根据同周期、同主族元素原子半径变化规律,可知:r(B)>r(N)、r(Al)>r(S)、r(Al)>r(B),故铝原子半径最大。 [答案] C 2.下列对价电子构型为2s22p5的元素描述正确的是( ) A.原子半径最小 B.原子序数为7 C.第一电离能最大 D.电负性最大 [解析] 价电子构型为2s22p5的元素为氟元素,同一周期中原子半径最小,但是大于氢原子半径;原子序数为9;第一电离能比氦、氖小,电负性最大。 [答案] D 3.下列说法中正确的是( ) A.第三周期的元素中,钠的第一电离能最大 B.最外层都只有一个电子的两原子的性质一定完全相同 C.元素电负性越大的原子,吸引电子的能力越强 D.在同一周期中,随着原子序数的增大,元素的电负性逐渐减小 [解析] 同周期元素从左到右,第一电离能呈增大趋势,第三周期的元素中,钠的第一电离能最小,A错误;最外层都只有一个电子的两原子,如Na和H,性质不同,如为同主族元素,性质存在递变性和相似性,也不完全相同,B错误;电负性越强,吸引电子能力越强,C正确;在同一周期中,随着原子序数的增大,电负性逐渐增强,D错误。 [答案] C 4.下列图示中纵坐标表示元素的电负性数值,横坐标表示同一主族的5种元素的原子序数的是( ) 11 [解析] 同主族自上而下原子半径增大,原子对键合电子的吸引力减小,元素的电负性减小,即同主族随原子序数的增大,电负性减小,选项中符合变化规律的为B中所示图像。 [答案] B 5.下列关于电负性的叙述中不正确的是( ) A.电负性用来描述不同元素的原子对键合电子吸引力的大小 B.电负性是以氟为4.0作为标准的相对值 C.元素电负性越小,元素非金属性越强 D.元素电负性越大,元素非金属性越强 [解析] 因为电负性是描述不同元素原子对键合电子吸引力的大小,所以电负性越大,说明元素吸引电子能力越强,非金属性越强。 [答案] C 6.下列曲线表示卤族元素某种性质随核电荷数的变化趋势,正确的是( ) 11 [解析] 同主族元素从上到下电负性依次减小,A正确;卤族元素中氟无正价,B错;HF分子间存在氢键,所以HF沸点最高,C错;卤族元素从上到下单质分子间范德华力依次增大,熔点依次升高,D错。 [答案] A 7.元素的原子结构决定其性质和在周期表中的位置。下列说法正确的是( ) A.元素原子的最外层电子数等于元素的最高化合价 B.多电子原子中,在离核较近的区域内运动的电子能量较高 C.P、S、Cl电负性和最高价氧化物对应的水化物的酸性均依次增强 D.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 [解析] 氧无最高正价、氟无正化合价,A项不正确;离核近的电子能量较低,B项不正确;元素周期表中ⅡA族和ⅢA族间的元素为过渡元素,D项错误。 [答案] C 8.已知X、Y是主族元素,I为电离能,单位是 kJ·mol-1。请根据下表所列数据判断,错误的是( ) 元素 I1 I2 I3 I4 X 500 4600 6900 9500 Y 580 1800 2700 11600 A.元素X的常见化合价是+1价 B.元素Y是ⅢA族元素 C.元素X与氯形成化合物时,化学式可能是XCl D.若元素Y处于第三周期,它可与冷水剧烈反应 [解析] X的第一电离能(I1)显著小于I2、I3 11 等,可知X最外层只有一个电子,故常见化合价为+1价,且与Cl元素形成化合物XCl,A、C项正确;Y元素的I1、I2、I3相差不大,与I4悬殊明显,故Y最外层有3个电子为ⅢA族元素,当n=3时,Y为Al,与冷水不反应,故B正确,而D错误。 [答案] D 9.通常情况下,原子核外p能级、d能级等原子轨道上电子排布为“全空”、“半充满”、“全充满”的时候一般更加稳定,称为洪特规则的特例,下列事实能作为这个规则证据的是( ) ①元素氦(He)的第一电离能远大于元素氢(H)的第一电离能 ②26Fe2+容易失电子转变为26Fe3+,表现出较强的还原性 ③基态铜(Cu)原子的电子排布式为[Ar]3d104s1而不是[Ar]3d94s2 ④某种激发态碳(C)原子电子排布式为1s22s12p3而不是1s22s22p2 A.①② B.②③ C.③④ D.全部 [解析] ①中He、H均没有p、d能级电子,与特例无关,错;②中Fe2+价电子排布为3d6,而Fe3+价电子排布为3d5,3d5属于半充满状态,体系稳定,故Fe2+易失去电子变为稳定的Fe3+,正确;③中[Ar]3d104s1显然符合d能级全充满状态,为稳定结构,正确;④属于基态原子获得能量,2s能级上一个电子跃迁到2p能级上,而激发态不稳定,易变为基态放出能量,错误。 [答案] B 10.处于同一周期的A、B、C、D四种短周期元素,其气态原子获得一个电子所放出的能量A>B>C>D。则下列说法中,正确的是( ) ①元素的非金属性依次增强 ②元素的电负性依次减小 ③元素的第一电离能依次增大 ④最高价氧化物对应水化物的酸性依次减弱 A.①④ B.②④ C.①③ D.③④ [解析] 根据电负性规律可知结合一个电子释放的能量越大,电负性越强,故在元素周期表中的从左到右的位置为:D、C、B、A,①、③错误,②、④正确。 [答案] B 11.现有四种元素基态原子电子排布式如下:①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p3;④1s22s22p5。则下列有关比较中正确的是( ) A.第一电离能:④>③>②>① B.原子半径:②>①>④>③ 11 C.电负性:④>③>②>① D.最高正化合价:④>①>③=② [解析] 从电子排布式可以看出①是S;②是P;③是N;④是F。第一电离能:F>N>P>S。原子半径:P>S>N>F。电负性:F>N>S>P。最高正化合价:S>N=P>F。 [答案] A 12.下列关于元素第一电离能的说法不正确的是( ) A.钾元素的第一电离能小于钠元素的第一电离能,故钾的活泼性强于钠 B.因同周期元素的原子半径从左到右逐渐减小,故第一电离能必依次增大 C.最外层电子排布为ns2np6(若只有K层时为1s2)的原子,第一电离能较大 D.对于同一元素而言,原子的电离能I1<I2<I3<…… [解析] A项同一主族,从上到下元素的第一电离能越来越小,活泼性越来越强。B项,同周期的第ⅡA与第VA族,第一电离能出现了反常。C项ns2np6的原子为稀有气体原子,第一电离能较大。D项因为原子失电子带正电荷,电子越来越难失去,尤其是达到稳定结构以后,故正确。 [答案] B 13.有A、B、C、D、E五种元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有两个不成对的电子;D、E原子核内各自的质子数与中子数相等;B元素可分别与A、C、D、E生成RB2型化合物,并知在DB2和EB2中,D与B的质量比为7∶8;E与B的质量比为1∶1。试回答: (1)写出D原子的电子排布式____________________。 (2)用电子式表示AE2的形成过程________________。 (3)B、C两元素的第一电离能大小关系为________>________(填元素符号),原因是____________________。 [解析] 本题只要推断出各元素,然后按要求写出答案即可。A原子最外层p能级的电子数等于次外层电子总数,说明次外层为K层,故A的电子排布为1s22s22p2,即A为碳元素。B原子最外层中有两个不成对的电子说明B为ⅣA或ⅥA族的元素,又B与A同周期,说明B为氧元素。C元素可与B形成CB2型化合物且C与A、B同周期,说明C为氮元素。在DB2中,D与B质量比7∶8,即D的相对原子质量为×32=28;在EB2中,E与B的质量比为1∶1,即E的相对原子质量为32;D、E核内各自的质子数与中子数相等可知D为硅元素,E为硫元素。 [答案] (1)1s22s22p63s23p2 (2)2··+··―→∶∶C∶∶ (3)N O N原子中最外层电子处于半充满状态,比较稳定 11 14.元素周期表前四周期A、B、C、D、E五种元素,A元素的原子最外层电子排布式为ns1;B元素的原子价电子排布式为ns2np2;C元素位于第二周期且原子中p能级与s能级电子总数相等;D元素原子的M能层的p能级中有3个未成对电子;E元素原子有五个未成对电子。 (1)写出元素名称: C________、D________、E________。 (2)C基态原子的电子排布图为________________。 (3)当n=2时,B的最简单气态氢化物的电子式为________,BC2分子的结构式是________;当n=3时,B与C形成的化合物与氢氧化钠溶液反应的离子方程式是________________________________。 (4)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2,A、B、C、D四种元素的第一电离能由大到小的顺序是______________________(用元素符号表示)。 (5)E元素原子的外围电子排布式是________,在元素周期表中的位置是_______________,其最高价氧化物的化学式是________。 [解析] A元素的原子最外层电子排布式为ns1,则A为IA族元素或Cr、Cu;B元素的原子价电子排布式为ns2np2,则B为ⅣA族元素;C元素位于第二周期且原子中p能级与s能级电子总数相等,则C为氧元素;D元素原子的M能层的p能级中有3个未成对电子,则D为磷元素;E元素原子有五个未成对电子,则E为25号元素锰元素。 (1)C、D、E元素名称依次为氧、磷、锰。 (2)氧元素核电荷数为8,则根据构造原理、能量最低原理、洪特规则和泡利原理,其电子排布图为: (3)当n=2时,B为碳元素,则B的最简单气态氢化物的电子式为;CO2分子的结构式是O===C===O;当n=3时,则B为硅元素,SiO2与氢氧化钠溶液反应的离子方程式是SiO2+2OH-===SiO+H2O。 (4)若A元素的原子最外层电子排布为2sl,则A为Li;B元素的原子价电子排布为3s23p2,则B为Si;C为O,D为P;A、B、C、D四种元素的第一电离能由大到小的顺序是O>P>Si>Li。 (5)E元素是锰元素,原子序数为25,位于元素周期表第四周期第ⅦB族,所以外围电子排布式为3d54s2,最高正价为+7价,其最高价氧化物的化学式是Mn2O7。 11 [答案] (1)氧 磷 锰 SiO2+2OH-===SiO+H2O (4)O>P>Si>Li (5)3d54s2 第四周期第ⅦB族 Mn2O7 15.根据周期表对角线规则,金属Be与铝单质及其化合物的性质相似,又知AlCl3熔、沸点较低,易升华,试回答下列问题: (1)写出Be与NaOH溶液反应的离子方程式(生成Na2BeO2): _____________________________________________________。 (2)Be(OH)2和Mg(OH)2可用试剂________鉴别,其离子方程式为______________________________________________________。 (3)BeCl2是________(填“离子化合物”或“共价化合物”),BeCl2水溶液呈酸性,其水解的离子方程式为______________。 [解析] 根据对角线法则,可由铝的性质来推测铍的性质,故Be与NaOH反应的离子方程式为:Be+2OH-===BeO+H2↑。Be(OH)2具有两性,能溶于NaOH溶液,因此可用NaOH溶液来鉴别。由于AlCl3是共价化合物,故BeCl2也是共价化合物,水解的离子方程式为:Be2++2H2OBe(OH)2+2H+。 [答案] (1)Be+2OH-===BeO+H2↑ (2)NaOH溶液 Be(OH)2+2OH-===BeO+2H2O (3)共价化合物 Be2++2H2OBe(OH)2+2H+ 16.第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的最低能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。 11 请回答以下问题: (1)认真分析图中同周期元素第一电离能的变化规律,将Na~Ar之间六种元素用短线连接起来,构成完整的图像。 (2)从上图分析可知,同一主族元素原子的第一电离能I1的变化规律为_____________________________________。 (3)上图中5号元素在周期表中的位置是________________。 [解析] 第一电离能反映原子失去最外层一个电子的难易,主族元素从上至下失电子越来越容易,故第一电离能依次减小。 [答案] (1)见解析图 (2)从上到下依次减小 (3)第三周期ⅤA族 17.有四种短周期元素,它们的结构、性质等信息如下表所示: 元素 结构、性质等信息 A 11 是元素周期表中(除稀有气体外)原子半径最大的元素,该元素某种合金是原子反应堆导热剂 B B与A同周期,其最高价氧化物的水化物呈两性 C 元素的气态氢化物极易溶于水,可用作制冷剂 D 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 E L层上有2对成对电子 请根据表中信息填写: (1)A原子的核外电子排布式____________。 (2)B元素在周期表中的位置________;离子半径:B________A(填“大于”或“小于”)。 (3)C原子的电子排布图是________________________,其原子核外有________个未成对电子,能量最高的电子为________轨道上的电子,其轨道呈________形。 (4)D原子的电子排布式为________________________,D-的结构示意图是________。 (5)C、E元素的第一电离能的大小关系是________(用元素符号表示)。 (6)已知CD3分子中D元素为+1价,则C、D的电负性大小关系是________,CD3与水反应后的产物是________________。 [解析] 根据题中信息可推出:A为Na,B为Al,C为N,D为Cl,E为O。 (1)A为Na,其核外电子排布式为1s22s22p63s1简化电子排布式为[Ne]3s1。 (2)B为Al,其在元素周期表中的位置为第三周期第ⅢA族,Na+与Al3+核外电子排布相同,核电荷数Al3+大于Na+,故r(Al3+)<r(Na+)。 (3)C为N,其电子排布图为,其中有3个未成对电子,能量最高的为p轨道上的电子,其轨道呈哑铃形。(4)D为Cl,其核外电子排布式为1s22s22p63s23p5,简化电子排布式为[Ne]3s23p5,Cl-的结构示意图为 (5)N、O分别在VA族、ⅥA族,因N的2p原子轨道半充满较稳定,故第一电离能N>O。 (6)NCl3分子中N为-3价,Cl为+1价,故N的电负性强于Cl,且水解产物为NH3(或NH3·H2O)和HClO。 [答案] (1)1s22s22p63s1或[Ne]3s1 (2)第三周期第ⅢA族 小于 11 (3) 3 p 哑铃 (4)1s22s22p63s23p5或[Ne]3s23p5 (5)N>O (6)N>Cl NH3(或NH3·H2O)和HClO [能力提升] 18.已知电负性和元素的化合价一样,也是元素的一种基本性质。下面给出14种元素的电负性: 元素 Al B Be C Cl F Li Mg N Na O P S Si 电负性 1.5 2.0 1.5 2.5 3.0 4.0 1.0 1.2 3.0 0.9 3.5 2.1 2.5 1.8 已知:两成键元素间电负性差值大于1.7时,形成离子键,两成键元素间电负性差值小于1.7时,形成共价键。 (1)根据表中给出的数据,可推知元素的电负性具有的变化规律是________________________。 (2)下列物质属离子化合物的是________,属于共价化合物的有________。 A.Mg3N2 B.BeCl2 C.AlCl3 D.SiC [解析] 元素的电负性随原子序数的递增呈周期性变化。据已知条件及表中数值Mg3N2电负性差值为1.8,大于1.7,形成离子键,为离子化合物;BeCl2、AlCl3、SiC电负性差值分别为1.5、1.5、0.7,均小于1.7,形成共价键,为共价化合物。 [答案] (1)随原子序数的递增,元素的电负性与原子半径一样呈周期性变化 (2)A BCD 19.仔细观察示意图,回答下列问题: (1)B的原子结构示意图为________,B元素位于元素周期表的第________周期第________族。 11 (2)铍的最高价氧化物对应的水化物是________化合物(填“酸性”“碱性”或“两性”),证明这一结论的有关离子方程式是__________________________________。 (3)根据周期律知识,硼酸酸性比碳酸________,理由是_____。 (4)根据Mg在空气中的燃烧情况,可知Li在空气中燃烧生成产物为________________(用化学式表示)。 [解析] 本题主要是对“对角线规则”的考查。运用类推的思想解题,是解决此类问题最有效的方法。 (1)B是5号元素,电子排布式为1s22s22p1。 (2)Be(OH)2与Al(OH)3的化学性质相似,但差别在于Be的化合价是+2。 (3)B比C的非金属性弱。 (4)Mg在空气中与O2、CO2、N2反应得MgO、Mg3N2,将Li与Mg类比得答案。 [答案] (1) 二 ⅢA (2)两性 Be(OH)2+2OH-===BeO+2H2O,Be(OH)2+2H+===Be2++2H2O (3)弱 硼的非金属性比碳弱 (4)Li2O、Li3N 11查看更多