- 2021-07-08 发布 |
- 37.5 KB |
- 5页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届浙江学考一轮复习考点精讲通用版考点35电解池原理的应用学案
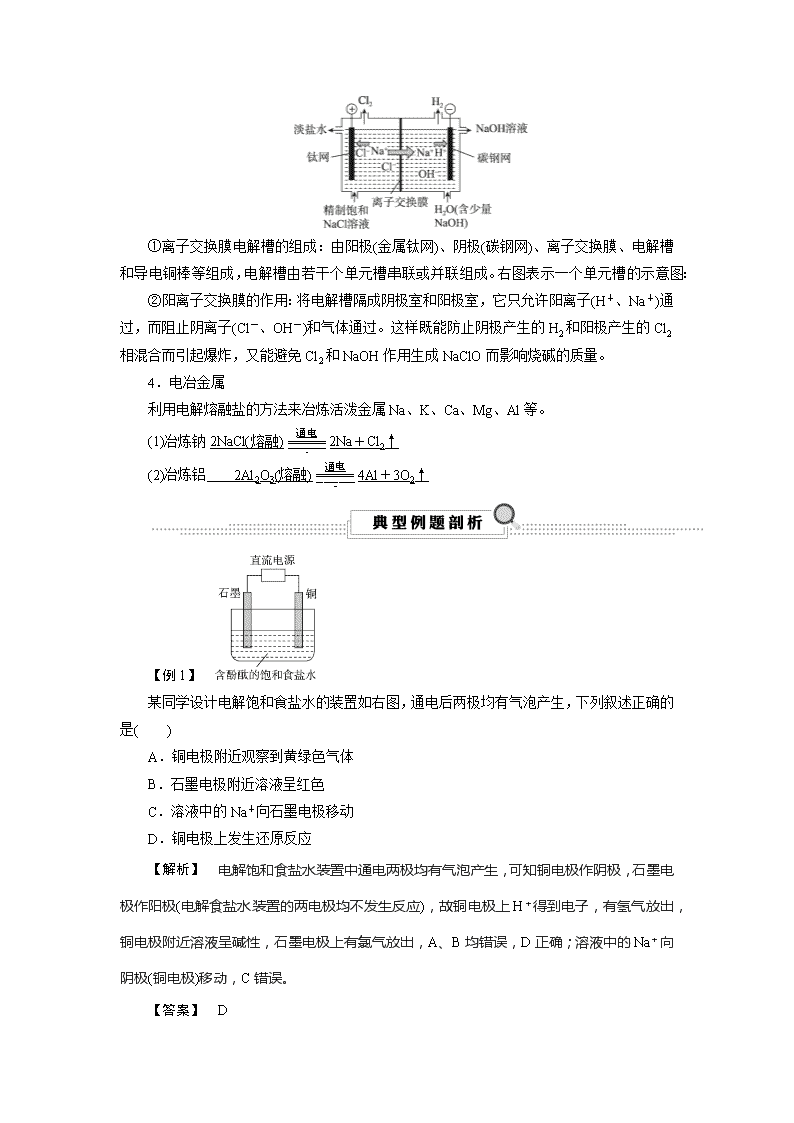
考点35 电解池原理的应用 知识条目 必考要求 加试要求 金属冶炼、氯碱工业、电镀在生产生活中的应用 b 1.铜的电解精炼 (1)电极材料:阳极为粗铜,阴极为纯铜。 (2)电解质溶液:含Cu2+的盐溶液。 (3)电极反应: 阳极:Zn-2e-===Zn2+、Fe-2e-===Fe2+、Ni-2e-===Ni2+、Cu-2e-===Cu2+ 阴极:Cu2++2e-===Cu 2.电镀 右图为金属表面镀银的工作示意图 (1)镀件作阴极,镀层金属银作阳极; (2)电解质溶液是AgNO3溶液等含镀层金属阳离子的盐溶液; (3)电极反应: 阳极:Ag-e-===Ag+ 阴极:Ag++e-===Ag (4)特点:阳极溶解,阴极沉积,电镀液的浓度不变。 3.氯碱工业 (1)电解饱和食盐水 电极反应:阳极反应式:2Cl--2e-===Cl2↑(氧化反应) 阴极反应式:2H++2e-===H2↑(还原反应) 总反应方程式:2NaCl+2H2O2NaOH+H2↑+Cl2↑ (2)离子交换膜法制烧碱 ①离子交换膜电解槽的组成:由阳极(金属钛网)、阴极(碳钢网)、离子交换膜、电解槽和导电铜棒等组成,电解槽由若干个单元槽串联或并联组成。右图表示一个单元槽的示意图: ②阳离子交换膜的作用:将电解槽隔成阴极室和阳极室,它只允许阳离子(H+、Na+)通过,而阻止阴离子(Cl-、OH-)和气体通过。这样既能防止阴极产生的H2和阳极产生的Cl2相混合而引起爆炸,又能避免Cl2和NaOH作用生成NaClO而影响烧碱的质量。 4.电冶金属 利用电解熔融盐的方法来冶炼活泼金属Na、K、Ca、Mg、Al等。 (1)冶炼钠2NaCl(熔融)2Na+Cl2↑ (2)冶炼铝 2Al2O3(熔融)4Al+3O2↑ 【例1】 某同学设计电解饱和食盐水的装置如右图,通电后两极均有气泡产生,下列叙述正确的是( ) A.铜电极附近观察到黄绿色气体 B.石墨电极附近溶液呈红色 C.溶液中的Na+向石墨电极移动 D.铜电极上发生还原反应 【解析】 电解饱和食盐水装置中通电两极均有气泡产生,可知铜电极作阴极,石墨电极作阳极(电解食盐水装置的两电极均不发生反应),故铜电极上H+得到电子,有氢气放出,铜电极附近溶液呈碱性,石墨电极上有氯气放出,A、B均错误,D正确;溶液中的Na+向阴极(铜电极)移动,C错误。 【答案】 D 【提炼】 电解饱和食盐水是电解原理的其中一个应用—— 氯碱工业,其总反应方程式为2NaCl+2H2O2NaOH+H2↑+Cl2↑,阳极电极反应式为2Cl--2e-===Cl2↑,阴极电极反应式为2H2O+2e-===H2↑+2OH-,两端滴加酚酞,阴极区看到变红色。 【例2】 在铜片上镀银时,下列有关叙述正确的是( ) ①将铜片接在电池的正极上 ②将银片接在电源的正极上 ③在铜片上发生的反应为Ag++e-===Ag ④在银片上发生的反应为4OH--4e-===O2↑+2H2O ⑤需用CuSO4溶液作电解液 ⑥需用AgNO3溶液作电解液 A.①③⑥ B.②③⑥ C.①④⑤ D.②③④⑥ 【解析】 铜是镀件,作阴极,接电源负极,①错误;银是镀层金属,作阳极,接电源正极,②正确;电解质溶液要含有镀层金属阳离子,所以要选AgNO3溶液作电解液,⑥正确,⑤错误;在阴极上发生反应Ag++e-===Ag,③正确;在阳极上发生反应Ag-e-===Ag+,④错误。综上②③⑥正确,B符合题意。 【答案】 B 【提炼】 电镀是电解原理的另一个应用。镀件与外加电源的负极相连,作阴极,镀层金属与外加电源的正极相连,作阳极;电解质溶液是含镀层金属阳离子的盐溶液。 【例3】 利用如图所示装置模拟电解原理在工业生产上的应用。下列说法正确的是( ) A.氯碱工业中,X电极上反应式是4OH--4e-===2H2O+O2↑ B.电解精炼铜时,Z溶液中的Cu2+浓度不变 C.在铁片上镀铜时,Y是纯铜 D.制取金属镁时,Z是熔融的氯化镁 【解析】 氯碱工业中阳极是Cl-放电生成Cl2;电解精炼铜时阳极粗铜溶解,阴极Cu2+放电析出Cu,由于粗铜中含有锌、铁、镍等杂质,溶液中Cu2+浓度变小;铁片上镀铜时,阴极应该是铁片,阳极是纯铜。 【答案】 D 【提炼】 铜的电解精炼是电解原理的另一个应用:粗铜与外加电源的正极相连,为阳极材料;纯铜与外加电源的负极相连,作阴极;电解质溶液为含Cu2+的盐溶液。其电极反应:阳极:Zn-2e-===Zn2+、Fe-2e-===Fe2+、Ni-2e-===Ni2+、Cu-2e-===Cu2+;阴极:Cu2++2e-===Cu。 【例4】 用右图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10, 阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( ) A.用石墨作阳极,铁作阴极 B.阳极的电极反应式为Cl-+2OH--2e-===ClO-+H2O C.阴极的电极反应式为2H2O+2e-===H2↑+2OH- D.除去CN-的反应式2CN-+5ClO-+2H+===N2↑+2CO2↑+5Cl-+H2O 【解析】 Cl-在阳极发生氧化反应生成ClO-,水电离出的H+在阴极发生还原反应生成H2,又由于电解质溶液呈碱性,故A、B、C项正确;D项,溶液呈碱性,离子方程式中不能出现H+,正确的离子方程式为2CN-+5ClO-+H2O===N2↑+2CO2↑+5Cl-+2OH-,错误。 【答案】 D 【提炼】 利用电解原理除去含CN-、Cl-废水中的CN-,根据题干信息学会分析原理:阳极的电极反应式为Cl-+2OH--2e-===ClO-+H2O,阴极的电极反应式为2H2O+2e-===H2↑+2OH-。 【例5】 电解法处理酸性含铬废水(主要含有Cr2O)时,以铁板作阴、阳极,处理过程中存在反应Cr2O+6Fe2++14H+===2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去,下列说法不正确的是( ) A.阳极反应为Fe-2e-===Fe2+ B.电解过程中溶液pH不会变化 C.过程中有Fe(OH)3沉淀生成 D.电路中每转移12 mol电子,最多有1 mol Cr2O被还原 【解析】 由题中方程式可知:Cr2O与Fe2+的反应在消耗H+,使得溶液由酸性变为中性,再由中性变为碱性,Cr3++3OH-===Cr(OH)3↓,Fe3++3OH-===Fe(OH)3↓,所以A、C正确,B不正确。由阳极反应及总反应知,电路中每转移12 mol电子,则生成6 mol Fe2+,所以有1 mol Cr2O被还原,D正确。 【答案】 B 【提炼】 由题干信息分析其反应原理,阳极(Fe):Fe-2e-===Fe2+;阴极(Fe):2H++2e-===H2↑,因H+不断在阴极上得电子成为H2而析出。查看更多