- 2021-07-08 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
四川省仁寿第二中学2019-2020高二化学7月月考试卷(Word版附答案)
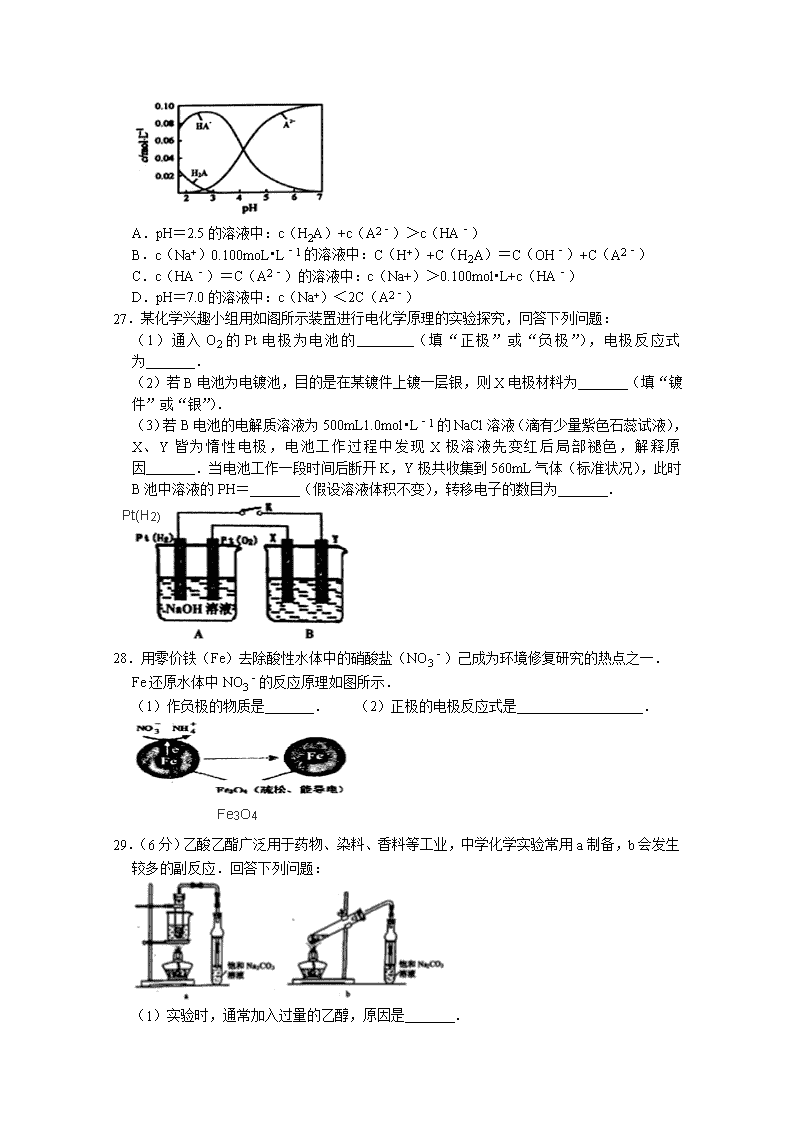
7.(6分)化学在生活中有着广泛的应用,下列说法错误的是( ) A.Al2(SO4)3 和小苏打溶液反应可用于泡沫灭火器灭火 B.利用HF与SiO2反应,用氢氟酸在玻璃器皿上刻蚀标记 C.化石燃料完全燃烧不会造成大气污染 D.用浸泡过高锰酸钾溶液的硅藻土保存水果以达到保鲜的效果 8.(6分)下列关于有机物的说法正确的是( ) A.苯和聚乙烯均能发生加成反应 B.分子式为C5H10O2的有机物不一定能与NaHCO3溶液反应放出气体 C.两种不同的烷烃一定互为同系物 D.乙烷光照条件下能与溴水发生取代反应 9.(6分)下列实验操作能达到实验目的是( ) 实验目的 实验操作 A. 除去CO2中混有的HCl 将气体通过装有饱和碳酸钠溶液的洗气瓶 B. 由MgCl2溶液制备无水Mg Cl2 将MgCl2溶液加热蒸干 C. 证明Cu(OH)2的溶度积 比 Mg(OH)2 的小 将0.lmol•L﹣1MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.lmol•L﹣1CuSO4溶液 D. 苯萃取碘水中的I2 先从分液漏斗下口放出有机层,后从上口倒出水层 A.A B.B C.C D.D 10.(6分)甲基环己烷的结构如图所示:下列说法正确的是( ) A.甲基环己烷的分子式为C7H16 B.甲基环己烷的一氯代物有4种 C.甲基环己烷中碳原子可能都处于同一平面 D.甲基环己烷与2﹣乙基一1一戊烯互为同分异构体 11.铅蓄电池是最常见的二次电池,电池总反应式为:Pb+PbO2+4H++2SO2PbSO4+2H2O,下列说法错误的是( ) A.充电时,阴极反应式为:SO42﹣+4H++PbO2+2e﹣═PbSO4+2H2O B.充电时,两个电极的质量均减轻 C.电池放电时,电解质溶液的pH增大 D.电池放电时,负极可能会发生副反应:Pb+H2SO4═PbSO4+H2↑ 12.(6分)短周期主族元素A、B、C、D、E的原子序数依次增大,A原子的最外层有6个电子,B是迄今发现的非金属性最强的元素,在周期表中C位于IA族,D的氧化物为两性氧化物,E与A属于同一主族.下列说法正确的是( ) A.元素C、E的原子半径和简单离子半径均为:C>E B.由C、E两种元素组成的化合物C2E2既含有离子键也含有共价键 C.最高价氧化物对应的水化物的碱性:D>C D.常温下,由D单质制成的容器可盛装E的最高价氧化物的水化物的稀溶液 13.(6分)某酸H2A为二元弱酸.20℃时,配制一组c(H2A)+c(HA﹣)+c(A2﹣)=0.100mol•L﹣1的H2A和NaOH混合溶液,溶液中部分微粒的物质的里浓度随pH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定正确的是( ) A.pH=2.5的溶液中:c(H2A)+c(A2﹣)>c(HA﹣) B.c(Na+)0.100moL•L﹣1的溶液中:C(H+)+C(H2A)=C(OH﹣)+C(A2﹣) C.c(HA﹣)=C(A2﹣)的溶液中:c(Na+)>0.100mol•L+c(HA﹣) D.pH=7.0的溶液中:c(Na+)<2C(A2﹣) 27.某化学兴趣小组用如阁所示装置进行电化学原理的实验探究,冋答下列问题: (1)通入O2的Pt电极为电池的 (填“正极”或“负极”),电极反应式为 . (2)若B电池为电镀池,目的是在某镀件上镀一层银,则X电极材料为 (填“镀件”或“银”). (3)若B电池的电解质溶液为500mL1.0mol•L﹣1的NaCl溶液(滴有少量紫色石蕊试液),X、Y皆为惰性电极,电池工作过程中发现X极溶液先变红后局部褪色,解释原因 .当电池工作一段时间后断开K,Y极共收集到560mL气体(标准状况),此时B池中溶液的PH= (假设溶液体积不变),转移电子的数目为 . Pt(H2) 28.用零价铁(Fe)去除酸性水体中的硝酸盐(NO3﹣)己成为环境修复研究的热点之一. Fe还原水体中NO3﹣的反应原理如图所示. (1)作负极的物质是 . (2)正极的电极反应式是 . Fe3O4 29.(6分)乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用a制备,b会发生较多的副反应.回答下列问题: (1)实验时,通常加入过量的乙醇,原因是 . (2)饱和Na2CO3溶液的作用是 . (3)反应结束后,将盛有饱和Na2CO3溶液的试管中收集到的产品倒入分液漏斗中, 、 ,然后分液. 30.(8分)磷酸铁(FePO4•2H2O,难溶于水的米白色固体)可用于生成药物、食品添加剂和锂离子电池的正极材料,实验室可通过下列实验制备磷酸铁. (1)称取一定量已除去油污的废铁屑,加入稍过量的稀硫酸,加热、搅拌,反应一段时间后过滤.反应加热的目的是 . (2)向滤液中加入一定量H2O2氧化Fe2+,为使滤液中的Fe2+完全被H2O2氧化成Fe3+,下列实验条件控制正确的是 (填字母编号). A.加入适当过量的H2O2溶液B.缓慢滴加H2O2溶液并搅拌 C.加热,使反应在较高温度下进行D.用氨水调节溶液pH=7 (3)往含有Fe3+的溶液中加入一定量的Na2HPO4溶液(溶液显碱性),搅拌、过滤、洗漆、干燥得到FePO4•2H2O.若反应得到的FePO4•2H2O固体呈棕黄色,则磷酸铁中混有的杂质可能为 . (4)实验过程中用H2O2氧化Fe2+之前,为确定加入H2O2的量,需先用K2Cr2O7标准溶液滴定滤液中的Fe2+,离子方程式为:CrO72﹣+6Fe2++14H+═2Cr3++6Fe3++7H2O ①在向滴定管注入K2Cr2O7标准溶液前,滴定管需要检漏、 和 . ②若滴定x mL含Fe2+的滤液消耗a mol•L﹣1K2Cr2O7标准溶液b mL,则滤液中c(Fe2+)= mol•L﹣1. 31.(2分)已知: (ⅰ)Al2O3(s)+3C(s)═2Al(s)+3CO(g)△H1=+1 344.1kJ•mol﹣1 (ⅱ)2AlCl3(g)═2Al(s)+3Cl2(g)△H2=+1 169.2kJ•mol﹣1由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为 . 32.(4分)碳酸:H2CO3,K1=4.3×10﹣7,K2=5.6×10﹣11 草酸:H2C2O4,K1=5.9×10﹣2,K2=6.4×10﹣5 0.1mol/L Na2CO3溶液的pH 0.1mol/L Na2C2O4溶液的pH;(选填“大于”“小于”或“等于”) 等浓度的草酸溶液和碳酸溶液中,氢离子浓度较大的是 ;若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是 (选填编号); a.[H+]>[HC2O4﹣]>[HCO3﹣]>[CO32﹣] b.[HCO3﹣]>[HC2O4﹣]>[C2O42﹣]>[CO32﹣] c.[H+]>[HC2O4﹣]>[C2O42﹣]>[CO32﹣] d.[H2CO3]>[HCO3﹣]>[HC2O4﹣]>[CO32﹣]. 33.工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)⇌CH3OH(g). 图Ⅰ表示反应中能量的变化;图Ⅱ表示一定温度下,在体积为2L的密闭容器中加入4mol H2 和一定量的CO后,CO(g)和CH3OH(g)的浓度随时间变化图. 回答下列问题: (1)在“图I”中,曲线 (填“a”成“b”)表示使用了催化剂,该反应属于 _ (填“吸热”或“放热”)反应. (2)根据“图II”判断,下列说法不正确的是 . A.起始充入的CO为l mol B.增加CO浓度,CO的转化率增大 C.容器中压强恒定时,反应己达平衡状态 D.保持温度和密闭容器容积不变,再充入l mol CO和2mol H2,再次达到平衡时会增大 (3)从反应开始到建立平衡,V(H2)= ,该温度下CO(g)+2H2(g)⇌CH3OH(g) 的化学平衡常数为 .若保持其他条件不变,向平衡体系中再充入0.5mol CO、l mol H2、1.5mol CH3OH,平衡 (填“向正反应方向移动”或“向逆反应方向移动”或“不移动”) 34.已知A、B、C、D、E为元素周期表中前四周期元素,且原子序数依次增大。A是原子半径最小的主族元素,B是空气中含量最多的元素:C元素2p能级有两个未成对电子且没有空轨道;D是29号元素;E元素的价电子排布式为ns2np2.回答下列问题: (1)基态D原子的外围电子排布式为 ,B、C两种元素的第一电离能最大的是 _ (用元素符号表示)。 (2)BC3﹣微粒的空间构型为 ,1个[D(A2C)4]2+中含有的σ键数目为 个。 (3)A、D两种元素分别与C元素形成的简单化合物,熔点较高的是 ,原因是 。 (4)BA3在一定条件下容易得到一个A+,形成BA4+.下列对上述过程的描述不合理的是 。 A.B原子的杂化类型发生了改变 B.微粒的形状发生了改变 C.微粒的化学性质发生了改变 D.微粒中的键角减小 (5)E单质的晶体具有金刚石结构,其中微粒之间存在的作用力是,如图为E单质晶体的晶胞,已知晶胞的密度为dg/cm3,则晶胞的边长为 pm(列出计算式即可)。 【化学-选修5:有机化学基础】(15分) 35.用石油化工产品1,3﹣丁二烯合成化工中间产品D ()的合成路线如图: 已知: (1)物质D中所含官能团名称为 ,一定条件下,1molD最多与 molH2发生加成反反应。 (2)写出②⑥的反应类型分别是 、 。 (3)④反应的化学方程式 。⑤反应的化学方程式 。 (4)A 的系统命名是 。 (5)写出与物质D互为同分异构体且满足以下条件的有机物结构简式 。 ①能与FeCl3溶液发生显色反应 ②能发生银镜反应 ③核磁共振氢谱显示有5组峰 (6)请设计合理方案用 合成. (其他原料自选,用反应流程图表示,并注明必要的反应条件)。 高二下期教学质量检测试题(二)答案 7-13: CBCDABB 27.(10分) (1) 正极 , O2+4e﹣+2H2O=4OH﹣ .(2) 银 (3) X电极产生的Cl2与水反应产生的HCl和HClO使溶液显酸性,同时HClO有漂白性 . 13 , 0.05NA . 28.(3分)(1) 铁 .(2) NO3﹣+8e﹣+10H+=NH4++3H2O . 29.(6分)(1) 增大反应物浓度,使平衡向生成酯的方向移动,提高酯的产率 . (2) 中和乙酸、溶解乙醇、减少乙酸乙酯在水中的溶解 . (3) 振荡 、 静置 30.(8分)(1)加快铁和稀硫酸的反应速率 .(2) A、B (填字母编号). (3) Fe(OH)3 . (4)① 用蒸馏水洗净 和 用K2Cr2O7标准溶液润洗2~3次 .② mol•L﹣1. 31.(2分) Al2O3(s)+3C(s)+3Cl2(g)═2AlCl3(g)+3CO(g)△H=174.9kJ/mol . 32.(4分) 大于 ; 草酸 ; ac 33.(10分)(1) b , 放热 .(2) A、B . (3) 0.15mol/(L•min) , 12 . 向正反应方向移动 34.(15分)(1) 3d104s1 , N 。(2)平面(正)三角形 , 12 个。 (3) CuO , CuO为离子晶体,H2O为分子晶体 。 (4) A、D 。 (5) 不填 , ×1010 pm(列出计算式即可)。 35略查看更多