2020届高考化学二轮复习化学平衡状态和化学平衡常数学案
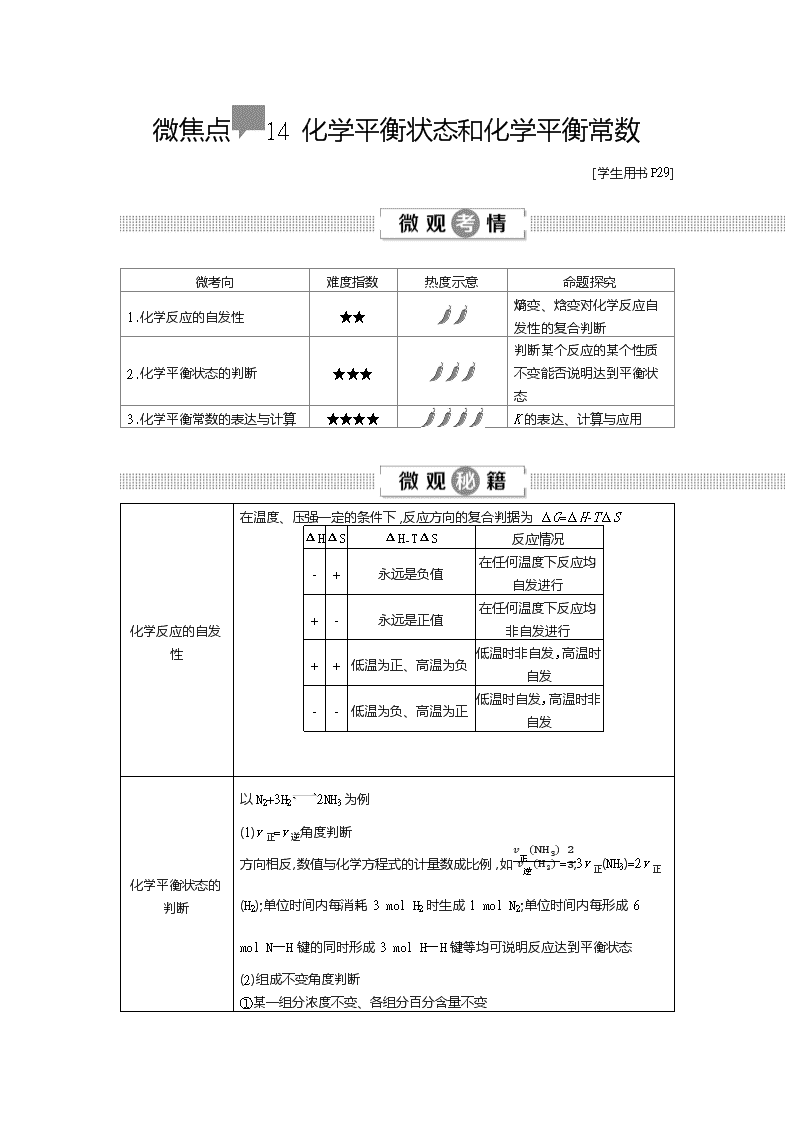
微焦点14 化学平衡状态和化学平衡常数
[学生用书P29]
微考向
难度指数
热度示意
命题探究
1.化学反应的自发性
★★
熵变、焓变对化学反应自发性的复合判断
2.化学平衡状态的判断
★★★
判断某个反应的某个性质不变能否说明达到平衡状态
3.化学平衡常数的表达与计算
★★★★
K的表达、计算与应用
化学反应的自发性
在温度、压强一定的条件下,反应方向的复合判据为ΔG=ΔH-TΔS
ΔH
ΔS
ΔH-TΔS
反应情况
-
+
永远是负值
在任何温度下反应均自发进行
+
-
永远是正值
在任何温度下反应均非自发进行
+
+
低温为正、高温为负
低温时非自发,高温时自发
-
-
低温为负、高温为正
低温时自发,高温时非自发
化学平衡状态的判断
以N2+3H22NH3为例
(1)v正=v逆角度判断
方向相反,数值与化学方程式的计量数成比例,如v正(NH3)v逆(H2)=23;3v正(NH3)=2v正(H2);单位时间内每消耗3 mol H2时生成1 mol N2;单位时间内每形成6 mol N—H键的同时形成3 mol H—H键等均可说明反应达到平衡状态
(2)组成不变角度判断
①某一组分浓度不变、各组分百分含量不变
②恒容条件下体系压强不再变化
③恒压条件下体系体积、密度不再变化
④平均相对分子质量不变
⑤绝热条件下体系温度不再变化
续 表
化学平衡常数的表达与计算
(1)由于固体或纯液体的浓度视为常数1,所以在平衡常数表达式中不再写出;
化学平衡常数与化学方程式书写形式有关,方程式系数变化,K的表达式也相应发生变化;对于同一可逆反应,正反应的平衡常数等于逆反应的平衡常数的倒数,即K正=1/K逆。两反应加和,得到的新反应,其化学平衡常数是两反应平衡常数的乘积;两反应相减,得到的新反应,其化学平衡常数是两反应平衡常数相除得到的商
(2)化学平衡常数与温度的关系
ΔH<0,K随温度升高而减小;ΔH>0,K随温度升高而增大;只要温度不变,平衡常数就不会改变,利用此定律可以计算恒定温度下再次平衡后的转化率等物理量,这也是定量化学的重要定律
(3)化学平衡常数的应用
①利用K可推测可逆反应进行的限度。相同条件下K越大,正反应进行的程度越大
②利用K可以判断化学反应是否达到化学平衡。对于反应mA(g)+nB(g)pC(g)+qD(g),在一定温度下的任意时刻,Qc=cp(C)·cq(D)cm(A)·cn(B)。Qc
K,反应向逆反应方向进行
化学反应的自发性
[典例导考1] (2019·温州高三月考)已知在298 K和101 kPa条件下,有如下反应:
反应Ⅰ:C(s)+O2(g)CO2(g) ΔH1=-393.5 kJ· mol-1
反应Ⅱ:2C(s)+O2(g)2CO(g) ΔH2=-221 kJ· mol-1
反应Ⅲ:N2(g)+O2(g)2NO(g) ΔH3=180.5 kJ· mol-1
汽车尾气净化原理为反应Ⅳ:2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH= ,该反应能自发进行的条件是 (填“高温”“低温”或“任意温度”)。
【审】 考查盖斯定律应用和化学反应的自发性。
【切】 应用化学反应方向的熵判据和焓判据以及温度的影响来解决反应自发进行的方向和条件问题。
【解】 根据盖斯定律可知反应Ⅳ由(反应Ⅰ×2-反应Ⅱ-反应Ⅲ)得到,则ΔH=(-393.5 kJ· mol-1)×2-(-221 kJ· mol-1)-180.5 kJ· mol-1=-746.5 kJ· mol-1;由ΔG=ΔH-TΔS<0,其中ΔH<0、ΔS<0,可知该反应在低温下能自发进行。
【答】 -746.5 kJ· mol-1 低温
【思】 熟练掌握焓变、熵变的四种组合与化学反应自发性的关系。
[应用提能1-1]以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN);通过电解法可制取铝。电解铝时阳极产生的CO2可通过二氧化碳甲烷化再利用。
已知:
2Al2O3(s)4Al(g)+3O2(g) ΔH1=3 351 kJ· mol-1
2C(s)+O2(g)2CO(g) ΔH2=-221 kJ· mol-1
2Al(g)+N2(g)2AlN(s) ΔH3=-318 kJ· mol-1
碳热还原Al2O3合成AlN的热化学方程式是 ,该反应自发进行的条件是 。
【答案】 Al2O3(s)+3C(s)+N2(g)2AlN(s)+3CO(g) ΔH=1 026 kJ· mol-1 高温
【微探究】 将已知的三个反应分别编号为①②③,①×12+②×32+③即可得:Al2O3(s)+3C(s)+N2(g)2AlN(s)+3CO(g) ΔH=1 026 kJ· mol-1; 该反应ΔH>0,ΔS>0(气体分子数增加),所以高温条件下反应自发进行。
[应用提能1-2]水是“生命之基质”,是“永远值得探究的物质”。关于反应H2(g)+12O2(g)H2O(l),下列说法不正确的是( )
A.焓变ΔH<0,熵变ΔS<0
B.可以把该反应设计成原电池,实现能量的转化
C.一定条件下,若观察不到水的生成,说明该条件下反应不能自发进行
D.选用合适的催化剂,有可能使反应在常温常压下以较快的速率进行
【答案】 C
【微探究】 该反应显然为放热反应,所以焓变ΔH<0,该反应气体分子数减小,所以熵变ΔS<0,A项正确;该反应属于自发的氧化还原反应,所以可以设计成原电池,实现能量的转化,B
项正确;反应能自发进行的判断依据是ΔH-TΔS<0,是反应能进行的趋势,和是否生成水无关,C项错误;催化剂能降低反应的活化能,加快反应速率,有可能使反应在常温常压下以较快的速率进行,D项正确。
化学平衡状态的判断
[典例导考2](2018·4月选考,14)反应N2(g)+3H2(g)2NH3(g) ΔH<0,若在恒压绝热容器中发生,下列选项表明反应一定已达平衡状态的是( )
A.容器内的温度不再变化
B.容器内的压强不再变化
C.相同时间内,断开H—H键的数目和生成N—H键的数目相等
D.容器内气体的浓度c(N2)∶c(H2)∶c(NH3)=1∶3∶2
【审】 本题考查了化学平衡状态的判断,根据化学平衡状态的特征解答,当反应达到平衡状态时,正、逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化。
【切】 解题时要注意选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应达到平衡状态,注意当反应达到平衡状态时,正、逆反应速率相等,但不为0。
【解】 注意题干信息:绝热,说明与外界没有热量交换,正反应会导致体系温度升高;恒压,表示容器体积可变,正反应导致容器容积缩小。反应前后压强恒不变,无法判定平衡是否建立,B项错误。断开H—H键和生成N—H键都是正反应,单一方向的速率不可以判定平衡,C项错误。浓度的比值取决于投料和转变量,与是否平衡无关,D项错误。
【答】 A
【思】 以下几种情况不能作为可逆反应达到化学平衡状态的标志:
(1)某一时刻,各物质的浓度(或物质的量或分子数)之比等于化学计量数之比的状态。
(2)恒温、恒容条件下气体体积不变的反应,混合气体的压强或气体的总物质的量不随时间变化,如2HI(g)I2(g)+H2(g)。
(3)全部是气体参加的体积不变的反应,体系的平均相对分子质量不随时间变化而变化,如2HI(g)I2(g)+H2(g)。
(4)全部是气体参加的反应,恒容条件下体系的密度保持不变。
[应用提能2-1]下列说法正确的是( )
A.H2(g)+I2(g)2HI(g),其他条件不变,缩小反应容器体积,正、逆反应速率不变
B.C(s)+H2O(g)H2(g)+CO(g),碳的质量不再改变说明反应已达平衡
C.若压强不再随时间变化能说明反应2A(?)+B(g)2C(?)已达平衡,则A、C不能同时是气体
D.1 mol N2和3 mol H2反应达到平衡时,H2转化率为10%,放出热量Q1;在相同温度和压强下,当2 mol NH3分解为N2和H2的转化率为10%时,吸收热量Q2,Q2不等于Q1
【答案】 B
【微探究】 对于反应H2(g)+I2(g)2HI(g),由于反应物和生成物均为气体,缩小反应容器体积,增大体系压强,正、逆反应速率均加快,A项错误;C(s)+H2O(g)H2(g)+CO(g),碳的质量不再改变说明正、逆反应速率相等,说明反应已达平衡,B项正确;若A、B、C均为气体,压强不再随时间变化也能说明该反应已达平衡,C项错误;根据能量守恒规律和等效平衡,两者应该相等,D项错误。
[应用提能2-2]在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g)C(g)+D(g)已达到平衡状态的是( )
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④混合气体的总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值 ⑦混合气体的总质量 ⑧混合气体的总体积 ⑨C、D的分子数之比为1∶1
A.①③④⑤ B.①③④⑤⑧⑨
C.①②③④⑤⑦ D.①②③④⑤⑥⑦⑧
【答案】 A
【微探究】 可逆反应A(g)+2B(g)C(g)+D(g)为气体体积缩小的反应,该反应达到平衡状态时,正反应速率与逆反应速率相等,各组分的浓度、百分含量不再变化。①该反应前后气体分子数不相同,因此混合气体压强不变能说明达到平衡状态,正确;②反应体系所有物质均为气体,容器容积不变,所以混合气体密度始终不变,密度不变不能说明反应达到平衡状态,错误;③B的物质的量浓度不变,说明B的物质的量不变,说明反应达到平衡状态,正确;④与①相同道理,正确;⑤由于该反应是气体体积改变的反应,气体的质量不变,所以若混合气体的平均相对分子质量不变,则气体的物质的量不变,说明反应处于平衡状态,正确;⑥在任何状态下的相同时间内,v(C)与v(D)的比值都等于其化学计量数之比,因此不能依此判断反应是否处于平衡状态,错误;⑦由于该反应的反应物、生成物都是气体,所以混合气体的总质量一直不变,故不能说明反应处于平衡状态,错误;⑧在定容容器中,混合气体的总体积不能作为判断依据,故不能说明反应处于平衡状态,错误;⑨
反应未达到平衡状态时,C、D气体的分子数之比也可能为1∶1,故不能说明反应处于平衡状态,错误;说明反应已达到平衡状态的是①③④⑤。
化学平衡常数的表达与计算
[典例导考3](2018·温州模拟)碳酸甲乙酯(CH3OCOOC2H5)是一种理想的锂电池有机电解液。生成碳酸甲乙酯的原理为C2H5OCOOC2H5(g)+CH3OCOOCH3(g)2CH3OCOOC2H5(g)。其他条件相同时,CH3OCOOCH3的平衡转化率(α)与温度(T)、反应物配比[R=n(C2H5OCOOC2H5)∶n(CH3OCOOCH3)]的关系如图所示。三种反应物配比分别为1∶1、2∶1、3∶1。下列说法不正确的是( )
A.该反应的正反应ΔH>0
B.增大反应物中CH3OCOOCH3的浓度能提高C2H5OCOOC2H5的平衡转化率
C.650 K,反应物配比为1∶1时,平衡常数K=6
D.当C2H5OCOOC2H5与CH3OCOOC2H5生成速率比为1∶2时,反应达到平衡状态
【审】 本题是平衡常数的应用分析,“三段式”法是有效解答化学平衡计算题的“万能钥匙”。
【切】 解题时,要注意清楚条理地列出起始量、转化量、平衡量,按题目要求进行计算,同时还要注意单位的统一。
【解】 由图可知,配比一定时,温度越高,CH3OCOOCH3的平衡转化率越大,即升高温度平衡向正反应方向移动,则该反应的正反应为吸热反应,所以ΔH>0,A项正确;增大一种反应物的浓度,可以提高其他反应物的转化率,CH3OCOOCH3的含量越高,C2H5OCOOC2H5的转化率越大,B项正确;由图可知,R3表示反应物配比为 1∶1,650 K时CH3OCOOCH3(g)的转化率约为60%,令反应物起始物质的量为1 mol,体系体积为1 L,则
C2H5OCOOC2H5(g)+CH3OCOOCH3(g)2CH3OCOOC2H5(g)
开始/mol: 1 1 0
变化/mol: 0.6 0.6 1.2
平衡/mol: 0.4 0.4 1.2
故该温度下平衡常数K=1.22/(0.4×0.4)=9,C项错误;D项,C2H5OCOOC2H5与CH3OCOOC2H5生成速率分别为逆反应速率和正反应速率,速率之比为1∶2,等于化学计量数之比,正、逆反应速率相等,反应达到平衡,D项正确。
【答】 C
【思】 掌握三个百分数
a.转化率=n(转化)n(起始)×100%=c(转化)c(起始)×100%。
b.产率=产物的实际质量理论产量×100%。
c.混合物中某组分的百分含量=平衡量平衡总量×100%。
[应用提能3]温度为T0时,在容积固定的密闭容器中发生反应:X(g)+Y(g)Z(g)(未配平),4 min时达到平衡,各物质浓度随时间变化的关系如图a所示。其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示。下列叙述正确的是( )
A.发生反应时,各物质的反应速率大小关系为v(X)=v(Y)=2v(Z)
B.图a中反应达到平衡时,Y的转化率为37.5%
C.T0时,该反应的平衡常数为33.3
D.该反应正反应的反应热ΔH<0
【答案】 C
【微探究】 根据题图a可知,0~4 min时,X、Y的浓度均减少0.25 mol·L-1,Z的浓度增加0.5 mol·L-1,则化学方程式为X(g)+Y(g)2Z(g),同一反应中各物质的反应速率之比等于其化学计量数之比,则v(X)=v(Y)=12v(Z),A项错误;题图a中,Y的起始浓度为0.4 mol·L-1,平衡浓度为0.15 mol·L-1,则Y的转化率为(0.4-0.15)mol·L-10.4mol·L-1×100%=62.5%,B项错误;达到平衡时,c(X)=0.05 mol·L-1,c(Y)=0.15 mol·L-1,c(Z)=0.5 mol·L-1,则平衡常数K=c2(Z)c(X)·c(Y)=0.520.05×0.15≈33.3,C项正确;根据题图b可知,T1条件下反应先达到平衡,说明反应速率快,则T1>T2,T2→T1,温度升高,c(Z)增大,则平衡向正反应方向移动,故正反应为吸热反应,ΔH>0,D项错误。