- 2021-07-08 发布 |
- 37.5 KB |
- 12页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
湖北省鄂州市华容高级中学2020届高三上学期第四次月考化学试卷
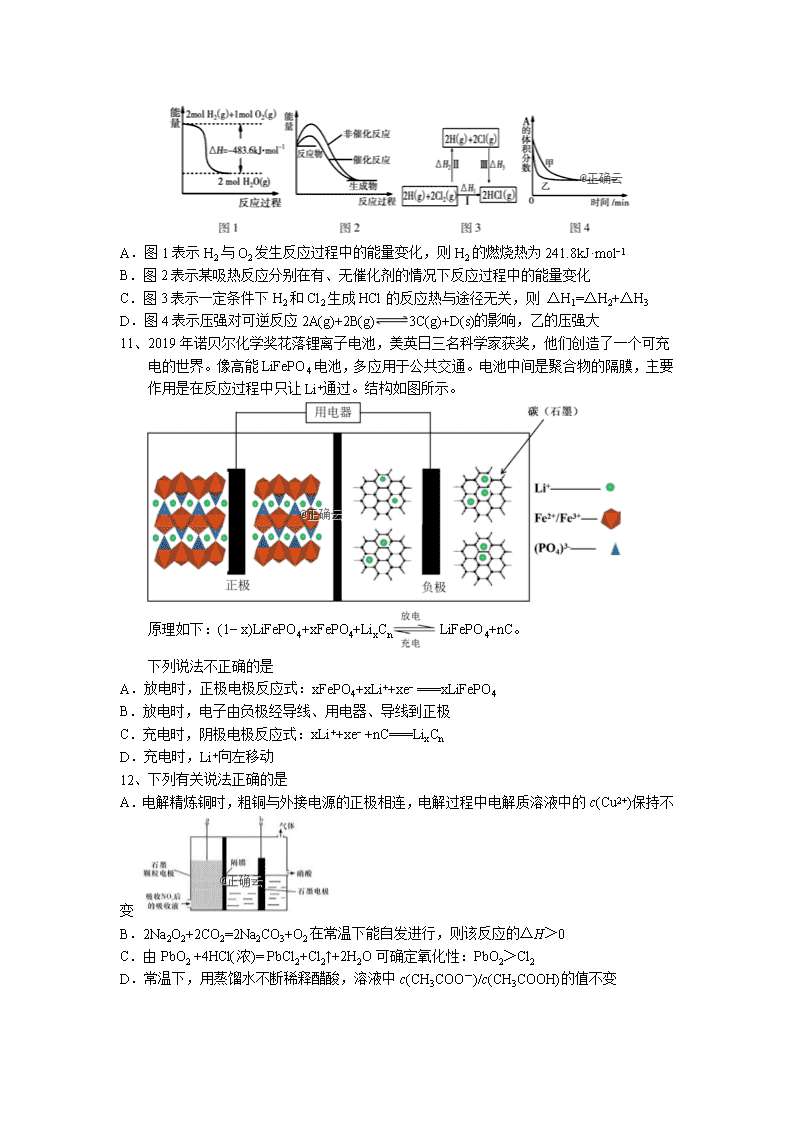
化 学 可能用到的相对原子质量:H-1 C-12 O-16 P-31 S-32 Cl-35.5 K-39 I-127 一、选择题(本题包括 24 小题,每小题 2 分,共 48 分,每小题只有一个选项符合题意) 1、2019 年新版人民币的发行,引发了人们对有关人民币中化学知识的关注。下列表述不正.. 确.的是 A.制造人民币所用的棉花、优质针叶木等原料的主要成分是纤维素 B.用于人民币票面方案等处的油墨中所含有的 Fe3O4 是一种磁性物质 C.防伪荧光油墨由颜料与树脂连接料等制成,其中树脂属于有机高分子材料 D.某种验钞笔中含有碘酒,遇假钞呈现蓝色,其中遇碘变蓝的是葡萄糖 2、《厉害了,我的国》展示了中国五年来探索太空,开发深海,建设世界第一流的高铁、桥 梁、码头,5G 技术联通世界等取得的举世瞩目的成就。它们与化学有着密切联系。下列 说法正确的是 A.“神舟十一号”宇宙飞船返回舱外表面使用的高温结构陶瓷的主要成分是硅酸盐 B.为打造生态文明建设,我国近年来大力发展核电、光电、风电、水电,电能属于一次能 源 C.我国提出网络强国战略,光缆线路总长超过三千万公里,光缆的主要成分是晶体硅 D.大飞机 C919 采用大量先进复合材料、铝锂合金等,铝锂合金属于金属材料 3、某合作学习小组讨论辨析: ①氯化钠固体和氯化氢气体都不导电是因为二者中都不存在离子 ②碳酸钠、氢氧化钡、氯化铵都属于离子化合物 ③醋酸、烧碱和过氧化钠分别属于酸、碱和碱性氧化物 ④氨气、水和硫酸钡分别属于非电解质、弱电解质和强电解质 ⑤碳酸钠晶体在空气中风化是化学变化,硫酸铜晶体溶于水是物理变化 ⑥用玻璃棒蘸取溶液进行焰色反应实验,火焰呈黄色说明溶液中含有 Na+ ⑦用 Ba(NO3)2 溶液、品红试液都可以区分 CO2 和 SO2 这两种气体 上述说法正确的是 A.①④⑤⑥ B.②③⑥⑦ C.②③④⑤ D.②④⑤⑦ 4、设 NA 表示阿伏加德罗常数的值。下列叙述正确的是 A.pH=1 的 H3PO4 溶液中,含有 0.1NA 个 H+ B.常温下,0.1mol 环氧乙烷( )中含有的共价键数为 0.3NA C.含 3.6g 碳的石墨中存在的共价键总数为 0.45NA D.100g 46%的乙醇溶液中,含共价键的数目为 8NA 5、常温下,下列各组离子在指定溶液中一定能大量共存的是 A.1.0 mol·L−1 KNO3 溶液:H+、Fe2+、SCN-、SO2−4 B.pH=7 的 NaCl 溶液:Al3+、Cl-、SO2−4 、NO−3 C. 1010 )( )( OHc Hc 的溶液:K+、Ba2+、NO−3、Cl- D.c(ClO-)=1.0 mol·L-1 的溶液:Na+、I-、S2-、SO2−4 6、下列有关化学用语表示正确的是 A.对硝基甲苯的结构简式: B.HClO 的结构式:H-O-Cl C.CH2F2 的电子式: D.CO2 的比例模型: 7、下列反应的离子方程式书写正确的是 A.少量的 CO2 通入到“84”消毒液中:CO2+H2O+2ClO-=HClO+CO32- B.SO2 通入漂白粉溶液中产生白色浑浊:SO2+Ca2++2ClO-+H2O CaSO3↓+2HClO C.用铝粉和 NaOH 溶液反应制取少量 H2:Al+2OH− AlO2-+H2↑ D.0.1 mol·L-1Ba(OH)2 溶液与 0.1 mol·L-1 NaHCO3 溶液等体积混合: OH-+HCO3-+Ba2+ BaCO3↓+H2O 8、工业酸性废水中的 Cr2O72-可转化为 Cr3+除去,实验室用电解法模拟该过程,结果如下表 所示(实验开始时溶液体积为 50mL,Cr2O72-的起始浓度、电压、电解时间均相同),下列说 法中,错误..的是 实验 ① ② ③ 电解条件 阴、阳极均为石墨 阴、阳极均为石墨, 滴加 1mL 浓硫酸 阴极为石墨,阳极为铁,滴加 1mL 浓硫酸 Cr2O72-的去除率% 0.922 12.7 57.3 A.对比实验①②可知,降低 pH 可以提高 Cr2O72-的去除率 B.实验②中, 2 2 7Cr O 在阴极放电的电极反应式是 2 3 2 7 2Cr O 6e 14H 2Cr 7H O C.实验③中, 2 2 7Cr O 去除率提高的原因是阳极产物还原 Cr2O72- D.实验③中,理论上电路中每通过3mol 电子,则有 0.5molCr2O72-被还原 9、短周期主族元素 原子序数依次增大。由这些元素组成的化合物甲、乙、 丙、丁的 0.1 mo/L 水溶液 如表,丙、丁为二元化合物。甲溶液逐滴滴入丙溶液中,先 产生白色沉淀,后沉淀消失;乙的水溶液可除油污。下列说法一定正确的是 0.1 mo/L 水溶液 甲 乙 丙 丁 pH 13 11 5 1 A.原子半径: B.配制丙溶液时需加入丁溶液 C.乙溶液去油污时只涉及到盐类的水解 D.海水提镁的过程中一定用到化合物甲 10、下列四幅图示所表示的信息与对应的叙述相符的是 A.图 1 表示 H2 与 O2 发生反应过程中的能量变化,则 H2 的燃烧热为 241.8kJ·mol−1 B.图 2 表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 C.图 3 表示一定条件下 H2 和 Cl2 生成 HCl 的反应热与途径无关,则 △H1=△H2+△H3 D.图 4 表示压强对可逆反应 2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强大 11、2019 年诺贝尔化学奖花落锂离子电池,美英日三名科学家获奖,他们创造了一个可充 电的世界。像高能 LiFePO4 电池,多应用于公共交通。电池中间是聚合物的隔膜,主要 作用是在反应过程中只让 Li+通过。结构如图所示。 原理如下:(1− x)LiFePO4+xFePO4+LixCn LiFePO4+nC。 下列说法不正确...的是 A.放电时,正极电极反应式:xFePO4+xLi++xe− ===xLiFePO4 B.放电时,电子由负极经导线、用电器、导线到正极 C.充电时,阴极电极反应式:xLi++xe− +nC===LixCn D.充电时,Li+向左移动 12、下列有关说法正确的是 A.电解精炼铜时,粗铜与外接电源的正极相连,电解过程中电解质溶液中的 c(Cu2+)保持不 变 B.2Na2O2+2CO2=2Na2CO3+O2 在常温下能自发进行,则该反应的△H>0 C.由 PbO2 +4HCl(浓)= PbCl2+Cl2↑+2H2O 可确定氧化性:PbO2>Cl2 D.常温下,用蒸馏水不断稀释醋酸,溶液中 c(CH3COO-)/c(CH3COOH)的值不变 13、直接电解吸收是烟气脱硝的一种有效方法。用 6%的稀硝酸吸收 NOx 会生成亚硝酸, 再将吸收液导入电解槽使之转化为硝酸。电解装置如下所示(阴、阳离子可通过隔膜,但分 子不能通过)下列说法不正确的是 A.吸收 NOx 的过程涉及氧化还原反应 B.石墨电极为颗粒状,可增大接触面积提高电解效率 C.当 a 极转移电子数为 0.5NA 时, b 极放出 11.2L 气体 (标准状况) D.a 极的电极反应式为 HNO2-2e—+H2O === 3H++NO3— 14、500℃时,在容积为 1L 的密闭容器中充入 1mol CO2 和 3mol H2 发生反应: CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H<0。CH3OH 的浓度随时间变化如图, 下列说法不正确...的是( ) A.从反应开始到 10 分钟时,H2 的平均反应速率 v(H2)=0.15 mol/(L•min) B.从 20 分钟到 25 分钟达到新的平衡,可能是增大压强 C.其它条件不变,将温度升到 800℃,再次达平衡时平衡常数减小 D.从开始到 25 分钟,CO2 的转化率是 70% 15、孔雀石主要含 Cu2(OH)2CO3,还含少量 Fe、Si 的化合物。实验室以孔雀石为原料制备 CuSO4·5H2O 及 CaCO3,步骤如下: 下列说法正确的是 A.为将溶液 A 中的 Fe2+氧化为 Fe3+,试剂①可选用双氧水、氯气等 B.流程中所加的 CuO 可以用 Cu2(OH)2CO3 代替 C.溶液 C 通过蒸发结晶即可获得 CuSO4·5H2O D.制备 CaCO3 时,应向 CaCl2 溶液中先加入氨水,再通入过量 CO2 16、下列热化学方程式及有关应用的叙述中,正确的是 A.甲烷的燃烧热为 890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+ 3/2O2(g) ═ CO(g) + 2H2O(l) △H = -890.3kJ•mol-1 B.已知强酸与强碱在稀溶液里反应的中和热为 57.3kJ•mol-1, 则 1/2H2SO4(aq)+1/2Ba(OH)2(aq)═1/2BaSO4(s)+H2O(l) △H < -57.3kJ•mol-1 C.500℃、30MPa 下,将 0.5mol N2 和 1.5molH2 置于密闭的容器中充分反应生成 NH3(g), 放热 19.3kJ,其热化学方程式为:N2(g) + 3H2(g) 2NH3(g) △H = -38.6kJ•mol-1 D.已知 25℃、101KPa 条件下:4Al(s) + 3O2(g) ═ 2A12O3(s) △H = -2834.9kJ•mol-1, 4Al(s) + 2O3(g) ═ 2A12O3(s) △H = -3119.1kJ•mol-1,则 O3 比 O2 稳定 17、为了使 Na2S 溶液中 c(Na+) / c(S-)的比值变小,可加入的物质是( ) ①适量 HCl(g)②适量 NaOH(s)③适量 KOH(s)④适量 NH3(g)⑤适量 KHS(s)⑥适量的水 A.②④ B.①②⑤ C.③④⑤ D.②③ 18、常温下,向 20mL0.05mol·L-1 的某稀酸 H2B 溶液中滴入 0.1mol·L-1 氨水,溶液中由水 电离出氢离子浓度随滴入氨水体积变化如图。下列分析正确的是 A.NaHB 溶液可能为酸性,也可能为碱性 B.A、B、C 三点溶液的 pH 是逐渐减小,D、E、F 三点溶液的 pH 是逐渐增大 C.E 溶液中离子浓度大小关系:c(NH4+)>c(B2-)>c(OH-)>c(H+) D.F 点溶液 c(NH4+)=2c(B2-) 19、某小组利用下面的装置进行实验,②、③中溶液均足量,操作和现象如下表。 实验 操作 现象 Ⅰ 向盛有 Na2S 溶液的①中持 续通入 CO2 至过量 ②中产生黑色沉淀,溶液的 pH 降低; ③中产生白色浑浊,该浑浊遇酸冒气泡 Ⅱ 向盛有 NaHCO3 溶液的①中 持续通入 H2S 气体至过量 现象同实验Ⅰ 资料:CaS 遇水完全水解 由上述实验得出的结论不正确...的是 A.实验Ⅰ①中发生的反应是:CO2+H2O+ S2−== CO32−+ H2S B.②中溶液 pH 降低的原因是:H2S+Cu2+ == CuS↓+2H+ C.③中白色浑浊是 CaCO3 D.由实验Ⅰ和Ⅱ不能比较 H2CO3 和 H2S 酸性的强弱 20、2019 年 10 月 1 日是中华人民共和国成立 70 周年,国庆期间对大量盆栽鲜花施用了 S- 诱抗素制剂以保证鲜花盛开,S-诱抗素的分子结构如图。下列关于该物质的说法正确的 是 A.该有机物的分子式为 C15H21O4 B.该有机物能发生取代、加成和水解反应 C.1mol 该有机物与足量溴反应最多消耗 4mol Br2 D.1mol 该有机物与足量 Na 反应生成生成 1mol H2 21、我国学者研制了一种纳米反应器,用于催化草酸二甲酯(DMO)和氢气反应获得 EG。反 应过程 示意图如下。 下列说法正确的是 A.氢气在该反应中作为催化剂 B.DMO 分子中只有碳氧单键发生了断裂 C.MG 酸性水解的一种产物在一定条件下能形成高分子化合物 D.EG 和甲醇互为同系物 22、类比是研究物质性质的常用方法之一,可预测许多物质的性质。但类比是相对的,不能 违背客观事实。下列说法中正确的是 A.O2 与 Cu 加热生成 CuO,则 S 与 Cu 加热生成 CuS B.SO2 通入 BaCl2 溶液不产生沉淀,则 SO2 通入 Ba(NO3)2 溶液也不产生沉淀 C.根据化合价 Fe3O4 可表示为 FeO•Fe2O3,则 Pb3O4 也可表不为 PbO• Pb2O3 D.CaC2 能水解:CaC2 + 2H2O=Ca(OH)2 + C2H2↑,则 A14C3 也能水解:Al4C3 + 12H2O =4Al(OH)3+3CH4↑ 23、Cl2O 是黄棕色具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水且会与水反应 生成次氯酸,与有机物、还原剂接触或加热时会发生燃烧并爆炸。一种制取 Cl2O 的装置如 图所示。 已知:Cl2O 的熔点为-116 ℃,沸点为 3.8 ℃;Cl2 的沸点为-34.6 ℃;HgO+2Cl2==HgCl2 +Cl2O。 下列说法中不正确的是 A.装置②③中盛装的试剂依次是饱和食盐水和浓硫酸 B.通入干燥空气的目的是将生成的 Cl2O 稀释,减小爆炸危险 C.从装置⑤中逸出气体的主要成分是 Cl2 D.装置④与⑤之间不用橡胶管连接,是为了防止橡胶管燃烧和爆炸 24、通过膜电池可除去废水中的乙酸钠和对氯苯酚( Cl OH ),其原理如右图所 示,下列说法错误..的是 A.a 极的电极反应为: Cl OH+H++2e-→ Cl-+ OHCl OH+H++2e-→ Cl-+ OH B.b 极上的电势比 a 极上的电势低 C.当外电路中有 0.2mole-转移时,通过质子交换膜的 H+的个数为 0.2NA D.电池工作一段时间后,a 极区域的 pH 降低 二、非选择题(本题包括 4 小题,每空 2 分,共 52 分) 25、(14 分)五氧化二碘 可用作氧化剂,除去空气中的一氧化碳,易溶于水形成碘 酸,不溶于无水乙醇、乙醚、氯仿和二硫化碳。用下列装置制备五氧化二碘 加热装置及夹 持装置省略 。 制备五氧化二碘的步骤如下: 步骤 1: 与 按一定比例加入反应器 M 中,用硝酸调节 ,温度控制在 。 搅拌反应 l h,使反应完全。 步骤 2:然后冷却至室温,析出碘酸氢钾 晶体。将过滤得到的晶体加水、加热溶 解,并用足量氢氧化钾溶液中和至溶液 pH 为 10。再冷却结晶,过滤得到的晶体于 干燥 3h, 得到碘酸钾产品。 步骤 3:将步骤 2 制得的碘酸钾酸化后得碘酸 ,再将碘酸在干燥空气气流中加热到 失 水得到五氧化二碘。 五氧化二碘可除去空气中的一氧化碳,反应生成碘单质,该反应中氧化剂与还原剂的物 质的量之比为__________。 仪器 M 的名称是___________________。反扣的漏斗 N 除了可以防止倒吸,还有一个作 用是____________________________________。 步骤 1 中除了生成碘酸氢钾外,同时还生成氯化钾和氯气,若 : :3,写出该 反应的化学方程式:___________________________________________________。 步骤 2 中的主要反应为,称取 0.700g 碘酸钾产品 假设杂质不参与反应 ,将产品放入烧杯 中,加蒸馏水溶解,并加入足量酸化的 KI 溶液,配制成 100 mL 溶液,取 配制的溶液于 锥形瓶中并加入指示剂,然后用 标准溶液滴定至终点,三 次 实 验 平 均 消 耗 标 准 溶 液 的 体 积 为 18.00mL 。 已 知 如何判断该滴定终点。 该碘酸钾产品中碘酸钾的质量分数是____________________ 保留三位有效数字 。 若装 标准溶液的滴定管尖嘴部分滴定前无气泡,滴定后又有气泡,则所测得产品 的质量分数__________ 填“偏高”或“偏低” 。 26、(12 分)某小组同学利用下图所示装置进行铁的电化学腐蚀原理的探究实验: 装置 分别进行的操作 现象 i.连好装置一段时间后,向烧杯中滴 加酚酞 ii.连好装置一段时间后,向烧杯中滴 加 K3[Fe(CN)6]溶液 铁片表面产生蓝 色沉淀 (1)小组同学认为以上两种检验方法,均能证明铁发生了吸氧腐蚀。 ①实验 i 中的现象是。 ②用电极反应式解释实验 i 中的现象:。 (2)查阅资料:K3[Fe(CN)6]具有氧化性。 ①据此有同学认为仅通过 ii 中现象不能证明铁发生了电化学腐蚀,理由是 ___________________________________________。 ②进行下列实验,在实验几分钟后的记录如下: 实验 滴管 试管 现象 0.5 mol·L-1 K3[Fe(CN)6]溶液 iii.蒸馏水 无明显变化 iv.1.0 mol·L-1NaCl 溶液 铁片表面产生大量蓝 色沉淀 v.0.5 mol·L-1Na2SO4 溶液 无明显变化 以上实验表明:在有 Cl-存在条件下,K3[Fe(CN)6]溶液可以与铁片发生反应。为探究的存在 对反应的影响,小组同学将铁片酸洗(用稀硫酸浸泡后洗净)后再进行实验 iii,发现铁片表面 产生蓝色沉淀。此补充实验表明 Cl-的作用是。 (3)有同学认为上述实验仍不够严谨。为进一步探究 K3[Fe(CN)6]的氧化性对实验 ii 结果的 影响,又利用(2)中装置继续实验。其中能证实以上影响确实存在的是______(填字母序号)。 实验 试剂 现象 A 酸洗后的铁片、K3[Fe(CN)6]溶液(已除 O2) 产生蓝色沉淀 B 酸洗后的铁片、K3[Fe(CN)6]和 NaCl 混合溶液(未除 O2) 产生蓝色沉淀 C 铁片、K3[Fe(CN)6]和 NaCl 混合溶液(已除 O2) 产生蓝色沉淀 D 铁片、K3[Fe(CN)6]和盐酸混合溶液(已除 O2) 产生蓝色沉淀 (4)综合以上实验分析,利用实验 ii 中试剂能证实铁发生了电化学腐蚀的实验方案是:连 好装置一段时间后,(回答相关操作、现象),则说明负极附近溶液中产生了 Fe2+,即发生了 电化学腐蚀。 27、(12 分)锂离子电池应用很广。某种锂离子二次电池的电极材料主要是钴酸锂(LiCoO2) 和石墨。钴是一种稀有的贵重金属,废旧锂离子电池电极材料的回收再生意义重大。 (1)锂离子电池(又称锂离子浓差电池)的充电过程:Li+从含 LiCoO2 的电极中脱出,正 三价 Co 被氧化,此时该极处于贫锂态(Li1-xCoO2)。 ①放电时,电流从______(填“a”或“b”)极流出。 ②充电时,a 极的电极反应式为。 (2)钴酸锂回收再生流程如下: ① 用 H2SO4 酸浸时,通常添加 30%的 H2O2 以提高浸出效率,其中 H2O2 的作用是。 ② 用盐酸代替 H2SO4 和 H2O2,浸出效率也很高,但工业上不使用盐酸,主要原因之一是: 会产生有毒、有污染的气体。写出相应反应的化学方程式。 ③ 其他条件不变时,相同反应时间,随着温度升高,含钴酸锂的固体滤渣在 H2SO4 和 30% H2O2 混合液中的浸出率曲线如图,请解释温度高于 80℃,钴的浸出率变化的原因:。 ④ 高温下,在 O2 存在时纯净的 CoC2O4 与 Li2CO3 再生为 LiCoO2 的化学方程式为 。 28.(14 分)研究减少 CO2 排放是一项重要课题。CO2 经催化加氢可以生成低碳有机物, 主要有以下反应: 反应Ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.6 kJ/mol 反应Ⅱ:CH3OCH3(g)+H2O(g) 2CH3OH(g) △H2=+23.4 kJ/mol 反应Ⅲ:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) △H3 (1)△H3=kJ/mol。 (2)恒温恒容条件下,在密闭容器中通入等物质的量的 CO2 和 H2,发生反应 I。下列描述 能说明反应 I 达到平衡状态的是(填序号)。 A.容器内的混合气体的密度保持不变 B.反应体系总压强保持不变 C.断裂 3NA 个 H-O 键同时断裂 2NA 个 C=O 键 D.CH3OH 和 H2O 的浓度之比保持不变 (3)反应 II 在某温度下的平衡常数为 0.25,此温度下,在密闭容器中加入等物质的量的 CH3OCH3(g)和 H2O(g),反应到某时刻测得各组分浓度如下: 物质 CH3OCH3(g) H2O(g) CH3OH(g) 浓度/mol.L-1 1.8 1.8 0.4 此时 v 正________v 逆(填“>”、“<”或“=”),当反应达到平衡状态时,混合气体中 CH3OH 体积分数(CH3OH)% =________%。 (4)在某压强下,反应 III 在不同温度、不同投料比时,CO2 的平衡转化率如图所示。T1 温度下,将 6 mol CO2 和 12 mol H2 充入 2 L 的密闭容器中,5 min 后反应达到平衡状态,则 0~5 min 内的平均反应速率 v(CH3OCH3)=。 (5)恒压下将 CO2 和 H2 按体积比 1:3 混合,在不同催化剂作用下发生反应 I 和反应 III, 在相同的时间段内 CH3OH 的选择性和产率随温度的变化如下图。 其中:CH3OH 的选择性= CH3OH的物质的量 反应的CO2的物质的量 ×100% ①温度高于 230℃,CH3OH 产率随温度升高而下降的原因是。 ②在上述条件下合成甲醇的工业条件是。 A.210℃ B. 230℃ C.催化剂 CZT D.催化剂 CZ(Zr-1)T 化学参考答案 一、选择题(本题包括 24 小题,每小题 2 分,共 48 分,每小题只有一个选项符 合题意) 二、非选择题(本题包括 4 小题,每空 2 分,共 52 分) 25、(14 分) (1)1:5 (2)三颈烧瓶 能增大氯气(或氯气、HNO3)与 NaOH 溶液的接触面积 (3)6 I2+11KClO3+3H2O === 6KH(IO3)2+5KCl+3Cl2↑ (4)滴入最后一滴标准溶液,蓝色恰好褪色,且 30 秒内不复原 91.7 偏低 26、(12 分) (1)①碳棒附近溶液变红 ② O2+4e-+2H2O === 4OH- (2)①K3[Fe(CN)6]可能氧化 Fe 生成 Fe2+,会干扰由于电化学腐蚀负极生成 Fe2 +的检验 ②Cl-破坏了铁片表面的氧化膜 (3)AC (4)取铁片(负极)附近溶液于试管中,滴加 K3[Fe(CN)6]溶液,若出现蓝色沉淀 27、(12 分) (1)①a ② LiCoO2 - xe- = Li1-xCoO2 +xLi+ (2)①还原 LiCoO2(将 LiCoO2 中的+3 价 Co 还原为 Co2+) ②2LiCoO2 +8HCl= 2LiCl+2CoCl2 + Cl2↑+4H2O ③80℃后,升高温度使 H2O2 分解速率加快,H2O2 浓度下降,使浸出率反 而降低 ④ 4CoC2O4+2Li2CO3+3O2 === 4LiCoO2 +10CO2 28、(14 分) (1)-122.6 (2)BC (3)> 20 (4)0.18mol·L−1·min−1 (5)①反应 I 的△H<0 温度升高,使 CO2 转化为 CH3OH 的平衡转化率下降 (其他合理答案也可给分) ②BD 题号 1 2 3 4 5 6 7 8 9 10 11 12 答案 D D D C C B D D B C D C 题号 13 14 15 16 17 18 19 20 21 22 23 24 答案 C B B B C D A D C D C A 高温查看更多