- 2021-07-08 发布 |
- 37.5 KB |
- 25页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届一轮复习浙江专版元素周期表元素周期律学案
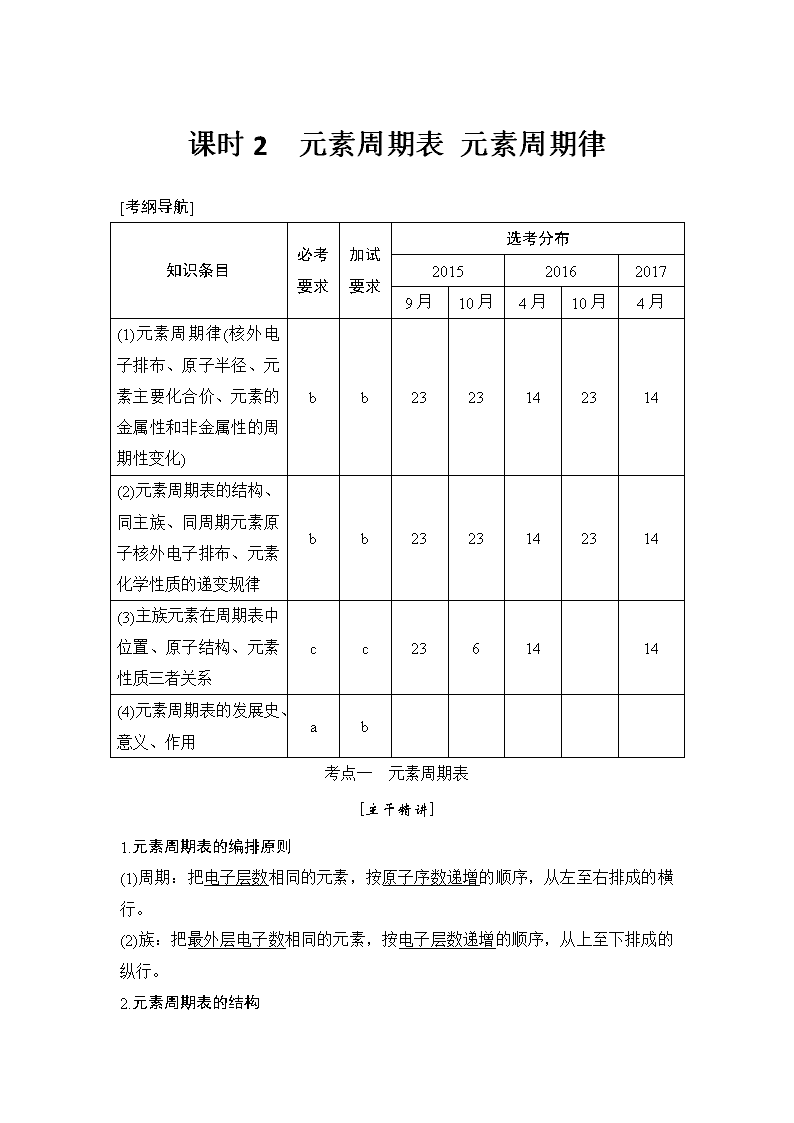
课时 2 元素周期表 元素周期律 [考纲导航] 知识条目 必考 要求 加试 要求 选考分布 2015 2016 2017 9 月 10 月 4 月 10 月 4 月 (1)元素周期律(核外电 子排布、原子半径、元 素主要化合价、元素的 金属性和非金属性的周 期性变化) b b 23 23 14 23 14 (2)元素周期表的结构、 同主族、同周期元素原 子核外电子排布、元素 化学性质的递变规律 b b 23 23 14 23 14 (3)主族元素在周期表中 位置、原子结构、元素 性质三者关系 c c 23 6 14 14 (4)元素周期表的发展 史、意义、作用 a b 考点一 元素周期表 [主干精讲] 1.元素周期表的编排原则 (1)周期:把电子层数相同的元素,按原子序数递增的顺序,从左至右排成的横 行。 (2)族:把最外层电子数相同的元素,按电子层数递增的顺序,从上至下排成的 纵行。 2.元素周期表的结构 (1)周期 短周期 长周期 序号 1 2 3 4 5 6 7 元素种数 2 8 8 18 18 32 不完全周期,最多容纳 32 种元素,目前排了 26 种元素 0 族元素 原子序数 2 10 18 36 54 86 (2)族 ①主族:由短周期元素和长周期元素共同组成的族(第 18 列除外) ②副族:仅由长周期元素组成的族(第 8、9、10 列除外) ③Ⅷ:包括 8、9、10 三个纵列。 ④0 族:第 18 纵列,该族元素又称为稀有气体元素。 列序 1 2 3 4 5 6 7 8 9 10 族序数 ⅠA ⅡA ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ 列序 11 12 13 14 15 16 17 18 族序数 ⅠB ⅡB ⅢA ⅣA ⅤB ⅥA ⅦA 0 3.元素周期表中的特殊位置 (1)分区 ①分界线:沿着元素周期表中铝、锗、锑、钋与硼、硅、砷、碲、砹的交界处画 一条斜线,即为金属元素区和非金属元素区分界线(氢元素除外)。 ②各区位置:分界线左面为金属元素区,分界线右面为非金属元素区。 ③分界线附近元素的性质:既表现金属元素的性质,又表现非金属元素的性质。 (2)过渡元素:元素周期表中部从ⅢB 族到ⅡB 族 10 个纵列共六十多种元素,这 些元素都是金属元素。 (3)镧系:元素周期表第 6 周期中,57 号元素镧到 71 号元素镥共 15 种元素。 (4)锕系:元素周期表第 7 周期中,89 号元素锕到 103 号元素铹共 15 种元素。 (5)超铀元素:在锕系元素中 92 号元素铀(U)以后的各种元素。 4.元素周期表的应用 (1)科学预测:元素周期表为新元素的发现及预测它们原子结构和性质提供线索。 (2)寻找新材料 ①在金属和非金属交界处附近寻找半导体材料; ②在过渡元素中寻找优良的催化剂和耐高温、耐腐蚀的合金材料。 [典例剖析] 【例 1】 (2016·浙江 4 月学考)W、X、Y、Z、M、N 六种主族元素,它们在周 期表中位置如图所示,下列说法不正确的是( ) A.原子半径:Y>Z>W B.单质的还原性:X>Y C.溴与元素 M 同主族,最高价氧化物的水化物的酸性比 M 的强 D.元素 N 位于金属与非金属的分界线附近,可以推断 N 元素的单质可作半导体 材料 解析 根据图中各元素在周期表中位置,可以推断出 W 为氧、X 为钠、Y 为镁、 Z 为硫、M 为氯、N 为锗,据此进行分析。A 项,原子半径:Mg>S>O,A 项正 确;B 项,单质的还原性:Na>Mg,B 项正确;C 项,溴与元素 M(Cl)同主族, 最高价氧化物的水化物的酸性比氯的弱,C 项不正确;D 项,元素锗位于金属与 非金属的分界线附近,锗元素的单质可作半导体材料,D 项正确。 答案 C 【例 2】 (2015·10 月浙江选考)硅元素在周期表中的位置是( ) A.第二周期ⅣA 族 B.第三周期ⅣA 族 C.第三周期ⅥA 族 D.第二周期ⅥA 族 解析 硅元素为 14 号元素,处于周期表中的位置是第三周期ⅣA 族,故 B 项正 确。 答案 B 【例 3】 [2017·金华市十校联考高三(上)期末]短周期元素 X、Y、Z、W 的原子 序数依次增大,且原子最外层电子数之和为 13,X 的原子半径比 Y 的小,X 与 W 同主族,Z 是地壳中含量最高的元素,下列说法正确的是( ) A.原子半径的大小顺序:r(Y)>r(Z)>r(W) B.元素 Z、W 的简单离子的电子层结构不同 C.元素 Y 的简单气态氢化物的热稳定性比 Z 的强 D.只含 X、Y、Z 三种元素的化合物,可能是离子化合物,也可能是共价化合物 解析 Z 是地壳中含量最高的元素,Z 为 O;由 X 的原子半径比 Y 的小,X 与 W 同主族,短周期元素 X、Y、Z、W 的原子序数依次增大,则 X 为 H,W 为 Na;原子最外层电子数之和为 13,则 Y 的最外层电子数为 13-1-1-6=5,Y 为第 2 周期的 N 元素,A.电子层越多,半径越大,同周期原子序数大的原子半 径小,则原子半径为 r(W)>r(Y)>r(Z),故 A 错误;B.元素 Z(O)、W(Na)的简单 离子的电子层结构相同,均有 2 个电子层,最外层电子数为 8,故 B 错误;C. 非金属性 Z>Y,则元素 Y 的简单气态氢化物的热稳定性比 Z 的弱,故 C 错误; D.只含 X、Y、Z 三种元素的化合物,若为硝酸盐,则为离子化合物,若为硝酸, 则是共价化合物,故 D 正确。 答案 D [考点精练] 1.[2017·义乌市群星外国语高三(上)期中]四种短周期 X、Y、Z、W 在元素周期表 中的位置如图所示。已知 X、Y、Z 三种元素的原子最外层电子数之和为 15。下 列说法正确的是( ) X Z Y W A.X 是第ⅢA 元素,Z 是第ⅤA 元素 B.原子半径大小关系:r(Y)<r(W) C.Y 的气态氢化物比 Z 的气态氢化物稳定 D.X、Y、W 三种元素的最高化合价依次升高 解析 A.由图分析可知 X 为ⅣA 族,Z 为ⅥA 族元素,故 A 错误;B.同周期元 素从左到右原子半径逐渐减小,则 r(Y)>r(W),故 B 错误;C.非金属性 O>P, 元素的非金属性越强,对应的氢化物越稳定,故 C 错误;D.X、Y、W 三种元素 的最高化合价分别为+4、+5、+6,依次升高,故 D 正确。 答案 D 2.如图所示,元素周期表中的金属和非金属元素的分界线用虚线表示。下列说法 正确的是( ) A.虚线右上方的元素为金属元素 B.第 6 周期ⅤA 族的元素为非金属元素 C.可在虚线附近寻找用于制造半导体材料的元素 D.可在虚线附近寻找稀土元素 解析 虚线右上方的元素为非金属元素,A 错;第 6 周期ⅤA 族的元素是铋,为 金属元素,B 错;可在虚线附近寻找用于制造半导体材料的元素,C 对,D 错。 答案 C 【归纳总结】 元素周期表结构 【规律小结】 元素周期表结构中隐含的两条规律 1.同周期主族元素原子序数差的关系 (1)短周期元素原子序数差=族序数差; (2)两元素分布在过渡元素同侧时,原子序数差=族序数差。两元素分布在过渡 元素两侧时,四或五周期元素原子序数差=族序数差+10,六周期元素原子序数 差=族序数差+24; (3)四、五周期的ⅡA 与ⅢA 族原子序数之差都为 11,六周期ⅡA 与ⅢA 族原子 序数之差为 25。 2.同主族、邻周期元素的原子序数差的关系 (1)ⅠA 族元素,随电子层数的增加,原子序数依次相差 2、8、8、18、18、32; (2)ⅡA 族元素,随电子层数的增加,原子序数依次相差 8、8、18、18、32; (3)ⅢA~ⅦA 族元素,随电子层数的增加,原子序数依次相差 8、18、18、32、 32。 (4)0 族元素,随电子层数的增加,原子序数依次相差 8、8、18、18、32、32。 考点二 元素周期律 [主干精讲] 1.元素周期律 元素的性质随着元素核电荷数的递增而呈现周期性变化的规律。 2.元素周期律的实质 元素性质的周期性变化是元素原子核外电子排布周期性变化的必然结果。 3.元素周期表中主族元素性质的递变规律 项目 同周期(左→右) 同主族(上→下) 原子 结构 核电荷数 逐渐增大 逐渐增大 电子层数 相等 逐渐增加 原子半径 逐渐减小 逐渐增大 性质 化合价 最高正化合价由+1→+ 7(O、F 除外) 负化合价=-(8-最外层 电子数) 相同最高正化合价=主 族序数(O、F 除外) 元 素 的 金 属 性 和非金属性 金属性逐渐减弱 非金属性逐渐增强 金属性逐渐增强 非金属性逐渐减弱 离子的氧化性、 还原性 阳离子氧化性逐渐增强 阴离子还原性逐渐减弱 阳离子氧化性逐渐减弱 阴离子还原性逐渐增强 气 态 氢 化 物 稳 定性 逐渐增强 逐渐减弱 最 高 价 氧 化 物 对 应 的 水 化 物 碱性逐渐减弱 酸性逐渐增强 碱性逐渐增强 酸性逐渐减弱 的酸碱性 [典例剖析] 【例 1】 (2017·4 月浙江选考)W、X、Y、Z 四种短周期元素,它们在周期表中 位置如图所示,下列说法不正确的是( ) A.Z、Y、X 的原子半径依次减小,非金属性依次降低 B.Z、Y、W 的最高价氧化物的水化物的酸性依次降低 C.WH4 与 Z 元素的单质在一定条件下可发生化学变化 D.W 的位置是第 2 周期、第ⅣA 族 解析 本题为容易题。熟记短周期元素种类,牢记元素周期律中原子半径、非金 属性和金属性、最高价氧化物的酸性变化规律,易选出 A 选项错误。C 选项 CH4 和 Cl2 光照条件下可以发生取代反应。 答案 A 【例 2】 (2015·10 月浙江选考)右图为元素周期表中短周期主族非金属元素的 一部分,下列说法不正确的是( ) X Y Z W A.W 的原子序数可能是 Y 的两倍 B.Z 的原子半径比 X 的大 C.Y 元素的非金属性比 Z 元素的强 D.Z 的最高价氧化物对应水化物的酸性比 W 的强 解析 A 项,如 S 的原子序数是 O 的两倍,正确;B 项,Z 在 X 的下一周期, 原子半径比 X 的大,正确;C 项,依据元素在元素周期表中的相对位置,正确; D 项,因非金属性:W>Z,故 W 的最高价氧化物对应水化物的酸性比 Z 的强, 不正确。 答案 D 【例 3】 根据元素周期律,由下列事实进行归纳推测,推测不合理的是( ) 事实 推测 A 12Mg 与水反应缓慢,20Ca 与水反应较快 56Ba(ⅡA 族)与水反应会更快 B Si 是半导体材料,同族的 Ge 也是半导体 材料 ⅣA 族的元素都是半导体材料 C HCl 在 1500 ℃时分解,HI 在 230 ℃时分 解 HBr 的分解温度介于二者之间 D Si 与 H2 在高温时反应,S 与 H2 在加热时 能反应 P 与 H2 在高温时能反应 解析 同主族金属元素由上至下金属性增强,与水反应剧烈程度增强,A 项正确; 半导体材料通常位于元素周期表中金属元素和非金属元素的分界处,第ⅣA 族元 素并不都是半导体材料,B 项错误;同主族非金属元素由上至下非金属性减弱, 气态氢化物的热稳定性减弱,C 项正确;同周期非金属元素从左到右非金属性增 强,与氢气化合难度减小,D 项正确。 答案 B [考点精练] 1.(2017·绍兴选考适应性考试)如图是部分短周期元素主要化合价与原子序数的 关系图,下列说法不正确的是( ) A.X 和 W 位于同一主族 B.原子半径:Y>Z>X C.盐 YRX 与化合物 WX2 的漂白原理相同 D.Y 和 R 两者的最高价氧化物对应的水化物能相互反应 解析 由图可知,原子序数由大到小的元素为 R、W、Z、Y、X;再根据元素的 主要化合价可推断 X 为 O,Y 为 Na,Z 为 Al,W 为 S,R 为 Cl。A 项,X(O) 与 W(S)位于同一主族,正确;B 项原子半径 Y(Na)>Z(Al)>X(O),正确;C 项 盐 YRX 为 NaClO,其漂白原理是因为漂白过程中产生具有强氧化性的 HClO, 而 WX2(SO2)的漂白性是 SO2 与有颜色的物质发生化合反应生成无色的不稳定的 化合物,错误。 答案 C 2.(2016·浙江余姚中学高二下期中)下列各组粒子中粒子半径由大到小的是 ( ) A.O、Cl、S、P B.Al3+、Mg2+、Ca2+、Ba2+ C.K+、Mg2+、Al3+、H+ D.Li、Na、K、Cs 解析 比较粒子半径有以下原则:①同周期元素原子半径从左到右逐渐减小,A 为 P>S>Cl>O,②同主族元素原子半径从上到下逐渐增大,③核外电子排布相 同时,核电荷数越大,微粒半径越小,Mg2+>Al3+,④各层排布都饱和,一般电 子层数越多,微粒半径越大。故只有 C 正确。 答案 C 3.下列有关性质的比较,不能..用元素周期律解释的是( ) A.酸性:H2SO4>H3PO4 B.非金属性:Cl>Br C.碱性:NaOH>Mg(OH)2 D.热稳定性:Na2CO3>NaHCO3 解析 A 项,同周期元素自左向右其最高价氧化物对应水化物酸性增强,酸性: H2SO4>H3PO4,能用元素周期律解释;B 项,同主族元素自上而下非金属性逐 渐减弱,非金属性 Cl>Br,能用元素周期律解释;C 项,同周期元素自左向右 其最高价氧化物对应水化物碱性减弱,碱性:NaOH>Mg(OH)2,能用元素周期 律解释;D 项,碳酸盐的热稳定性大于其碳酸氢盐的热稳定性,如热稳定性: Na2CO3>NaHCO3,与元素周期律无关。 答案 D 【规律方法】 微粒半径的比较 【易错警示】 元素周期律和元素性质中的易错点 (1)误认为主族元素的最高正价一定等于族序数,忽视了氧无最高正价,氟无正 价。 (2)误认为元素的非金属性越强,其氧化物对应水化物的酸性就越强,但 HClO、 H2SO3 是弱酸,忽视了关键词“最高价”。 (3)误认为失电子难的原子得电子的能力一定强,忽视了稀有气体元素的原子, 失电子难,得电子也难。 (4)元素原子得失电子的数目与元素的非金属性、金属性强弱没有必然的联系。 误认为得(失)电子的数目越多,元素的非金属性(金属性)越强。 (5)误认为同周期相邻两主族元素原子序数之差等于 1,忽视了长周期也有相差 11 或 25 的情况。 (6)误认为最高正价和最低负价绝对值相等的元素只有ⅣA 族的某些元素。忽视 了ⅠA 族的 H 的最高正价为+1,最低负价为-1。 考点三 元素的金属性和非金属性 [主干精讲] 元素金属性强弱和元素非金属性强弱比较 (1)结构比较依据 ①最外层电子数越少,电子层越多,元素的金属性越强。 ②最外层电子数越多,电子层数越少,元素非金属性越强。 (2)位置比较依据 (3)实验比较依据 [典例剖析] 【例 1】 (2016·10 月浙江选考)W、X、Y、Z 四种短周期元素,它们在周期表 中位置如图所示,下列说法不正确的是( ) A.W、Y、X 三种元素的原子半径依次减小 B.Z 元素的气态氢化物的热稳定性比 Y 的高 C.W 元素与氢元素可能会形成 W2H6 D.Y 元素的单质能从 NaZ 溶液中置换出 Z 元素的单质 解析 同一周期元素,随原子序数递增,原子半径减小,A 正确;同一周期元素, 随原子序数递增,元素的非金属性增强,非金属性 Z>Y,气态氢化物的稳定性: Z>Y,B 正确,D 错误;W 为硅元素,类似于碳可以形成乙硅烷(Si2H6),C 正确。 答案 D 【例 2】 (2015·9 月浙江选考)四种短周期元素的相关信息如下表所示: 元素 相关信息 X 它存在多种同素异形体,可用于制作钻头、电极和纳米材料等 Y 最外层电子数是内层电子数的 3 倍 Z 第 3 周期中最高价氧化物的水化物碱性最强 W 与 X 元素处于同一主族,工业上常用 X 的单质还原 W 的氧化物 制取 W 单质 下列说法正确的是( ) A.原子半径:W>Z>Y>X B.Y、Z 两种元素只能形成化合物 Z2Y C.最低价气态氢化物的热稳定性:W>X D.最高价氧化物对应水化物的酸性:X>W 解析 根据题意,X 元素的同素异形体可制作钻头(金刚石)、电极(石墨)等,故 X 元素是碳元素;Y 元素最外层电子数是内层电子数的 3 倍,则 Y 元素是氧元 素;Z 元素是第 3 周期中最高价氧化物的水化物碱性最强,则 Z 为 Na 元素;W 元素与 X 元素处于同一主族,工业上常用 X 还原 W 的氧化物制取 W 单质,则 W 是 Si 元素。根据同周期和同主族原子半径大小规律知它们的原子半径:Na> Si>C>O,A 项错误;O、Na 两种元素形成 Na2O、Na2O2,B 项错误;Si、C 的 最低价气态氢化物的热稳定性:CH4>SiH4,C 项错误;Si、C 的最高价氧化物 对应水化物的酸性:H2CO3>H2SiO3,D 项正确。 答案 D [考点精练] 1.下列叙述能说明金属 A 比金属 B 更活泼的是( ) A.A 原子的最外层电子数比 B 原子的最外层电子数少 B.A 原子电子层数比 B 原子的电子层数多 C.1 mol A 从酸中置换生成的 H2 比 1 mol B 从酸中置换生成的 H2 多 D.常温下,A 能从水中置换出氢,而 B 不能 解析 金属 A 比金属 B 活泼的依据是 A 比 B 更易失去电子,而失电子的能力并 不取决于最外层电子数的多少、电子层数的多少、以及与酸反应置换出 H2 的多 少,而是取决于其与酸(或 H2O)反应置换出氢的难易程度。 答案 D 2.X、Y、Z 均为短周期主族元素,已知它们的原子序数的关系为 X+Z=2Y,且 Z 的最高价氧化物对应的水化物是强酸。则下列有关说法不正确的是( ) A.若 X 是 O,则 YX 一定是离子化合物 B.若 Y 是 O,则 X、Y、Z 一定位于同一周期 C.若 X 是 Na,则非金属性一定是 Y>Z D.若 Y 是 Na,则 X、Z 可能是同一主族元素 解析 根据 Z 的最高价氧化物对应的水化物是强酸,可知 Z 元素可能为 N 或 S 或 Cl。再根据题中所给原子序数的关系可知,X 与 Z 的原子序数之和为偶数, 则 X 与 Z 的原子序数一定同为奇数或同为偶数。若 X 是 O,Z 只能为 S,则 Y 为 Mg,MgO 是离子化合物,A 正确;若 Y 是 O,Z 只能为 N,则 X 为 F,B 正 确;若 X 是 Na,Z 是为 N,则 Y 为 P,C 错误;若 Y 是 Na,则 Z 为 N、X 为 P 或 Z 为 S、X 为 C 或 Z 为 Cl、X 为 B,D 正确。 答案 C 3.(2016·浙江东阳中学高二下期中)下列叙述中正确的是( ) A.进行 H2O 和 H2S 的热分解实验,可确定 S、O 两种元素的非金属性强弱 B.根据非金属性强弱 F>Cl,可以推测沸点 HF>HCl C.已知 2C+SiO2=====高温 Si+2CO↑,说明 C 的非金属性比 Si 强 D.H2SO3 的酸性比 H2CO3 的酸性强,说明 S 的非金属性比 C 强 解析 A 项,非金属性越强,氢化物的稳定性越强,则进行 H2O 和 H2S 的热分 解实验,可确定 S、O 两种元素的非金属性强弱,A 正确;B 项,非金属性强弱 与氢化物的沸点没有关系,氟化氢分子间存在氢键,沸点高于氯化氢,B 错误; C 项,已知 2C+SiO2=====高温 Si+2CO↑,不能说明 C 的非金属性比 Si 强,因为该 反应是难挥发性物质制备易挥发性物质,C 错误;D 项,H2SO3 的酸性比 H2CO3 的酸性强,但亚硫酸不是最高价含氧酸,则不能说明 S 的非金属性比 C 强,D 错误。 答案 A 【归纳总结】 1.同一元素的“位—构—性”之间的关系 2.规律方法 元素在周期表中的位置推断方法 (1)依据电子排布规律推断位置 ①最外层电子数等于或大于 3 且小于 8 的一定是主族元素。 ②最外层有 1 个或 2 个电子,则可能是第ⅠA 族、ⅡA 族元素,也可能是副族元 素、第Ⅷ族元素或 0 族元素氦。 ③最外层电子数比次外层电子数多的短周期元素一定位于第二周期。 ④某元素阴离子的最外层电子数与次外层电子数相同,该元素位于第三周期。 ⑤电子层结构相同的离子,若电性相同,则对应的元素位于同周期;若电性不同, 则阳离子对应的元素位于阴离子对应的元素的下一周期。 (2)根据元素化合价的特征关系推断位置 ①根据等式确定元素在周期表中的位置: 最高正化合价=最外层电子数=主族序数(O、F 例外) ②如果已知最低负化合价(或阴离子的符号),则须用等式先求出最高正化合价: 最高正化合价=8-|最低负化合价|,再确定元素在周期表中的位置。 (3)利用元素的特征来推断元素的位置 如根据“形成化合物最多的元素”、“空气中含量最多的元素”、“地壳中含量最多 的元素”等特征来推断。 (4)根据稀有气体的原子序数推断位置 各周期最后的元素都是稀有气体元素,熟记这些原子序数,用来推断元素在周期 表中的位置。 课后限时训练 (时间:45 分钟) 一、选择题 1.下列有关物质性质的说法错误的是( ) A.热稳定性:HCl>HI B.原子半径:Na>Mg C.酸性:H2SO3>H2SO4 D.结合质子能力:S2->Cl- 解析 A 项,元素的非金属性越强,其氢化物的稳定性就越强。元素的非金属性 Cl>I,所以稳定性 HCl>HI。B 项,Na、Mg 是同一周期的元素,同一周期的元 素,元素的原子序数越小,原子半径就越大。因此原子半径:Na>Mg,正确。 C 项,H2SO3 是中强酸,H2SO4 是强酸,所以酸性:H2SO4>H2SO3,错误。D 项, 元素的非金属性越强,其简单离子结合氢离子的浓度就越弱。非金属性 Cl>S, 所以结合质子能力:S2->Cl-,正确。 答案 C 2.(2016·杭州市七校高一下期中)下列各组顺序的排列不正确的是( ) A.原子半径:F>Na>Mg>Al B.热稳定性:HCl>H2S>PH3 C.酸性强弱:H2CO3查看更多
相关文章
- 当前文档收益归属上传用户