- 2021-07-08 发布 |
- 37.5 KB |
- 8页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
甘肃省酒泉市敦煌中学2020届高三上学期调研考试化学试卷
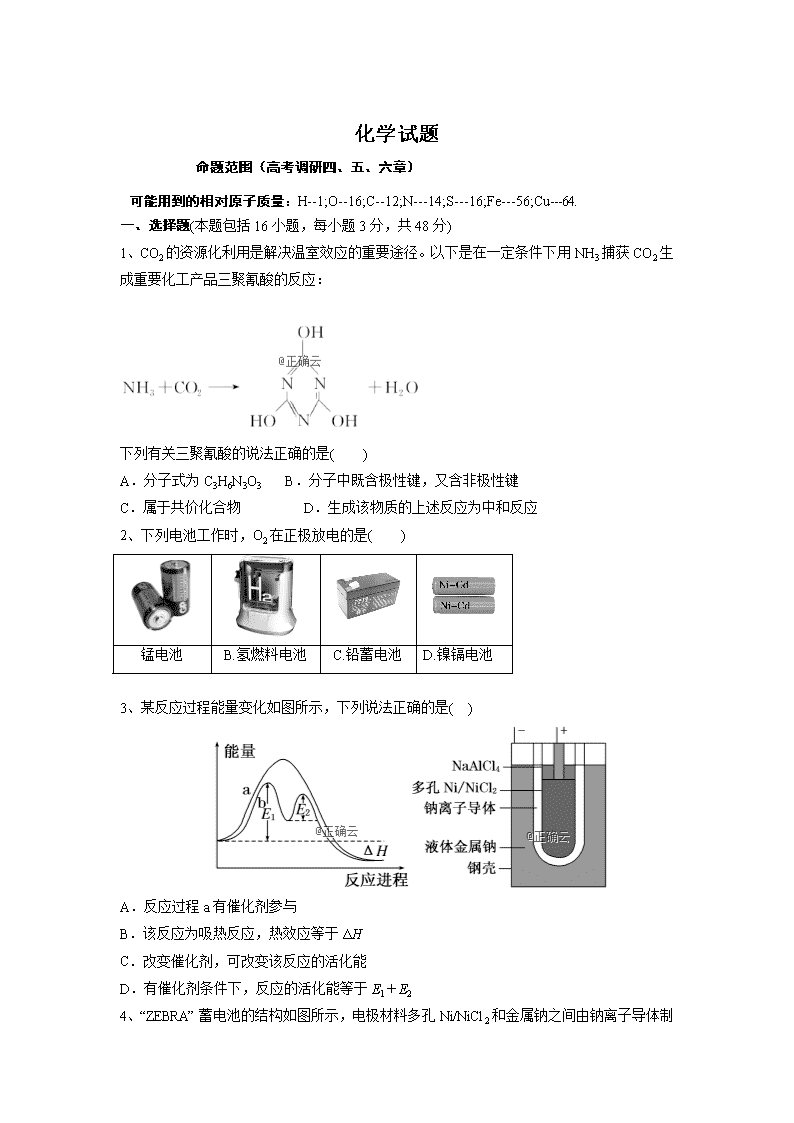
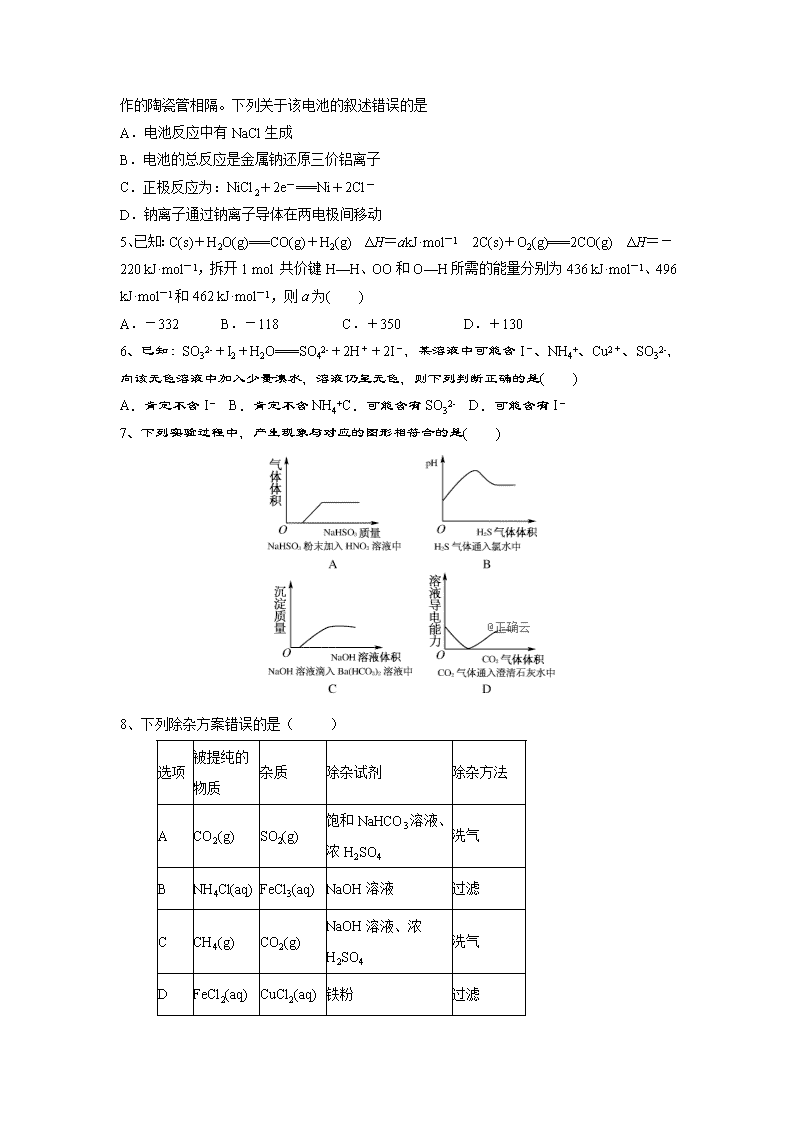
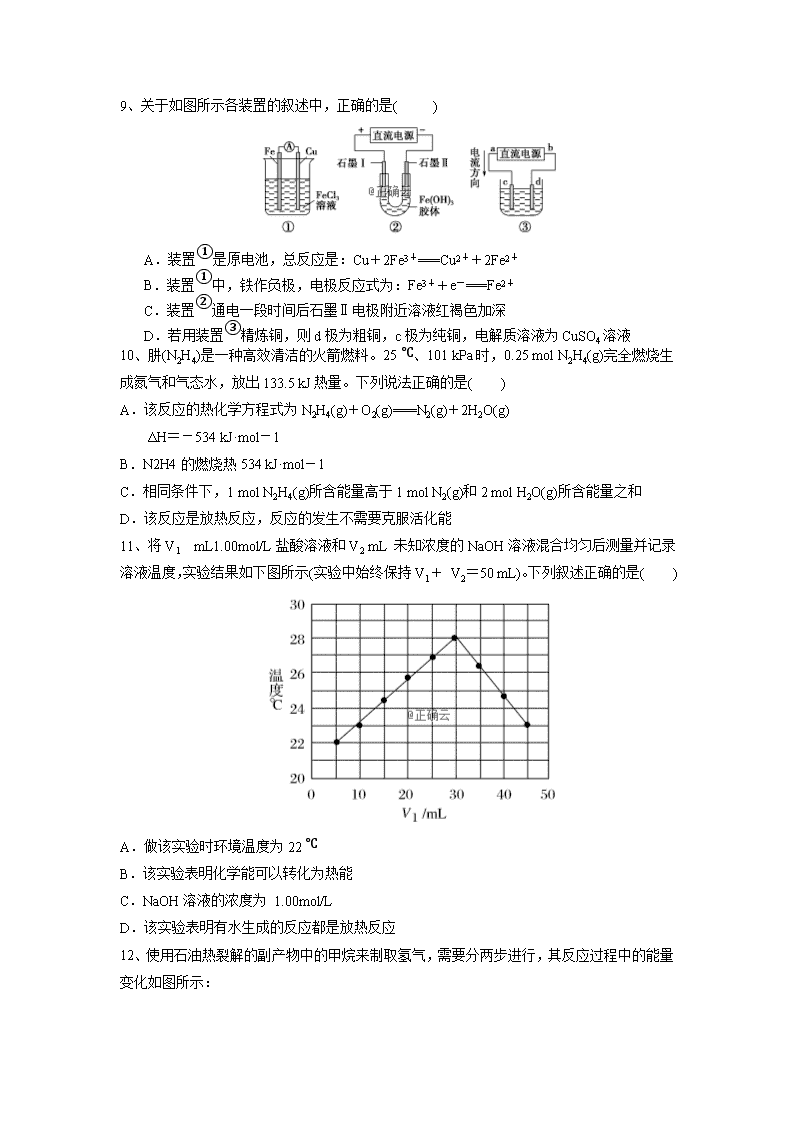
化学试题 命题范围(高考调研四、五、六章) 可能用到的相对原子质量:H--1;O--16;C--12;N---14;S---16;Fe---56;Cu---64. 一、选择题(本题包括16小题,每小题3分,共48分) 1、CO2的资源化利用是解决温室效应的重要途径。以下是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰酸的反应: 下列有关三聚氰酸的说法正确的是( ) A.分子式为C3H6N3O3 B.分子中既含极性键,又含非极性键 C.属于共价化合物 D.生成该物质的上述反应为中和反应 2、下列电池工作时,O2在正极放电的是( ) 锰电池 B.氢燃料电池 C.铅蓄电池 D.镍镉电池 3、某反应过程能量变化如图所示,下列说法正确的是( ) A.反应过程a有催化剂参与 B.该反应为吸热反应,热效应等于ΔH C.改变催化剂,可改变该反应的活化能 D.有催化剂条件下,反应的活化能等于E1+E2 4、“ZEBRA”蓄电池的结构如图所示,电极材料多孔Ni/NiCl2 和金属钠之间由钠离子导体制作的陶瓷管相隔。下列关于该电池的叙述错误的是 A.电池反应中有NaCl生成 B.电池的总反应是金属钠还原三价铝离子 C.正极反应为:NiCl2+2e-===Ni+2Cl- D.钠离子通过钠离子导体在两电极间移动 5、已知:C(s)+H2O(g)===CO(g)+H2(g) ΔH=akJ·mol-1 2C(s)+O2(g)===2CO(g) ΔH=-220 kJ·mol-1,拆开1 mol 共价键H—H、OO和O—H所需的能量分别为436 kJ·mol-1、496 kJ·mol-1和462 kJ·mol-1,则a为( ) A.-332 B.-118 C.+350 D.+130 6、已知:SO32-+I2+H2O===SO42-+2H++2I-,某溶液中可能含I-、NH4+、Cu2+、SO32-,向该无色溶液中加入少量溴水,溶液仍呈无色,则下列判断正确的是( ) A.肯定不含I- B.肯定不含NH4+C.可能含有SO32- D.可能含有I- 7、下列实验过程中,产生现象与对应的图形相符合的是( ) 8、下列除杂方案错误的是( ) 选项 被提纯的物质 杂质 除杂试剂 除杂方法 A CO2(g) SO2(g) 饱和NaHCO3溶液、浓H2SO4 洗气 B NH4Cl(aq) FeCl3(aq) NaOH溶液 过滤 C CH4(g) CO2(g) NaOH溶液、浓H2SO4 洗气 D FeCl2(aq) CuCl2(aq) 铁粉 过滤 9、关于如图所示各装置的叙述中,正确的是( ) A.装置①是原电池,总反应是:Cu+2Fe3+===Cu2++2Fe2+ B.装置①中,铁作负极,电极反应式为:Fe3++e-===Fe2+ C.装置②通电一段时间后石墨Ⅱ电极附近溶液红褐色加深 D.若用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液 10、肼(N2H4)是一种高效清洁的火箭燃料。25 ℃、101 kPa时,0.25 mol N2H4(g)完全燃烧生成氮气和气态水,放出133.5 kJ热量。下列说法正确的是( ) A.该反应的热化学方程式为N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534 kJ·mol-1 B.N2H4的燃烧热534 kJ·mol-1 C.相同条件下,1 mol N2H4(g)所含能量高于1 mol N2(g)和2 mol H2O(g)所含能量之和 D.该反应是放热反应,反应的发生不需要克服活化能 11、将V1 mL1.00mol/L盐酸溶液和V2 mL 未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+ V2=50 mL)。下列叙述正确的是( ) A.做该实验时环境温度为22 ℃ B.该实验表明化学能可以转化为热能 C.NaOH溶液的浓度为 1.00mol/L D.该实验表明有水生成的反应都是放热反应 12、使用石油热裂解的副产物中的甲烷来制取氢气,需要分两步进行,其反应过程中的能量变化如图所示: 则甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式为( ) A.CH4(g)+H2O(g)===3H2(g)+CO(g) ΔH=-103.3 kJ/mol B.CH4(g)+2H2O(g)===4H2(g)+CO2(g) ΔH=-70.1 kJ/mol C.CH4(g)+2H2O(g)===4H2(g)+CO2(g) ΔH=+70.1 kJ/mol D.CH4(g)+2H2O(g)===4H2(g)+CO2(g) ΔH=-136.5 kJ/mol 13、短周期元素W、X、Y、Z的原子序数依次增大,其中W的阴离子的核外电子数与X、Y、Z原子的核外内层电子数相同。X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质,而Z不能形成双原子分子。根据以上叙述,下列说法中正确的是( ) A.上述四种元素的原子半径大小为W查看更多
相关文章
- 当前文档收益归属上传用户