- 2021-07-08 发布 |
- 37.5 KB |
- 6页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019-2020学年黑龙江省大庆铁人中学高一上学期期末考试 化学
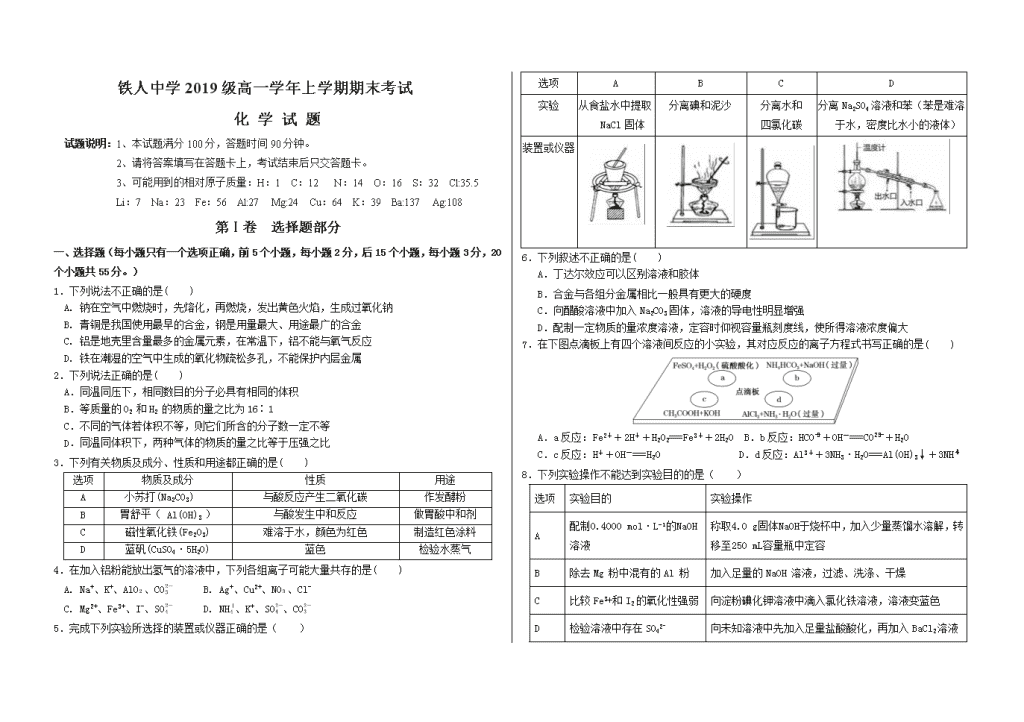
铁人中学2019级高一学年上学期期末考试 化 学 试 题 试题说明:1、本试题满分100分,答题时间90分钟。 2、请将答案填写在答题卡上,考试结束后只交答题卡。 3、可能用到的相对原子质量:H:1 C:12 N:14 O:16 S:32 Cl:35.5 Li:7 Na:23 Fe:56 Al:27 Mg:24 Cu:64 K:39 Ba:137 Ag:108 第Ⅰ卷 选择题部分 一、选择题(每小题只有一个选项正确,前5个小题,每小题2分,后15个小题,每小题3分,20个小题共55分。) 1.下列说法不正确的是( ) A. 钠在空气中燃烧时,先熔化,再燃烧,发出黄色火焰,生成过氧化钠 B. 青铜是我国使用最早的合金,钢是用量最大、用途最广的合金 C. 铝是地壳里含量最多的金属元素,在常温下,铝不能与氧气反应 D. 铁在潮湿的空气中生成的氧化物疏松多孔,不能保护内层金属 2.下列说法正确的是( ) A.同温同压下,相同数目的分子必具有相同的体积 B.等质量的O2 和H2 的物质的量之比为16∶1 C.不同的气体若体积不等,则它们所含的分子数一定不等 D.同温同体积下,两种气体的物质的量之比等于压强之比 3.下列有关物质及成分、性质和用途都正确的是( ) 选项 物质及成分 性质 用途 A 小苏打(Na2CO3) 与酸反应产生二氧化碳 作发酵粉 B 胃舒平( Al(OH)3 ) 与酸发生中和反应 做胃酸中和剂 C 磁性氧化铁(Fe2O3) 难溶于水,颜色为红色 制造红色涂料 D 蓝矾(CuSO4·5H2O) 蓝色 检验水蒸气 4.在加入铝粉能放出氢气的溶液中,下列各组离子可能大量共存的是( ) A. Na+、K+、AlO、CO B. Ag+、Cu2+、NO、Cl- C. Mg2+、Fe3+、I-、SO D. NH、K+、SO、CO 5.完成下列实验所选择的装置或仪器正确的是( ) 选项 A B C D 实验 从食盐水中提取NaCl固体 分离碘和泥沙 分离水和 四氯化碳 分离Na2SO4溶液和苯(苯是难溶于水,密度比水小的液体) 装置或仪器 6.下列叙述不正确的是( ) A.丁达尔效应可以区别溶液和胶体 B.合金与各组分金属相比一般具有更大的硬度 C.向醋酸溶液中加入Na2CO3固体,溶液的导电性明显增强 D.配制一定物质的量浓度溶液,定容时仰视容量瓶刻度线,使所得溶液浓度偏大 7.在下图点滴板上有四个溶液间反应的小实验,其对应反应的离子方程式书写正确的是( ) A.a反应:Fe2++2H++H2O2===Fe3++2H2O B.b反应:HCO+OH-===CO+H2O C.c反应:H++OH-===H2O D.d反应:Al3++3NH3·H2O===Al(OH)3↓+3NH 8.下列实验操作不能达到实验目的的是( ) 选项 实验目的 实验操作 A 配制0.4000 mol·L−1的NaOH溶液 称取4.0 g固体NaOH于烧杯中,加入少量蒸馏水溶解,转移至250 mL容量瓶中定容 B 除去Mg 粉中混有的Al 粉 加入足量的NaOH 溶液,过滤、洗涤、干燥 C 比较Fe3+和I2的氧化性强弱 向淀粉碘化钾溶液中滴入氯化铁溶液,溶液变蓝色 D 检验溶液中存在SO42‾ 向未知溶液中先加入足量盐酸酸化,再加入BaCl2溶液 9.已知Fe3O4可表示成FeO·Fe2O3,水热法制备Fe3O4纳米颗粒的总反应为: 3Fe2++2S2O32-+O2+4OH- Fe3O4+S4O62-+2H2O。下列说法正确的是( ) A.O2和S2O32-是氧化剂,Fe2+是还原剂 B. 参加反应的氧化剂与还原剂的物质的量之比为1∶5 C. 每生成1 mol Fe3O4 ,转移电子的物质的量为2 mol D. 若有2 mol Fe2+被氧化,则被Fe2+还原的O2为0.5 mol 10.阿伏加德罗常数的值为NA,下列叙述中错误的是( ) ①标准状况下,2.24 L水中含有0.1 NA个水分子 ②常温常压下,32g SO2 含有的分子数为0. 5NA ③2 mol NaOH的摩尔质量为80g/mol ④H2的气体摩尔体积约为22.4L/mol ⑤1molNa2O2与足量的CO2反应转移的电子数为NA ⑥2mol/L的CaCl2溶液中Cl-的数目为4NA ⑦常温常压下,1mol氦气含有的原子数为NA ⑧11.2 L氯气中含有 NA个氯原子 ⑨在标准状况下,22.4L由N2和N2O组成的混合气体中,所含有的氮原子的物质的量为2mol ⑩标准状况下14gCO含有的核外电子数为10NA A.4个 B.5个 C.6个 D. 7个 11.下列说法正确的是( ) A. 节日里燃放的五彩缤纷的烟花是某些金属元素化学性质的展现 B. 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来,说明金属铝的熔点较低 C. 将等物质的量的氧化钠和过氧化钠分别投入到足量且等质量的水中,得到溶质质量分数分别是a%和b%的两种溶液,则a和b的关系是a=b D. 用如图装置进行实验,将装置①中的AlCl3溶液滴入装置②浓氢氧化钠溶液,溶液中可观察到有大量白色沉淀产生 12. 铁、铝各1mol组成的混合物溶于一定量的盐酸,恰好完全反应后,再加入3mol Na2O2固体使之充分反应,最终产物是( ) A.Fe(OH)3、NaAlO2、NaCl B.Fe(OH)3、Al(OH)3、NaAlO2、NaCl C.Fe(OH)2、Al(OH)3、NaCl D.Fe(OH)2、Al(OH)3、NaAlO2、NaCl 13.把X溶液逐滴滴入Y溶液中,与把Y溶液逐滴滴入X溶液中,反应现象不同的是( ) A B C D X NaHCO3 NaAlO2 NaHCO3 MgCl2 Y Ca(OH)2 HCl HCl NaOH 14. 下列说法不正确的是( ) A.分别在甲乙两支侧管中装入1.06 g Na2CO3和0.84 g NaHCO3, 试管中各有10 mL相同浓度的盐酸(如图) 同时将两个侧管中的物质 全部倒入各自的试管中,乙装置的气球膨胀速率大 B.用如图装置可以制备沉淀Fe(OH)2 C.取少量Fe(NO3)2试样加水溶解,加稀H2SO4酸化,滴加KSCN溶液,溶液变为红色。结论: 该Fe(NO3)2试样已经变质 D.Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液充分反应,过滤,向滤液中通入过量CO2后过滤 15.向NaOH和Na2CO3混合溶液中滴加0.1 mol·L-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( ) A.在0~a范围内,只发生中和反应 B.ab斜段发生反应的离子方程式为CO+2H+H2O+CO2↑ C.a=0.3 D.原混合溶液中NaOH与Na2CO3的物质的量之比为1∶2 16.已知含有硝酸铜、硝酸锌、硝酸铁、硝酸银各0.1mol的混合溶液中加入0.1mol铁粉,充分搅拌后,铁溶解,溶液中不存在Fe3+,同时析出0.1mol银。下列结论正确的是( ) A. 氧化性:Ag+ >Cu2+>Fe3+> Zn2+ B. 0.1mol Fe可还原0.2mol阳离子 C. 加入0.1molFe时发生了反应Fe+Cu2+=Fe2++Cu D. 溶液中Cu2+与Fe2+物质的量比为2:1 17.下表中的各组物质之间通过一步反应就能实现如图所示转化的是( ) 编号 a b c d ① Na NaOH ② Al ③ Fe ④ MgO Mg A.①②④ B.①③④ C.①②③ D.②③④ 18.有一混合物的水溶液可能含有以下离子中的若干种:Na+、NH4+、Cl﹣、Ba2+、HCO3﹣、SO42﹣,现取两份100mL的该溶液进行如下实验: (1)第一份加足量NaOH溶液,加热,收集到标准状况下的气体448mL; (2)第二份加足量Ba(OH)2溶液,得沉淀4.30g,再用足量盐酸洗涤、干燥后,沉淀质量为2.33g. 根据上述实验,下列推测正确的是( ) A.Ba2+一定存在 B.100mL该溶液中含0.01mol HCO3﹣ C.Na+不一定存在 D.Cl﹣不确定,可向原溶液中加入AgNO3溶液进行检验 19.铁、铜混合粉末18.0 g加入到100 mL 5.0 mol·L-1 FeCl3 溶液中,剩余固体质量为3.2 g。下列说法正确的是( ) A.剩余固体是铁、铜混合物 B.反应后溶液中n(Fe3+)=0.10 mol C.原固体混合物中铜的质量是9.6 g D.反应后溶液中n(Fe2+)+n(Cu2+)=0.5 mol 20.溶液中可能含有H+、NH、Mg2+、Al3+、Fe3+、CO、SO、NO中的几种。①加入铝片,产生无色无味的气体;②加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是( ) A.溶液中一定不含CO,可能含有SO和NO B.在滴加NaOH溶液物质的量为0.5~0.7 mol时,发生离子反应为Al3++4OH-===AlO+2H2O C.溶液中的阳离子只有H+、Mg2+、Al3+ D.n(H+)∶n(NH)∶n(Mg2+)=2∶4∶1 第Ⅱ卷 非选择题部分 21.(8分) A、B、C为中学常见单质,其中一种为金属;通常情况下A为固体、B为黄绿色气体、C为无色气体。D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种无氧强酸溶液,E为黑色固体,H在常温下为液体。它们之间的转化如图所示(某些反应条件和部分反应产物已略去)。 (1)写出下列物质的化学式:D X 。 (2)在反应①~⑦中,不属于氧化还原反应的是 (填数字编号)。 (3)反应⑥的离子方程式为: 。 (4)反应⑦的化学方程式为 ;该反应中每消耗0.3mol的A,可转移电子 mol。 (5)除去D溶液中混有的少量G的方法是: 。 (6)检验G溶液中阳离子的方法是: 。 22.(6分)现有三种可溶性物质A、B、C,其中有一种是碱,两种是盐,溶于水后电离产生的离子如下表所示: 阳离子 Na+ H+ Ba2+ 阴离子 OH- CO32- SO42- 为鉴别它们,分别完成一些实验。请根据实验的结果回答下列问题: (1)A溶液与B溶液反应可生成气体X。根据上述六种离子之间的可能反应判断X的化学式为_______,A溶液与B溶液反应的离子方程式为____________________________________。 (2)气体X可以和C溶液反应生成沉淀D,沉淀D可与B溶液反应。则C的化学式为_____________,B溶于水后的电离方程式为__________________________________ (3)B溶液与C溶液反应生成不溶于稀硝酸的白色沉淀E。B溶液与C溶液反应至中性的离子方程式为_______________________________________________________ 。 (4)D与E的混合物ag,加入足量盐酸,完全反应生成的气体在标准状况下体积为bL,则求算E在混合物中的质量分数的表达式为________________________________________。 23.(11分) (1)最近材料科学家发现了首例带结晶水的晶体在5 K下呈现超导性。该晶体的化学式为Na0.35 CoO2·1.3H2O(该晶体的摩尔质量为122 g·mol-1),若用NA表示阿伏加德罗常数,则12.2 g该晶体中含氧原子数为__________,氢原子的物质的量为__________ mol。 (2)FeCl3溶液可以用来净水,用100 mL 2 mol·L-1的FeCl3溶液净水时,生成具有净水作用的微粒数________(填“大于”“等于”或“小于”)0.2NA。 (3)在标准状况下,VL某气体(摩尔质量为Mg/mol)溶解在1L水(水的密度近似为1g/cm3)中,假设气体完全溶解且不与水发生反应,所得溶液的密度为ρg/cm3,则所得溶液的物质的量浓度c=____________mol/L(用以上字母表示,且必须化简)。 (4)工业上用亚氯酸钠和稀盐酸为原料制备ClO2反应: NaClO2+HCl→ClO2↑+NaCl+H2O。写出配平的化学方程式__________________。 (5)向100 mL的FeBr2溶液中通入标准状况下Cl2 3.36 L(已知还原性:Fe2+>Br-),反应后的溶液中Cl-和Br-的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为________ mol/L。反应的离子方程式为_________。 (6)若向盛有10 mL 1 mol·L-1NH4Al(SO4)2溶液的烧杯中加20 mL 1.2 mol·L-1 Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为________ mol。 24.(10分)氢化锂(LiH)在干燥的空气中能稳定存在,遇水或酸能够引起燃烧。某活动小组准备使用下列装置制备LiH固体。 甲同学的实验方案如下: (1)仪器的组装连接:上述仪器装置接口的连接顺序为____________________,加入药品前首先要进行的实验操作是______________________(不必写出具体的操作方法);其中装置B的作用是____________________。 (2)添加药品:用镊子从试剂瓶中取出一定量金属锂(固体石蜡密封),然后在甲苯(一种有机化合物)中浸洗数次,该操作的目的是除去锂表面的石蜡,然后快速把锂放入到石英管中。通入一段时间氢气后加热石英管,在加热D处的石英管之前,必须进行的实验操作是___________________。 (3)加热一段时间后停止加热,继续通氢气冷却,然后取出LiH,装入氮封的瓶里,保存于暗处。采取上述操作的目的是为了避免LiH与空气中的水蒸气接触而发生危险。分析该反应原理,完成LiH与水反应的化学方程式_________________________。 (4)准确称量制得的产品0.174 g,在一定条件下与足量水反应后,共收集到气体470.4 mL(已换算成标准状况),则产品中LiH与Li的物质的量之比为_________________________。 25.(10分)把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐渐加入2.00mol/LHCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。 (注明:C点为沉淀恰好完全溶解) (1)A点沉淀物的化学式为_______________________。B点纵坐标为_______________________。 (2)A点至B点改为通入二氧化碳气体,至少须标准状况下二氧化碳_______________________mL。 此时发生反应的离子方程式为 。 (3)B点溶液中含溶质的物质的量是______________________ mol。C点(此时沉淀恰好完全溶解) 消耗HCl溶液的体积为___________________________mL。 铁人中学2019级高一学年上学期期末考试化学答案 一、选择题(每小题只有一个选项正确,前5个小题,每小题2分,后15个小题,每小题3分,20个小题共55分。) 1 2 3 4 5 6 7 8 9 10 C D B A C D D A D C 11 12 13 14 15 16 17 18 19 20 C A B C C B D B C D 二、非选择题(共45分) 21(8分) (1)FeCl3 (1分) HCl(1分) (2)③⑥(1分)(全对给1分,只对1个不给分) (3)Fe3++3SCN-=Fe(SCN)3(1分) (4)3Fe+4H2O(g)Fe3O4+4H2 (1分) (写加热符号或者高温均可以,若没有写g和反应条件的不给分) 0.8(1分) (5)向混合液中通入足量氯气(或氯水)(或加入足量H2O2)(1分) (6)取少量G溶液于试管中,滴2滴KSCN溶液,溶液不变色,再加新制氯水,溶液变为红色。 (1分) 22.(6分) (1)CO2 (1 分) 2H+ + CO32— = H2O +CO2 ↑(1 分) (2)Ba(OH)2 (1 分),NaHSO4 = Na++H++SO42- (1分) (3)2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓(1 分) (4) (1 分) 23.(11分) (1)0.33NA (1分)0.26 (1分) (2)小于(1分)(3). (1分) (4)5NaClO2+4HCl= 4ClO2↑+5NaCl+2H2O (1分) (5). 2 (2分) 离子方程式4Fe2++2Br-+3Cl2===4Fe3++Br2+3Cl-(2分) (6)0.022 (2分) 24. (10分) (1) e接a,b接f,g(或者f , g)接d(2分) 检验装置的气密性(1分) 除去H2中的H2O和HCl(1分) (2)收集c处排出的气体并检验H2纯度(2分) (3) 反应方程式:LiH+H2O===LiOH+H2↑(2分) (4)10∶1(2分) 25.(10分) (1). Mg(OH)2(1分) 4.28 (1分) (2). 448 (2分)2AlO+CO2+3H2O===2Al(OH)3↓+CO2(2分) (3) 0.22 (2分) 110(2分)查看更多