- 2021-07-08 发布 |
- 37.5 KB |
- 9页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
福建师范大学附属中学2021届高三化学上学期期中试题(Word版附答案)
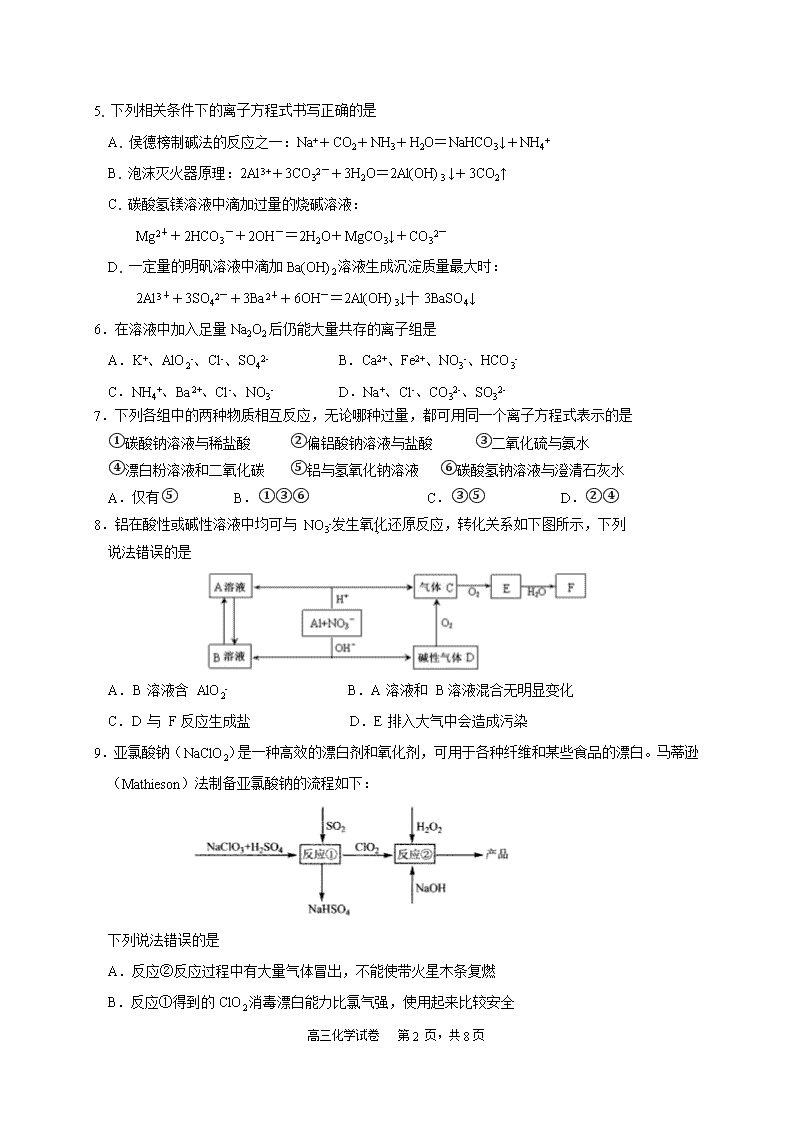
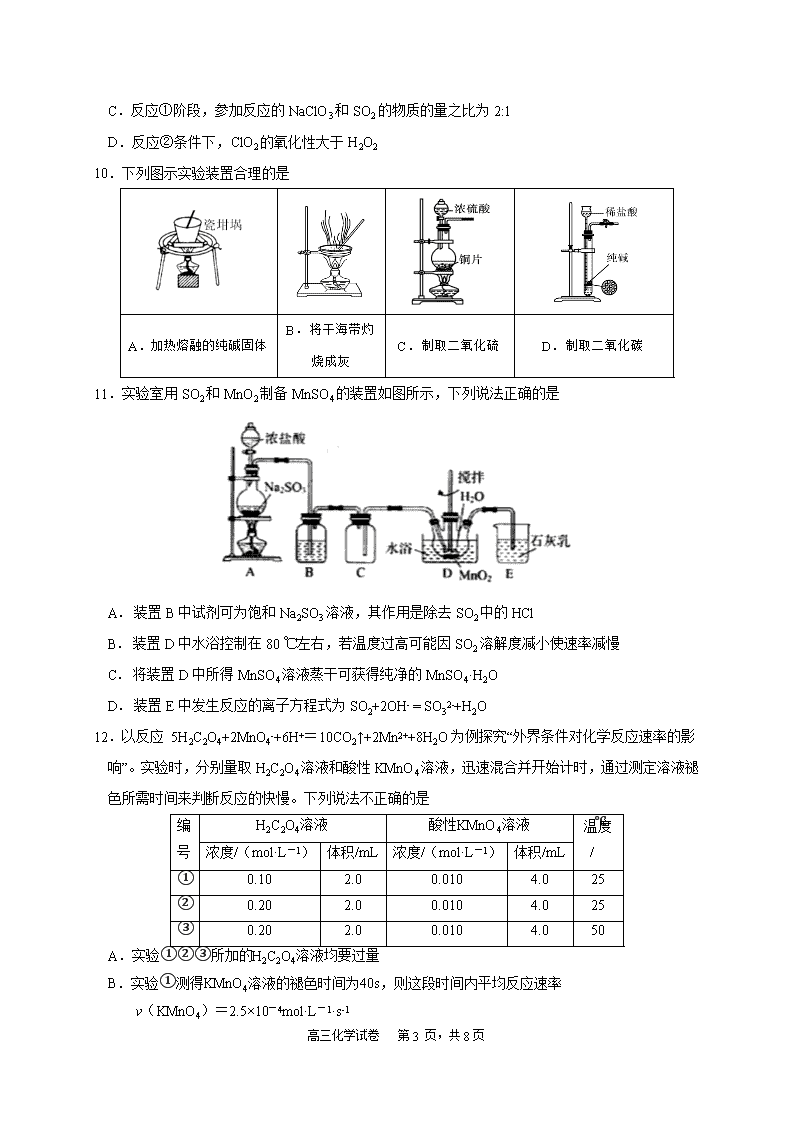
高三化学试卷 第 1 页,共 8 页 福建师大附中 2020-2021 学年上学期期中考试 高三 化学试卷 时间:70 分钟 满分:100 分 试卷说明: (1)本卷共两大题,19 小题,答案写在答卷的指定位置上,考试结束后,只交答卷。 (2)可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 Mn-55 Al-27 Ba-137 Cu-64 第Ⅰ卷(选择题,共 48 分) 一、选择题:每小题 3 分,共 48 分,每小题给出的四个选项中只有一个选项符合要求。 1. 陶瓷、青铜器、书画作品等都是中华文化的瑰宝,其中蕴藏丰富的化学知识。下列说法中错误的 是 A.商代后期铸造出工艺精湛的青铜器司母戊鼎,其材质属于合金 B.宋•王希孟《千里江山图》卷中的绿色颜料铜绿的主要成分是碱式碳酸铜 C.《茶经》中,唐代邢窑白瓷为上品,其烧制原料主要成分含有 SiO2、A12O3、Fe2O3 D.书画作品用的纸张,其化学成分主要是纤维素 2. 某中德联合研究小组设计制造了一种“水瓶”,用富勒烯(C60)的球形笼子作“瓶体”,一种磷酸盐 作“瓶盖”,恰好可将一个水分子关在里面。下列说法正确的是 A.“水瓶”、冰水混合物、CuSO4•5H2O 都是混合物 B.金刚石、石墨和 C60 互称为同素异形体,其中金刚石更稳定 C.磷酸钙是难溶性弱电解质 D.一定条件下石墨转化为 C60 是化学变化,属于有单质参加的非氧化还原反应 3. 下列物质的工业制法中,错误的是 A.制氨:加热氢氧化钙和氯化铵的混合物 B.制锰:高温下铝和二氧化锰反应 C. 制硅:高温下焦炭还原二氧化硅,副产物为 CO D. 制硫酸:黄铁矿煅烧生成的气体经接触氧化后用浓硫酸吸收 4. NA 代表阿伏加德罗常数的值。下列说法正确的是 A. 将 100 mL 0.1 mol·L-1 FeCl3 溶液滴入沸水中可制得 Fe(OH)3 胶粒 0.01NA B. 1.0 mol·L-1 氨水中的 NH3·H2O、NH4+ 微粒数之和为 NA C. 100g 质量分数为 3%的甲醛水溶液含有的氢原子数为 0.2NA D. 在标准状况下,0.5mol NO 与 0.5mol O2 混合后气体分子数小于 0.75 NA 高三化学试卷 第 2 页,共 8 页 3 2 5. 下列相关条件下的离子方程式书写正确的是 A. 侯德榜制碱法的反应之一:Na++CO2+NH3+H2O=NaHCO3↓+NH4+ B. 泡沫灭火器原理:2Al3++3CO32-+3H2O=2Al(OH)3 ↓+3CO2↑ C. 碳酸氢镁溶液中滴加过量的烧碱溶液: Mg2++2HCO3 -+2OH-=2H2O+MgCO3↓+CO32- D. 一定量的明矾溶液中滴加 Ba(OH)2 溶液生成沉淀质量最大时: 2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓十 3BaSO4↓ 6.在溶液中加入足量 Na2O2 后仍能大量共存的离子组是 A.K+、AlO2-、Cl-、SO42- B.Ca2+、Fe2+、NO3-、HCO3- C.NH4+、Ba2+、Cl-、NO3- D.Na+、Cl-、CO32-、SO32- 7.下列各组中的两种物质相互反应,无论哪种过量,都可用同一个离子方程式表示的是 ①碳酸钠溶液与稀盐酸 ②偏铝酸钠溶液与盐酸 ③二氧化硫与氨水 ④漂白粉溶液和二氧化碳 ⑤铝与氢氧化钠溶液 ⑥碳酸氢钠溶液与澄清石灰水 A.仅有⑤ B.①③⑥ C.③⑤ D.②④ 8.铝在酸性或碱性溶液中均可与 NO3-发生氧化还原反应,转化关系如下图所示,下列 说法错误的是 A.B 溶液含 AlO2- B.A 溶液和 B 溶液混合无明显变化 C.D 与 F 反应生成盐 D.E 排入大气中会造成污染 9.亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。马蒂逊 (Mathieson)法制备亚氯酸钠的流程如下: 下列说法错误的是 A.反应②反应过程中有大量气体冒出,不能使带火星木条复燃 B.反应①得到的 ClO2 消毒漂白能力比氯气强,使用起来比较安全 高三化学试卷 第 3 页,共 8 页 C.反应①阶段,参加反应的 NaClO3 和 SO2 的物质的量之比为 2:1 D.反应②条件下,ClO2 的氧化性大于 H2O2 10.下列图示实验装置合理的是 A.加热熔融的纯碱固体 B.将干海带灼 烧成灰 C.制取二氧化硫 D.制取二氧化碳 11.实验室用 SO2 和 MnO2 制备 MnSO4 的装置如图所示,下列说法正确的是 A.装置 B 中试剂可为饱和 Na2SO3 溶液,其作用是除去 SO2 中的 HCl B.装置 D 中水浴控制在 80 ℃左右,若温度过高可能因 SO2 溶解度减小使速率减慢 C.将装置 D 中所得 MnSO4 溶液蒸干可获得纯净的 MnSO4·H2O D.装置 E 中发生反应的离子方程式为 SO2+2OH- = SO32-+H2O 12.以反应 5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O 为例探究“外界条件对化学反应速率的影 响”。实验时,分别量取 H2C2O4 溶液和酸性 KMnO4 溶液,迅速混合并开始计时,通过测定溶液褪 色所需时间来判断反应的快慢。下列说法不正确的是 编 号 H2C2O4溶液 酸性KMnO4溶液 温度 /℃浓度/(mol·L-1) 体积/mL 浓度/(mol·L-1) 体积/mL ① 0.10 2.0 0.010 4.0 25 ② 0.20 2.0 0.010 4.0 25 ③ 0.20 2.0 0.010 4.0 50 A.实验①②③所加的H2C2O4溶液均要过量 B.实验①测得KMnO4溶液的褪色时间为40s,则这段时间内平均反应速率 v(KMnO4)=2.5×10-4mol·L-1·s-1 高三化学试卷 第 4 页,共 8 页 C.实验①和②是探究浓度对化学反应速率的影响,实验②和③是探究温度对化学反应速率的影响 D.实验①和②起初反应均很慢,过了一会儿速率突然增大,可能是生成的Mn2+对反应起催化作 用 13.在酸性条件下,黄铁矿( FeS2)催化氧化的反应 2FeS2+7O2+2H2O = 2Fe2++4SO42-+4H+,实现该反 应的物质间转化如图所示。下列分析错误的是 A.反应 I 的离子方程式为 4Fe(NO)2++O2+4H+===4Fe3++4NO+2H2O B.反应Ⅱ的氧化剂是 Fe3+ C.反应Ш是非氧化还原反应 D.黄铁矿催化氧化过程中:NO 和 Fe(NO)2+均作催化剂 14.某同学按下图所示实验装置探究铜与浓硫酸的反应,记录实验现象见下表。下列说法正确的是 A.②中白色沉淀是 BaSO3 B.①中可能有部分硫酸挥发了 C.为确定①中白色固体是否为硫酸铜,可向冷却后的试管中注入水,振荡 D.实验时若先往装置内通入足量 N2 ,再加热试管①,实验现象不变 15.煤燃烧排放的烟气含有 SO2 和 NOx,是大气的重要污染源之一。用 Ca(ClO)2 溶液对烟气 [n(SO2)∶n(NO) =3∶2]同时脱硫脱硝(分别生成 SO42-、NO3-),得到 NO、SO2 脱除率如下图,下 列说法错误的是 高三化学试卷 第 5 页,共 8 页 A.碱性环境下脱除 NO 的反应:2NO+3ClO-+2OH-= 2NO3- +3Cl-+H2O B.SO2 脱除率高于 NO 的原因可能是 SO2 在水中的溶解度大于 NO C.依据图中信息,在 80 min 时,吸收液中 n(NO3-)∶n(Cl-)=2∶3 D.随着脱除反应的进行,吸收剂溶液的 pH 逐渐减小 16.将 13.6g Cu 和 Cu2O 组成的混合物加入 250 mL 一定浓度的稀硝酸中,固体完全溶解生成 Cu(NO3)2 和 NO。向所得溶液中加入 1.0 L 0.5 mol • L-1 的 NaOH 溶液,生成沉淀的质量为 19.6 g,此时溶液 呈中性,且金属离子沉淀完全。下列说法正确的是 A.原固体混合物中,Cu 和 Cu2O 的物质的量之比为 1:1 B.原稀硝酸的浓度为 1.3 mol·L-1 C.固体溶解后剩余硝酸的物质的量为 0.1 mol D.产生的 NO 的体积为 2.24L 第Ⅱ卷(非选择题,共 52 分) 二、非选择题:3 小题,共 52 分。 17.(18 分)硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O] 比 FeSO4 稳定,不易被氧气氧化,常用于代替 FeSO4 作分析试剂。某小组在实验室制备(NH4)2Fe(SO4)2·6H2O 并探究其分解产物。 Ⅰ.按以下流程制备硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O] (1)铁屑溶于稀硫酸过程中,适当加热的目的是 。 (2)流程中,需将滤液转移到 (填写仪器名称)中,迅速加入饱和硫酸铵溶液,直 接加热蒸发混合溶液,观察到 ,停止加热。 II. 查阅资料可知硫酸亚铁铵晶体加热主要发生反应: (NH4)2Fe(SO4)2 — Fe2O3+ SO2↑+ NH3↑+ N2↑+ H2O 但伴有副反应发生,生成少量 SO3 和 O2。设计以下实验探究分解的产物: 高三化学试卷 第 6 页,共 8 页 (3)配平,完整写出上述分解反应的化学方程式。 (4)加热过程,A 中固体逐渐变为 色。待晶体完全分解后,为验证 A 中残留物是否 含有 FeO,需选用的试剂有 (填字母)。 A.KSCN 溶液 B.稀硫酸 C.浓盐酸 D.酸性 KMnO4 溶液 (5)B 中有白色沉淀生成,写出生成该白色沉淀的离子方程式: 。 (6)C 的作用是 。 (7)D 中集气瓶能收集到氧气, (填“能”或“不能”)用带火星木条检验。 (8)上述反应结束后,继续证明分解产物中含有 NH3 的方法是 。 18.(16 分)SO2 虽是大气污染物之一,但也是重要的工业原料。某研究小组利用软锰矿(主要成分 为 MnO2,另含有少量铁、铝、铜、镍等金属化合物)作燃煤尾气脱硫剂,通过如下简化流程既脱除 燃煤尾气中的 SO2,又制得电池材料 MnO2(反应条件已省略),达到变废为宝的目的。 请回答下列问题: (1)下列各组试剂中,能准确测定一定体积燃煤尾气中 SO2 含量的是 (填编号)。 A.NaOH 溶液、酚酞试液 B.稀 H2SO4 酸化的 KMnO4 溶液 C.KI 溶液、淀粉溶液 D.氨水、酚酞试液 (2)软锰矿是重要的锰矿石,在做脱硫剂时往往做成浆状的主要原因是 ,写出 软锰矿浆吸收 SO2 的离子方程式 。 (3)用 MnCO3 能除去溶液中的 Al3+和 Fe3+,其原理是 。 (4)上述流程中多次涉及到过滤操作,实验室进行过滤操作时需要用到的硅酸盐仪器有玻璃棒、 烧杯、 ;其中玻璃棒的作用是 。 (5)写出 KMnO4 与 MnSO4 溶液反应的离子方程式 。已知废气中 SO2 浓度为 6.4g/m3,软锰矿浆对 SO2 的吸收率可达 90%,若将 MnSO4 溶液蒸发浓缩、冷却结晶可获得 高三化学试卷 第 7 页,共 8 页 硫酸锰晶体(MnSO4·H2O),则处理 1000m3 燃煤尾气,可得到硫酸锰晶体(相对分子质量为 169) 质量为 kg(结果保留 3 位有效数字)。 19.(18 分)研究非金属元素及其化合物的性质具有重要意义。 Ⅰ.含硫物质燃烧会产生大量烟气,主要成分是 SO2、CO2、N2、O2 。某研究性学习小组在实 验室利用装置(图 19-1)测定烟气中 SO2 的体积分数。 (1)将部分烟气缓慢通过 C、D 装置,其中 C、D 中盛有的药品分别是_______、________。(填 序号)①KMnO4 溶液 ②饱和 NaHSO3 溶液 ③饱和 Na2CO3 溶液 ④饱和 NaHCO3 溶液 (2)若烟气的流速为 a mL·min-1,若 t1 min 后,测得量筒内液体体积为 VmL,则 SO2 的体积分 数 。 图 19-1 图 19-2 II.某化学兴趣小组为探究 Cl2、Br2、Fe3+的氧化性强弱,设计如下实验(装置图 19-2): (3)检查装置 A 的气密性: ,向分液漏斗中注水,若水不能顺利滴下,则 气密性良好。 (4)装置 A 中发生的反应的离子方程式为 。 (5)整套实验装置存在一处明显的不足,请指出:___________________________。 (6)用改正后的装置进行实验,实验过程如下: 实验操作 实验现象 结论 打开旋塞 a,向圆底烧瓶中滴入适 量浓盐酸;然后关闭旋塞 a,点燃 酒精灯 D 装置中:溶液变红 E 装置中:水层溶液变黄,振荡 后,CCl4 层无明显变化 Cl2、Br2、Fe3+的氧化性由强到 弱的顺序为________ (7)因忙于观察和记录,没有及时停止反应,D、E 中均发生了新的变化。 D 装置中:红色慢慢褪去。 E 装置中:CCl4 层先由无色变为橙色,后颜色逐渐加深,直至变成红色。 为探究上述实验现象的本质,小组同学查得资料如下: Ⅰ.(SCN)2 性质与卤素单质类似。氧化性:Cl2 > (SCN)2。 Ⅱ.Cl2 和 Br2 反应生成 BrCl,它呈红色(略带黄色),沸点约 5 ℃,与水发生水解反应。 Ⅲ.AgClO、AgBrO 均可溶于水。 ①结合化学用语解释 Cl2 过量时 D 中溶液红色褪去的原因: 高三化学试卷 第 8 页,共 8 页 ;设计简单实验证明上述解释:取少量褪色后的溶液,滴加 _____________,若______________,则上述解释合理。 ②欲探究 E 中颜色变化的原因,设计实验如下:用分液漏斗分离出 E 的下层溶液,蒸馏、收集 红色物质,取少量红色物质加入 AgNO3 溶液,结果观察到仅有白色沉淀产生。请结合化学用语解释 仅产生白色沉淀的原因: 。 高三化学试卷 第 9 页,共 8 页 福建师大附中 2020-2021 学年上学期期中考试 高三化学 参考答案 1-16 CDADA AABAC BBDBC C 17.(18 分)(1)加快铁与稀硫酸的反应速率,使铁屑充分溶解(2 分) (2)蒸发皿(1 分);表面有晶膜生成(2 分) (3)2(NH4)2Fe(SO4)2 Fe2O3+4SO2↑+2NH3↑+N2↑+5H2O(2 分) (4)红棕(1 分);BD(2 分) (5)Ba2++SO3+H2O=BaSO4↓+2H+(或 2Ba2++2SO2+O2+2H2O=2BaSO4↓+4H+)(2 分) (6) 检验产物中是否含有 SO2(2 分) (7)不能(2 分) (8)取 B 中少量溶液于试管中,滴加少量 NaOH 溶液并加热,能产生使湿润红色石蕊试纸变蓝的 气体。说明分解产物中含有 NH3(2 分) 18.(16 分)(1)B (2 分) (2)增大与气体的接触面积,使气体吸收更加充分(2 分) ;MnO2+SO2=Mn2++SO42- (2 分) (3)消耗溶液中的酸,促进 Al3+和 Fe3+水解生成氢氧化物沉淀(2 分) (4)漏斗(2 分);引流,防止液体溅出(2 分) (5)2MnO4-+3Mn2++2H2O == 5MnO2↓+4H+(2 分);15.2 (2 分) 19.(18 分) (1) ① ④(2 分) (2) (2 分) (3)关闭止水夹 b,打开旋塞 a(2 分) (4)MnO2+4H++2Cl-==Mn2++2H2O+Cl2↑(2 分) (5)缺少尾气处理装置(2 分) (6)Cl2> Br2>Fe3+ (2 分) (7)①过量氯气氧化 SCN-,使 SCN-浓度减小,则 Fe3+ +3SCN-⇌Fe(SCN)3 平衡逆向移动而褪色。 (2 分);滴加 KSCN 溶液,若溶液变红色(或滴加 FeCl3 溶液,若溶液不变红)(2 分) ②BrCl 发生水解 BrCl+H2O=HBrO+HCl,生成的 Cl-与 Ag+结合生成 AgCl 白色沉淀(2 分)查看更多