- 2021-07-07 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届一轮复习人教版有机制备中的蒸馏与冷凝装置的变迁学案
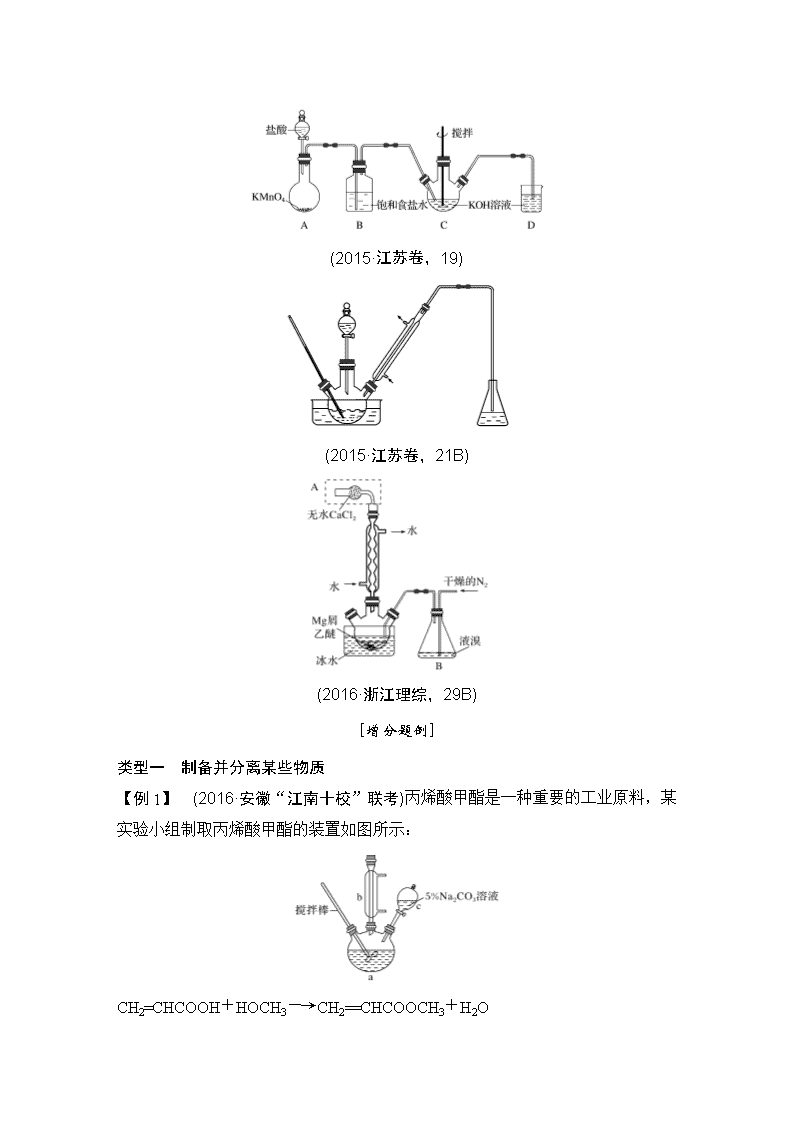
有关蒸馏装置和冷凝装置的实验综合题在新课标全国卷中前几年可谓年年必考,此类实验题往往以有机物的制备为载体,综合考查化学实验基本操作,如实验仪器的名称、试剂的添加、基本仪器的使用、基本仪器或装置的选择、产率的计算、误差分析等,此类题目自2012年在新课标全国卷中首次出现以来,2013、2014年的新课标全国卷Ⅰ、Ⅱ卷中都有类似题目,特别是在新课标全国卷Ⅰ卷中,都以非选择题第一题,即第26题出现,难度不大,基本起到了稳定考生心理的积极作用。虽然2016、2017年没有出现,但仍不失为一个很好的出题点,考察学生化学实验和探究的能力。 增分点1 有机制备中的蒸馏装置 [知识查补] 1.蒸馏的适用范围:两种或两种以上互溶的混合液体的分离,各组分的沸点相差较大。 2.蒸馏注意事项 (1)蒸馏装置中温度计的水银球要放置在蒸馏烧瓶支管口处。 (2)为防暴沸,可在蒸馏烧瓶中放几小块沸石或碎瓷片。 (3)冷凝管中水流方向应为“下进上出”。 3.高考题中出现过的蒸馏、冷凝装置或仪器 (2015·江苏卷,19) (2015·江苏卷,21B) (2016·浙江理综,29B) [增分题例] 类型一 制备并分离某些物质 【例1】 (2016·安徽“江南十校”联考)丙烯酸甲酯是一种重要的工业原料,某实验小组制取丙烯酸甲酯的装置如图所示: CH2=CHCOOH+HOCH3―→CH2==CHCOOCH3+H2O ①取10.0 g丙烯酸和6.0 g甲醇放置于三颈烧瓶中,连接好冷凝管,用搅拌棒搅拌,水浴加热。 ②充分反应后,冷却,向混合液中加入5% Na2CO3溶液洗至中性。 ③分液,取上层油状液体,再用无水Na2SO4干燥后蒸馏,收集70~90 ℃馏分。 可能用到的信息: 沸点 溶解性 毒性 丙烯酸 141 ℃ 与水互溶,易溶于有机溶剂 有毒 甲醇 65 ℃ 与水互溶,易溶于有机溶剂 易挥发,有毒 丙烯酸甲酯 80.5 ℃ 难溶于水,易溶于有机溶剂 易挥发 回答下列问题: (1)仪器c的名称是______________________________________________。 (2)混合液用5% Na2CO3溶液洗涤的目的是_________________________。 (3)请写出配制100 g 5% Na2CO3溶液所使用的玻璃仪器_______________。 (4)关于产品的蒸馏操作(夹持装置未画出),下图中有2处错误,请分别写出________________________________________________________________、 ______________________________________________________________。 为检验产率,设计如下实验: ①将油状物质提纯后平均分成5份,取出1份置于锥形瓶中,加入2.5 mol/L的KOH溶液10.00 mL,加热使之完全水解。 ②用酚酞做指示剂,向冷却后的溶液中滴加0.5 mol/L的HCl溶液,中和过量的KOH,滴到终点时共消耗盐酸20.00 mL。 (5)计算本次酯化反应丙烯酸的转化率________。 (6)请列举2条本实验中需要采取的安全防护措施_______________________ _____________________________________________________________。 解析 (2)用5% Na2CO3溶液洗涤混合液是为了除去混合液中的丙烯酸和甲醇,以便蒸馏时得到较纯的丙烯酸甲酯。(3)配制100 g 5% Na2CO3溶液时,将称量的5.0 g Na2CO3固体加入烧杯中,用量筒量取95 mL的水倒入烧杯中,用玻璃棒搅拌溶解得到所配溶液,因此所需玻璃仪器有烧杯、量筒、玻璃棒。(4)蒸馏时,温度计是用来测被冷凝蒸气温度的,故温度计水银球位置错了;尾接管与锥形瓶接口应与大气相通。(5)丙烯酸甲酯水解消耗的KOH的物质的量为2.5 mol/L×10.00 mL×10-3L/mL-0.5 mol/L×20.00 mL×10-3L/mL=0.015 mol。酯化反应转化的丙烯酸的物质的量=生成的丙烯酸甲酯物质的量=丙烯酸甲酯水解消耗的KOH的物质的量,酯化反应丙烯酸的转化率为×100%=54.0%。(6)丙烯酸和甲醇都有毒且易挥发,该实验应该在通风橱中进行;甲醇易挥发且易燃,实验时应该防止明火。 答案 (1)分液漏斗 (2)除去混合液中的丙烯酸和甲醇(降低丙烯酸甲酯的溶解度) (3)烧杯、玻璃棒、量筒 (4)温度计水银球位置 尾接管与锥形瓶接口密封 (5)54.0% (6)在通风橱中实验、防止明火(或其他合理答案) 增分点2 有机实验中的冷凝装置 [知识查补] 球形冷凝管(物质回流):主要应用于有机化合物的合成装置中的回流,一般用于反应装置,即在反应时考虑到反应物的蒸发流失而用球形冷凝管冷凝回流,使反应更彻底。球形有利于增加冷却接触面,故冷凝面积较直形冷凝管大,冷凝效率稍高。 直形冷凝管(物质流出):主要应用于混合液体或液-固体系中沸点不同各组分物质的蒸馏实验中的冷凝,蒸馏是要某物质蒸气冷凝成液体后流出,直形是为了方便液体的流出。 [增分题例] 类型二 直形冷凝管的用途及球形冷凝管的冷凝回流 【例2】 (2018·沈阳监测)四氯化钛是生产金属钛及其化合物的重要中间体。某校化学课外活动小组准备利用下图装置制备四氯化钛(部分夹持仪器已略去)。 资料表明:室温下,四氯化钛为无色液体,熔点:-25 ℃,沸点:136.4 ℃。在空气中发烟生成二氧化钛固体。在650~850 ℃下,将氯气通过二氧化钛和炭粉的混合物可得到四氯化钛和一种有毒气体。回答下列问题: (1)检查该装置气密性的方法是_____________________________________ _______________________________________________________________。 (2)A处分液漏斗上方的胶皮管的作用是_________________________________ _________________________________________________________________。 (3)实验中B装置中选用的试剂为________,该装置的作用是________________________________________________________________。 (4)写出D中物质制备的化学方程式________________________________ _______________________________________________________________; 写出四氯化钛在空气中发烟的化学方程式____________________________ _________________________________________________________________。 (5)E处球形冷凝管的作用是_____________________________________, 该装置冷却水应从________(填“c”或“d”)口通入。 (6)仪器F中盛装的物质是________。 (7)该实验设计略有缺陷,请指出其不足之处__________________________ ________________________________________________________________。 解析 (1)检查装置气密性时可以在B中加入蒸馏水至浸没玻璃导管a的下端,关闭活塞b,微热A装置中的烧瓶,若导管a中的液面上升一定的高度,则气密性良好。(2)A处分液漏斗上方的胶皮管的作用是平衡气压,有利于液体顺利滴下。(3)装置B中选用的试剂为饱和食盐水,其作用是洗去Cl2中的HCl气体,并用作安全瓶。(4)在D中制备TiCl4,反应的化学方程式为TiO2+2Cl2+2CTiCl4+2CO。四氯化钛在空气中发烟生成二氧化钛,化学方程式为TiCl4+2H2O===TiO2+4HCl↑。(5)冷凝管的作用是冷凝回流,冷却水从c口通入。(6)F的作用是避免空气中的水蒸气进入反应装置,所盛装的物质是碱石灰。(7)该实验设计的不足之处为没有对CO进行尾气处理。 答案 (1)在B中加入蒸馏水至浸没玻璃导管a的下端,关闭活塞b,微热A装置中的烧瓶,若导管a中的液面上升一定的高度,则气密性良好(或在B中加入蒸馏水至浸没玻璃导管a的下端,F处连接导气管并将尾端放到水槽中,微热A装置中的烧瓶,水槽中导气管的尾端有气泡冒出,停止加热,倒吸一段水柱,则气密性良好) (2)平衡气压,有利于液体顺利滴下 (3)饱和食盐水 洗去Cl2中的HCl气体,并用作安全瓶(或用作平衡气压的安全装置,或用作防堵塞的安全装置) (4)TiO2+2Cl2+2CTiCl4+2CO TiCl4+2H2O===TiO2+4HCl↑ (5)冷凝回流 c (6)碱石灰 (7)没有对CO进行尾气处理 【例3】 (2017·江苏化学,21B)1-溴丙烷是一种重要的有机合成中间体,沸点为71 ℃,密度为1.36 g·cm-3。实验室制备少量1-溴丙烷的主要步骤如下: 步骤1:在仪器A中加入搅拌磁子、12 g正丙醇及20 mL水,冰水冷却下缓慢加入28 mL浓H2SO4;冷却至室温,搅拌下加入24 g NaBr。 步骤2:如图所示搭建实验装置,缓慢加热,直到无油状物馏出为止。 步骤3:将馏出液转入分液漏斗,分出有机相。 步骤4:将分出的有机相转入分液漏斗,依次用12 mL H2O、12 mL 5% Na2CO3溶液和12 mL H2O洗涤,分液,得粗产品,进一步提纯得1-溴丙烷。 (1)仪器A的名称是________;加入搅拌磁子的目的是搅拌和________。 (2)反应时生成的主要有机副产物有2-溴丙烷和________。 (3)步骤2中需向接受瓶内加入少量冰水并置于冰水浴中的目的是_________________________________________________________________。 (4)步骤2中需缓慢加热使反应和蒸馏平稳进行,目的是 _______________________________________________________________。 (5)步骤4中用5% Na2CO3溶液洗涤有机相的操作:向分液漏斗中小心加入12 mL 5% Na2CO3溶液,振荡,____________________________________________ _________________________________________________,静置,分液。 解析 (2)浓H2SO4存在条件下,正丙醇可能发生消去反应生成丙烯,也可能分子间脱水生成正丙醚。(3)冰水降低温度,减少1-溴丙烷的挥发。(4)因正丙醇与HBr反应生成1-溴丙烷,HBr易挥发,缓慢加热,以减少HBr的挥发。 答案 (1)蒸馏烧瓶 防止暴沸 (2)丙烯、正丙醚 (3)减少1-溴丙烷的挥发 (4)减少HBr挥发 (5)将分液漏斗下口向上倾斜、打开活塞排出气体查看更多