安徽省滁州市明光中学2019-2020学年高二下学期开学考试化学试题
化学试卷
时间:100分钟 满分:100分
可能用到的相对原子质量: H-1 C-12 O-16 Cu-64
一、选择题(每小题只有一个正确选项,每题3分,共14题,42分)
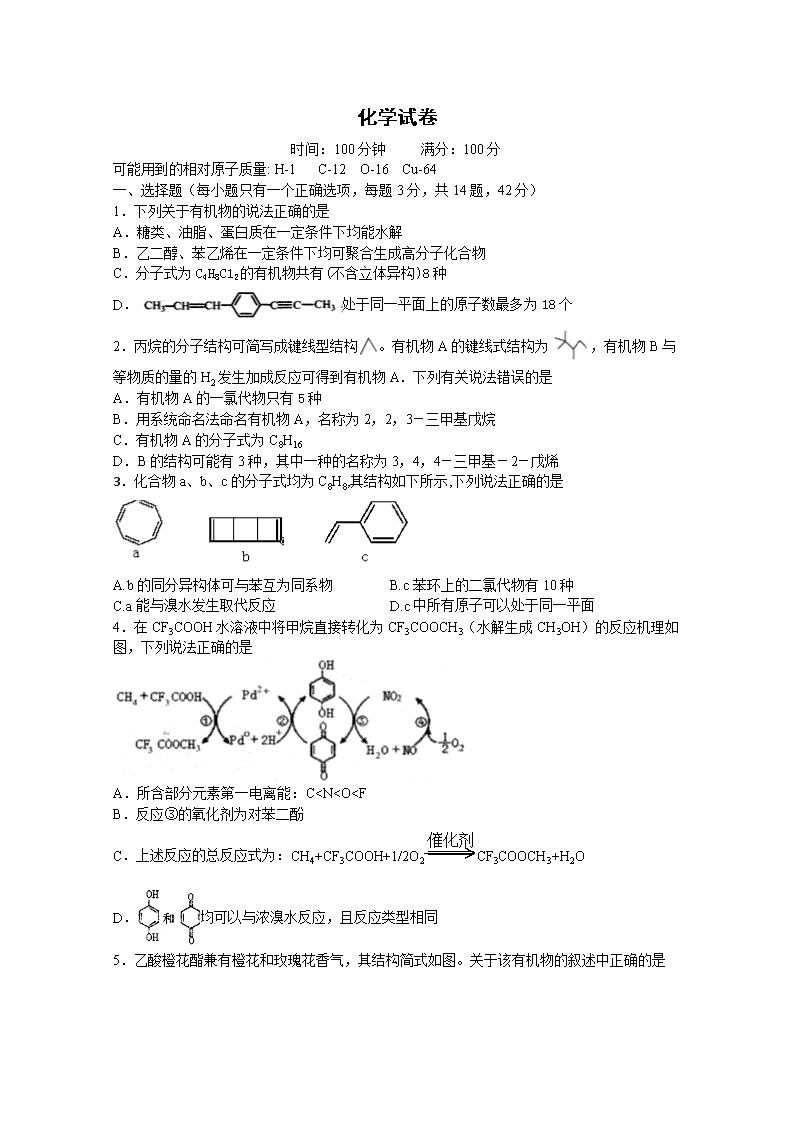
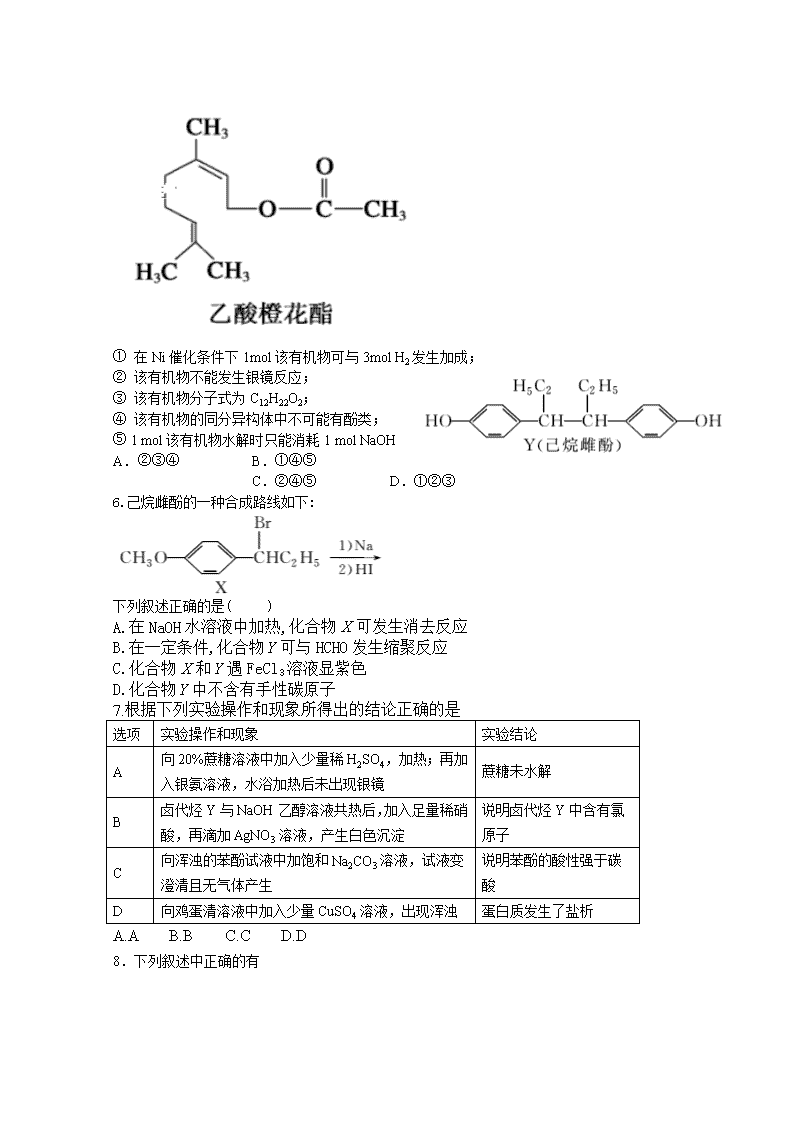
1.下列关于有机物的说法正确的是
A.糖类、油脂、蛋白质在一定条件下均能水解
B.乙二醇、苯乙烯在一定条件下均可聚合生成高分子化合物
C.分子式为C4H8C12的有机物共有(不含立体异构)8种
D.处于同一平面上的原子数最多为18个
2.丙烷的分子结构可简写成键线型结构。有机物A的键线式结构为,有机物B与等物质的量的H2发生加成反应可得到有机物A.下列有关说法错误的是
A.有机物A的一氯代物只有5种
B.用系统命名法命名有机物A,名称为2,2,3-三甲基戊烷
C.有机物A的分子式为C8H16
D.B的结构可能有3种,其中一种的名称为3,4,4-三甲基-2-戊烯
3.化合物a、b、c的分子式均为C8H8,其结构如下所示,下列说法正确的是
A.b的同分异构体可与苯互为同系物 B.c苯环上的二氯代物有10种
C.a能与溴水发生取代反应 D.c中所有原子可以处于同一平面
4.在CF3COOH水溶液中将甲烷直接转化为CF3COOCH3(水解生成CH3OH)的反应机理如图,下列说法正确的是
A.所含部分元素第一电离能:C
HClO,因为H3PO4中非羟基氧原子数大于次氯酸中非羟基氧原子数
12.第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形。RCl5在气态和液态时,分子结构如下图所示,下列关于RCl5分子的说法中正确的是
A.每个原子都达到8电子稳定结构
B.分子中5个R—Cl键键能都相同
C.键角(Cl—R—Cl)有90°、120°、180°几种
D.RCl5受热后会分解生成分子RCl3,RCl5和RCl3都是极性分子
13.硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示。下列说法正确的是( )
A.m=2
B.在Xm-中,硼原子轨道的杂化类型相同
C.1、2原子间和4、5原子间的化学键可能是配位键
D.Xm-中含离子键和配位键
14.甲烷晶体的晶胞结构如图所示,下列说法正确的是( )
A.甲烷晶胞中的球只代表1个C原子
B.晶体中1个CH4分子周围有12个紧邻的CH4分子
C.甲烷晶体熔化时需克服共价键
D.1个CH4晶胞中含有8个CH4分子
二、非选择题(共58分)
15.(14分)A、B、C、D、E、F为前四周期元素,原子序数依次增大,A、D同主族,A2—和B+具有相同的电子层结构;C、E为同周期元素,C核外电子总数是最外层电子数的3倍;
E元素最外层有一个未成对电子;F的最外层只有1个电子,但次外层有18个电子。
请回答下列问题:
(1)基态F原子的核外电子排布式为______,F元素在周期表中的位置______,F2+能与足量氨水反应得到深蓝色透明溶液,该深蓝色离子的结构式为______。
(2)六种元素中电负性最小的是______,其中C、D、E的第一电离能由大到小的顺序为______(填元素符号)。
(3)A、D的简单氢化物中沸点较高的物质是______(填化学式),原因是______。
(4)C和E的单质反应可生成组成比为1:3的化合物,该化合物的立体构型名称为 ______,中心原子的杂化轨道类型为______。
16.(14分)卤代烃是一类重要的有机合成中间体,是许多有机合成的原料.根据卤代烃的相关性质,回答下列问题.
(1)化合物A的分子式是C3H6Br2,A的氢核磁共振氢谱图如图1所示,则A的结构简式为___________.
(2)某同学用如图2装置(铁架台、酒精灯等略)验证取代反应和消去反应的产物
实验操作Ⅰ:在试管中加入5mL1mol/LNaOH溶液和0.5mL溴乙烷振荡.
实验操作Ⅱ:将试管如图2固定后,水浴加热.
①用水浴加热而不直接用酒精灯加热的目的是________.
②图3是为证明溴乙烷在NaOH乙醇溶液中加热发生的是消去反应.
i实验中需要检验的产物是_______,水的作用是__________,实验现象是_________________.
ii若将“酸性高锰酸钾溶液”换成“Br2的CCl4溶液”,还需要装水的洗气装置吗________?(填“需要”或“不需要”),理由是________.
iii所检验的产物与Br2的CCl4溶液反应的化学方程式为___________.
(3)已知:
分离溴乙烷与1,2-二溴乙烷混合气体的方法是____________.
a.冰水浴冷却→过滤
b.水浴冷却→蒸馏
c.冰水浴冷却→加水萃取→分液
d.水浴冷却→加水萃取→分液.
17. (14分)(1)①为了纪念元素周期表诞生150周年,联合国将2019年定为“国际化学元素周期表年”。Fe在元素周期表中的位置为__________。科学家在研究金属矿物质组分的过程中。发现了Cu-Ni-Fe等多种金属互化物。确定某种金属互化物是晶体还是非晶体的方法是_____________。
②已知:r(Fe2+)为61 pm,r(Co2+)为65 pm。在隔绝空气条件下分别加热FeCO3和CoCO3,实验测得FeCO3的分解温度低于CoCO3,原因是_______。
③下表是Fe和Cu的部分电离能数据,请解释I2(Cu)大于I2(Fe)的主要原因是__。
元素
Fe
Cu
第一电离能I1/kJ·mol-1
759
746
第一电离能I2/kJ·mol-1
1561
1958
(2)原子序数依次增大的五种元素A、B、C、D、E分别处于第一至第四周期,A是前四周期中原子半径最小的元素,B原子核外电子有6种不同的运动状态,常温下C的单质是空气中含量最多的成份,D最高价氧化物对应水化物的酸性最强,E的基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
①B2A2的电子式是___,D所在主族的前四种元素分别与A形成的化合物,其共价键的极性由强到弱的顺序是___(填化学式)。
②A和C形成的简单化合物遇到D单质出现白烟现象,写出有关反应的化学方程式为____。
③向E的硫酸盐溶液中滴加过量氨水,观察到的现象是首先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液,请写出最后-步得到深蓝色透明溶液对应的离子方程式____。
(3)铜与氧元素可形成如图所示的晶胞结构,其中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(,,),则d的坐标参数为__,已知该品体的密度为ρg/cm3,NA是阿伏加德罗常数值,则晶胞参数(晶胞棱长)为__cm(列出计算式即可)。
18.(16分)A(C3H6)是基本有机化工原料。由A制备聚合物C和的合成路线(部分反应条件略去)如图所示:
已知:
①+
②R—C≡NR—COOH
回答下列问题:
(1)D的名称是___________,B含有的含氧官能团的名称是__________。
(2)C的结构简式为_____________,D→E的反应类型为 ____________。
(3)E→F的化学方程式为___________。
(4)中最多有_____个原子共平面,发生缩聚反应生成有机物的结构简式为__________。
(5)B的同分异构体中,与B具有相同的官能团且能发生银镜反应的共有_______种(不考虑立体异构);其中核磁共振氢谱为3组峰,且峰面积之比为6:1:1的是__________(写结构简式)。
(6)结合题给信息,以乙烯、HBr为起始原料制备丙酸,设计合成路线(其他试剂任选)________。
化 学 答 案
1.B 2.C 3.D 4.C 5.C 6.B 7.B 8.B 9.A 10.A 11.A 12.C 13.A 14.B
15.1s22s22p63s23p63d104s1 (或[Ar]3d104s1) 第四周期ⅠB族 Na Cl>P>S H2O 水分子间能形成氢键 三角锥形 sp3
16. 使试管受热均匀 乙烯或CH2=CH2 除去乙烯中的乙醇,防止干扰乙烯的检验 溶液紫红(紫)色褪去 不需要 因为挥发出来的乙醇不会和Br2反应,不会干扰乙烯气体的检验 CH2=CH2+Br2→CH2Br-CH2Br ab
17.(1)第四周期Ⅷ族 X射线衍射 ; Fe2+的半径小于Co2+,FeO的晶格能大于CoO,FeCO3比CoCO3易分解 ;失去第二个电子时,Cu失去的是全充满3d10电子,Fe失去的是4S1电子 (2) HF >HCI> HBr >HI 8NH3+3Cl2===N2+6NH4Cl Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2+4H2O+2OH-
(3)(,,)
18. 3-氯丙烯 酯基 取代反应或水解反应 10 。 8
C H2=C H2CH3CH2BrCH3CH2CNCH3CH2COOH