- 2021-07-07 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年山东省济南市历城第二中学高二下学期开学考试化学试题 Word版
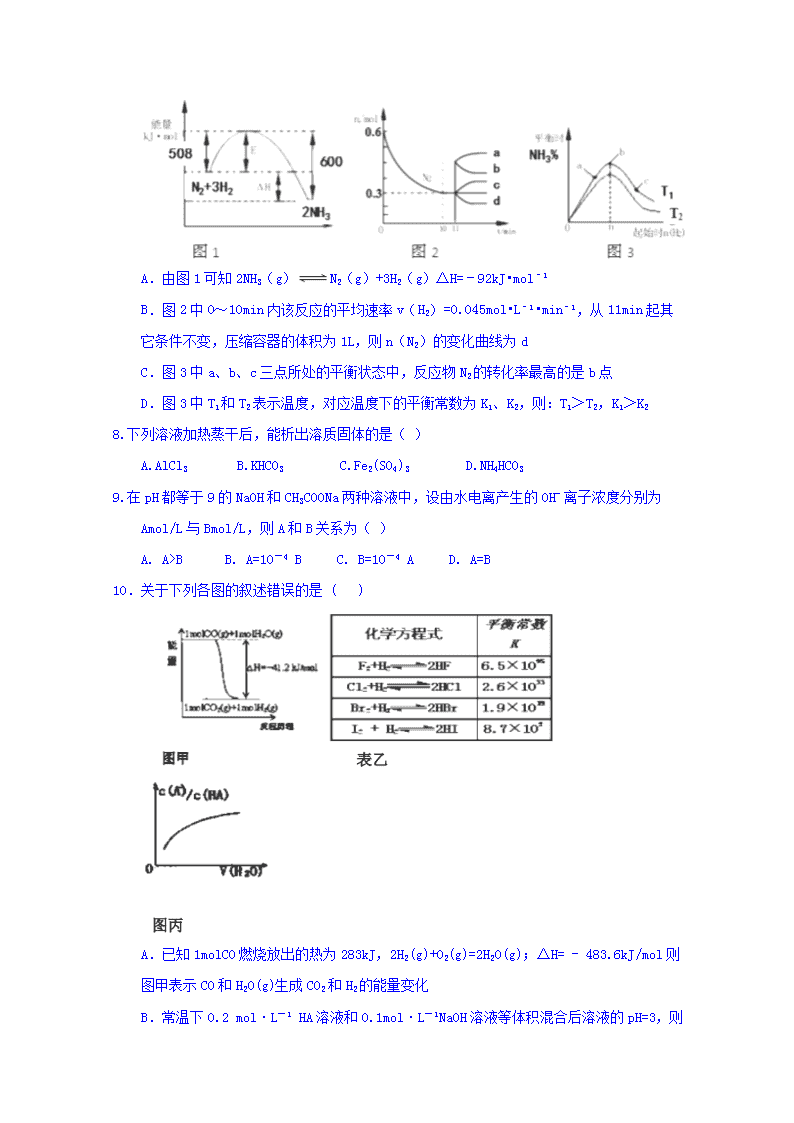
2017-2018学年山东省济南市历城第二中学高二下学期开学考试化学试题 一、选择题(本题包括18小题,每题3分,共54分。每小题只有一个选项符合题意) 1.已知:HCN(aq)与NaOH(aq)反应的ΔH=-12.1 kJ·mol-1;HCl(aq)与NaOH(aq)反应的ΔH=-55.6 kJ·mol-1。则HCN在水溶液中电离的ΔH等于( ) A.-67.7 kJ·mol-1 B.-43.5 kJ·mol-1 C.+43.5 kJ·mol-1 D.+67.7 kJ·mol-1 2.升高温度能加快反应速率的主要原因是 ( ) A.活化分子能量明显增加 B.降低活化分子能量 C.增加活化分子百分数 D.降低反应所需能量 3.在一定条件下的密闭容器中:NO(g) + CO(g)1/2N2(g) + CO2(g);△H = -373.2 kJ/mol,达到平衡后,为提高反应速率和NO的转化率,采取的正确措施是 ( ) A.加催化剂同时升高温度 B.加催化剂同时增大压强 C.升高温度同时充入N2 D.降低温度同时增大压强 4.一定量混合气体在密闭容器中发生如下反应:xA(g)+yB(g)zC(g)(正反应为放热反应);达到平衡后测得A气体的浓度为0.5 mol·L-1;当恒温下将密闭容器的容积扩大一倍并再次达到平衡时,测得A的浓度为0.3 mol·L-1。则下列叙述正确的是 ( ) A.平衡向右移动 B.x+y>z C.B的转化率提高 D.C的体积分数增加 5.可逆反应2A+3B2C+D相同条件下的反应速率,反应速率最快的是( ) A.v (A)= 0.5mol/ (L·min) B.v (B)= 0.01mol/ (L·s) C.v (C)=0.35mol/ (L·min) D.v (D)= 0.4mol/ (L·min) 6.下列叙述中,不能用平衡移动原理解释的是( ) A.红棕色的NO2,加压后颜色先变深后变浅 B.高压比常压有利于合成SO3的反应 C.由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 D.黄绿色的氯水光照后颜色变浅 7.合成氨反应为:N2(g)+3H2(g)2NH3(g).图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线.图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。下列说法正确的是( ) A.由图1可知2NH3(g)N2(g)+3H2(g)△H=﹣92kJ•mol﹣1 B.图2中0~10min内该反应的平均速率v(H2)=0.045mol•L﹣1•min﹣1,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为d C.图3中a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点 D.图3中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则:T1>T2,K1>K2 8.下列溶液加热蒸干后,能析出溶质固体的是( ) A.AlCl3 B.KHCO3 C.Fe2(SO4)3 D.NH4HCO3 9.在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH- 离子浓度分别为Amol/L与Bmol/L,则A和B关系为( ) A. A>B B. A=10-4 B C. B=10-4 A D. A=B 10.关于下列各图的叙述错误的是 ( ) A.已知1molCO燃烧放出的热为283kJ,2H2(g)+O2(g)=2H2O(g);ΔH= - 483.6kJ/mol则图甲表示CO和H2O(g)生成CO2和H2的能量变化 B.常温下0.2 mol·L-1 HA溶液和0.1mol·L-1 NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c(A-)> c(Na+)>c(H+)>c(OH-) C.常温下,X2(g)和H2反应生成HX的平衡常数如表乙所示,仅依据K的变化,就可以说明在相同条件下,平衡时X2(从F2到I2)的转化率逐渐减小,且HX的还原性逐渐减弱 D.图丙中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,的变化情况 11.已知25℃时有关弱酸的电离平衡常数见下表: 弱酸化学式 HA H2B 电离平衡常数(25℃) Ka=1.7×10﹣6 K1=1.3×10﹣3 K2=5.6×10﹣8 则下列有关说法正确的是( ) A.等物质的量浓度的各溶液pH关系为:pH(Na2B)>pH(NaHB)>pH(NaA) B.将a mol•L﹣1的HA溶液与a mol•L﹣1 的NaA溶液等体积混合,混合液中:c(Na+)>c(A﹣) C.向Na2B溶液中加入足量的HA溶液发生反应的离子方程式为:B2﹣+2HA═2A﹣+H2B D.NaHB溶液中部分微粒浓度的大小为:c(Na+)>c(HB﹣)>c(B2﹣)>c(H2B) 12.常温时,将pH=13的强碱溶液和pH=2的强酸溶液混合,所得溶液的pH=11,则强碱溶液和强酸溶液的体积之比为( ) A.1:9 B.9:1 C.10:1 D.1:10 13.下列实验中,由于错误操作导致所测出的数据一定偏低的是( ) A. 用量筒量取一定体积液体时,俯视读出的读数 B. 用标准盐酸滴定氢氧化钠溶液测碱液浓度时,酸式滴定管洗净后,没有用标准盐酸润洗,直接装标准盐酸滴定碱液,所测出的碱液的浓度值 C. 滴定前酸式滴定管尖嘴部分未充满溶液有气泡滴定后气泡消失 D. 做中和热测定时,在大小烧杯之间没有垫碎泡沫塑料(或纸条)所测出的中和热数值 14.以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下:下列说法不正确的是( ) A.在阴极室,发生的电极反应为2H2O+2e-=2OH-+H2↑ B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO+2H+Cr2O+H2O向右移动 C.该制备过程中总反应的化学方程式为4K2CrO4+4H2O=2K2Cr2O7+4KOH+2H2↑+O2↑ D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比(nK/nCr)为d,则此时铬酸钾的转化率为1-d 15.将下图所示实验装置的K闭合,下列判断正确的是( ) A.Cu电极上发生还原反应 B.电子沿 Zn→a→b→Cu 路径流动 C.片刻后甲池中c(SO)增大 D.片刻后可观察到滤纸b点变红色 16.下列说法中,正确的是( ) A.饱和石灰水中加入一定量生石灰,温度明显升高,所得溶液的pH会增大 B.在测定BaSO4沉淀的量前,先洗涤BaSO4沉淀,洗涤剂选择水或稀硫酸时的效果相同 C.AgCl 悬浊液中加入 KI 溶液,白色沉淀变成黄色,证明此条件下 Ksp(AgCl) > Ksp(AgI) D.加水稀释酸溶液时,所有离子的浓度都降低 17.用情性电极电解一定浓度的CuSO4溶液,通电—段时间后,向所得的溶液中加入9.8g Cu(OH)2后恰好恢复到电解前的浓度和pH。则下列说法正确的是( ) A. 电解过程中阴极没有气体生成 B. 电解过程中阳极收集到的气体体枳为1.12L(标况下) C. 原CuSO4溶液的浓度为0.1 mol·L-1 D. 电解过程中转移的电子的物质的量为0.4mol 18.糕点包装中常用的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。下列分析正确的是( ) A.脱氧过程是吸热反应,可降低温度,延长糕点保质期 B.脱氧过程中铁作原电池正极,电极反应为:Fe-3e-=Fe3+ C.脱氧过程中碳作原电池负极,电极反应为:2H2O+O2+4e-=4OH- D.含有1.12 g铁粉的脱氧剂,理论上最多能吸收氧气336 mL(标准状况) 二卷,每空2分,共46分 19. (1)用CH4催化还原NOx可以消除氮氧化物的污染。例如: CH4(g)+4NO2(g)==4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1 CH4(g)+4NO(g)==2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1 若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为________(阿伏加德罗常数用NA表示),放出的热量为________kJ。 (2)已知:C3H8(g)= CH4(g)+HC≡CH(g)+H2(g) ΔH1=+156.6 kJ·mol-1 CH3CH=CH2(g)→ CH4(g)+HC≡CH(g) ΔH2=+32.4 kJ·mol-1 则相同条件下,反应C3H8(g)=CH3CH=CH2 (g)+H2(g)的ΔH=________kJ·mol-1。 (3)甲烷在高温下与水蒸气反应的方程式为:CH4(g)+H2O(g)===CO(g)+3H2(g)。部分物质的燃烧热数据如下表:已知1mol H2O(g)转变为1 mol H2O(l)时放出44.0 kJ热量。写出CH4和H2O在高温下反应的热化学方程式__________________________。 物质 燃烧热(kJ·mol-1) H2(g) -285.8 CO(g) -283.0 CH4(g) -890.3 20.我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法. I.已知反应Fe2O3(s)+CO(g)Fe(s)+CO2(g) △H=﹣23.5kJ•mol﹣1,该反应在1000℃的平衡常数等于4.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡. (1)CO的平衡转化率= _________。 (2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是_________。 a.提高反应温度 b.增大反应体系的压强 c.选取合适的催化剂 d.及时吸收或移出部分CO2 e.粉碎矿石,使其与平衡混合气体充分接触 Ⅱ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:CO(g)+2H2(g)CH3OH(g).请根据图示回答下列问题: (1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=_________。 (2)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表: 容器 反应物投入的量 反应物的转化率 CH3OH的浓度 能量变化(Q1、Q2、Q3均大于0) 甲 1mol CO和2mol H2 α1 c1 放出Q1kJ热量 乙 1mol CH3OH α2 c2 吸收Q2kJ热量 丙 2mol CO和4mol H2 α3 c3 放出Q3kJ热量 则下列关系正确的是 A.c1=c2 B.2Q1=Q3 C.2α1=α3 D.α1+α2=1 E该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量 Ⅲ.以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,图3是目前研究较多的一类固体氧化物燃料电池工作原理示意图.回答下列问题: (1)B极上的电极反应式为_________。 (2)若用该燃料电池做电源,用石墨做电极电解100mL 1mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为_________(标况下)。 21.电离平衡常数是衡量弱电解质电离程度强弱的量.已知如表数据. 化学式 电离平衡常数(25℃) NH3•H2O Kb=1.77×10﹣5 HCN Ka=4.93×10﹣10 CH3COOH Ka=1.76×10﹣5 H2CO3 Ka1=4.30×10﹣7 Ka2=5.61×10﹣11 (1)25℃时,pH=11的NaCN溶液中水电离出的c(OH﹣)=______ mol•L﹣1 (2)25℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为_________. (3)NH4Cl溶液呈______性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈_____性,0.1mol.L﹣1 NH4HCO3溶液中物质的量浓度最大的离子是________(填化学式). (4)25℃时,等浓度的CH3COOH溶液和CH3COONa溶液等体积混合,混合溶液中各种离子浓度大小为_________. (5)向NaCN溶液中通入少量CO2,所发生反应的化学方程式为___________. 22.(1)常温时,将浓度为m mol•L﹣1的CH3COOH溶液和n mol•L﹣1 NaOH溶液等体积混合,混合后溶液的pH=7,m与n的大小关系是m____ n(填“>”、“<”或“=”,下同);若将pH=2的CH3COOH溶液和pH=12的NaOH溶液等体积混合,混合溶液的PH______ 7。 (2)消防用的泡沫灭火器内装的药品是硫酸铝溶液和碳酸氢钠溶液,用离子方程式表示二者混合时发生的反应_________________. (3)常温下某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合pH=7,则酸溶液体积V1和碱溶液体积V2的关系为_________. (4)常温时Ksp[Cu(OH)2]=2.2×10﹣20,将Cu(OH)2溶于2.2mol/L CuCl2溶液中形成平衡溶液的pH为____. (5)物质的量浓度相同的下列溶液①(NH4)2CO3②(NH4)2SO4③NH4HCO3④NH4HSO4⑤NH4Cl⑥NH3•H2O,c(NH4+)由小到大的排列顺序是___________(填序号)。 答案 1-5.C C B B D 6-10.C B C B C 11-15.D A D D A 16.C 17.D 18.D 19. (每空2分) (1)1.6NA 173.4 (2)+124.2 (3)CH4(g) + H2O(g)===CO(g) + 3H2(g) ΔH=+206.1 kJ/mol 20.(每空2分)I.(1)60%;(2)d; Ⅱ(1)0.15mol/(L•min); (2)ADE; Ⅲ(1)CH4﹣8e﹣+4O2﹣=CO2+2H2O; (2)1.12L 21.(每空2分)(1)10﹣3; (2)Na2CO3溶液>NaCN溶液>CH3COONa溶液; (3)酸;碱;NH4+; (4)c(CH3COO﹣)>c(Na+)>c(H+)>c(OH﹣); (5)NaCN+H2O+CO2=HCN+NaHCO3. 22.(每空2分)(1)>;<; (2)Al3++3HCO3﹣=Al(OH)3↓+3CO2↑; (3)V2=102V1; (4)4; (5)⑥③⑤④①②. 查看更多