2020高考化学二轮复习考前保温训练4含解析
考前保温训练7+4(4)
1.化学与生活、生产和社会发展密切相关。下列说法正确的是( )
A.《天工开物》中“凡石灰,经火焚炼而用”里的石灰,指的是Ca(OH)2
B.某品牌的八宝粥不含任何糖类物质,糖尿病人可以放心食用
C.未成熟的苹果肉遇碘酒变蓝,成熟苹果的汁液不能与银氨溶液反应
D.用氯化铁溶液洗涤银镜反应后的试管比用硫酸铁溶液效果好
答案 D
解析 A项,“凡石灰,经火焚炼而用”是指碳酸钙受热分解生成CaO,这里“石灰”是指CaCO3,错误;B项,八宝粥中含有淀粉,属于糖类物质,错误;C项,未成熟的苹果肉中含有淀粉,遇碘酒变蓝,成熟苹果的汁液中含有葡萄糖,能与银氨溶液反应,错误;D项,根据洗涤原理:Fe3++Ag===Fe2++Ag+,FeCl3和金属银反应生成AgCl和FeCl2,硫酸铁和银反应生成Ag2SO4,Ag2SO4的溶解度大于AgCl,故加入FeCl3溶液效果更好,正确。
2.设阿伏加德罗常数的值为NA。下列说法正确的是( )
A.常温下,1 mol C6H12中含C—C键的数目一定小于6NA
B.白磷(P4)为正四面体结构,1 mol P4与1 mol金刚石所含共价键数目之比为1∶1
C.4.0 g由H218O与D216O组成的混合物中所含中子数为2NA
D.浓度均为1 mol/L的醋酸和醋酸钠溶液等体积混合,溶液中CH3COOH和CH3COO-的总数为2NA
答案 C
解析 A项,若C6H12为环己烷,则1 mol C6H12含有C—C键数目等于6NA,错误;B项,金刚石中每个C原子形成2个共价键,则1 mol P4与1 mol金刚石所含共价键数目之比为6 mol∶2 mol=3∶1,错误;C项,1个H218O和D216O分子都含有10个中子,且摩尔质量均为20 g/mol,则4.0 g混合物的总物质的量为0.2 mol,所含中子数为2NA,正确;D项,题目未指明醋酸和醋酸钠溶液的具体体积,无法计算醋酸和醋酸钠的物质的量,错误。
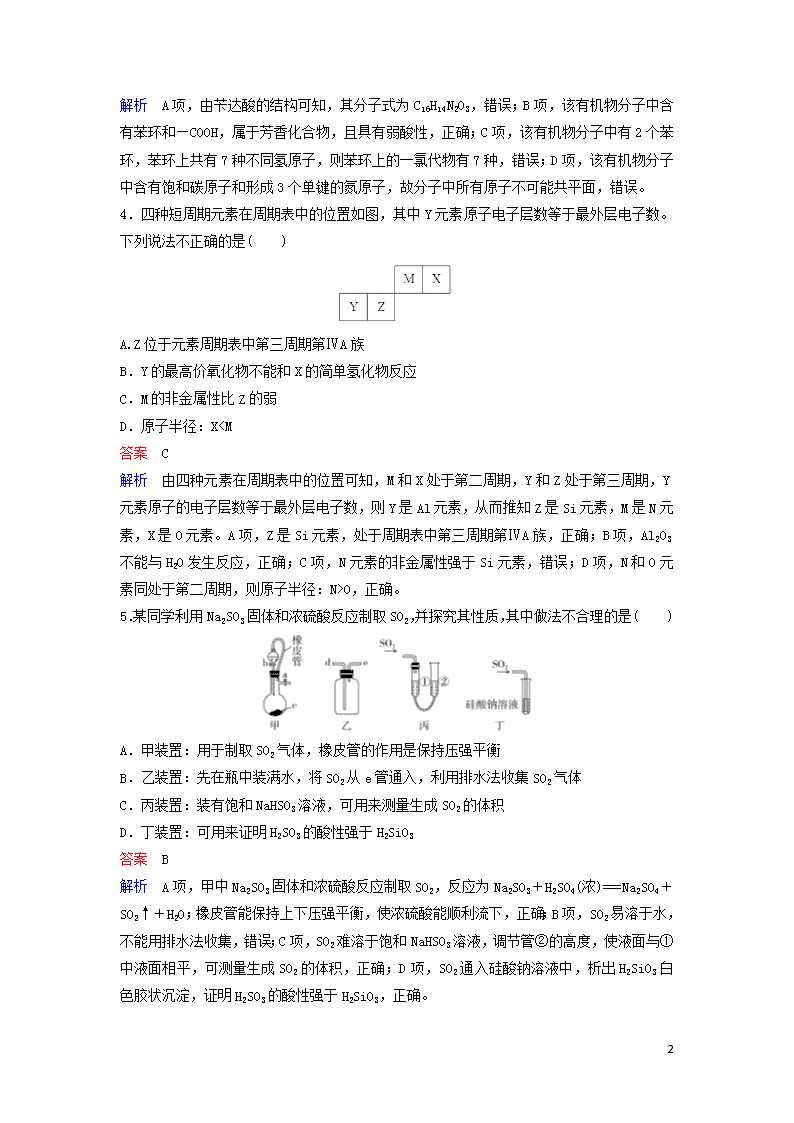
3.2017年12月5日国家食药监总局要求莎普爱思尽快启动临床有效性试验。莎普爱思有效成分是由苄达酸与赖氨酸生成的有机盐,苄达酸结构如图所示。下列关于苄达酸的叙述正确的是( )
A.分子式为C16H16N2O3
B.属于芳香化合物,且有弱酸性
C.苯环上的一氯代物有5种
D.所有原子可能共平面
答案 B
12
解析 A项,由苄达酸的结构可知,其分子式为C16H14N2O3,错误;B项,该有机物分子中含有苯环和—COOH,属于芳香化合物,且具有弱酸性,正确;C项,该有机物分子中有2个苯环,苯环上共有7种不同氢原子,则苯环上的一氯代物有7种,错误;D项,该有机物分子中含有饱和碳原子和形成3个单键的氮原子,故分子中所有原子不可能共平面,错误。
4.四种短周期元素在周期表中的位置如图,其中Y元素原子电子层数等于最外层电子数。下列说法不正确的是( )
A.Z位于元素周期表中第三周期第ⅣA族
B.Y的最高价氧化物不能和X的简单氢化物反应
C.M的非金属性比Z的弱
D.原子半径:X
O,正确。
5.某同学利用Na2SO3固体和浓硫酸反应制取SO2,并探究其性质,其中做法不合理的是( )
A.甲装置:用于制取SO2气体,橡皮管的作用是保持压强平衡
B.乙装置:先在瓶中装满水,将SO2从e管通入,利用排水法收集SO2气体
C.丙装置:装有饱和NaHSO3溶液,可用来测量生成SO2的体积
D.丁装置:可用来证明H2SO3的酸性强于H2SiO3
答案 B
解析 A项,甲中Na2SO3固体和浓硫酸反应制取SO2,反应为Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O;橡皮管能保持上下压强平衡,使浓硫酸能顺利流下,正确;B项,SO2易溶于水,不能用排水法收集,错误;C项,SO2难溶于饱和NaHSO3溶液,调节管②的高度,使液面与①中液面相平,可测量生成SO2的体积,正确;D项,SO2通入硅酸钠溶液中,析出H2SiO3白色胶状沉淀,证明H2SO3的酸性强于H2SiO3,正确。
12
6.如图所示是一种以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度高达700~900 ℃时,O2-可在该固体氧化物电解质中自由移动,生成物均为无毒无害的物质。下列说法正确的是( )
A.电池内的O2-由电极乙移向电极甲
B.电池总反应为N2H4+2O2===2NO+2H2O
C.当电极甲上有1 mol N2H4被消耗时,电极乙上有1 mol O2被氧化
D.电池外电路的电子由电极乙移向电极甲
答案 A
解析 A项,由图可知,N2H4通入电极甲发生氧化反应,O2通入电极乙发生还原反应生成O2-,则电极甲为负极,电极乙为正极,电池内部阴离子向负极移动,故电池内的O2-由电极乙移向电极甲,正确;B项,该电池反应生成物均为无毒无害的物质,则产物为N2和H2O,故电池总反应式为N2H4+O2===N2+2H2O,错误;C项,由B项分析可知,甲电极上有1 mol N2H4被消耗时,电极乙上有1 mol O2被还原,错误;D项,外电路中,电子由负极经导线流向正极,故电子由电极甲经导线流向电极乙,错误。
7.25 ℃时,向Na2CO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。已知:lgX=lg或lg,下列叙述正确的是( )
A.曲线m表示pH与lg的变化关系
B.当溶液呈中性时,c(Na+)=c(HCO3-)+2c(CO32-)
C.Ka1(H2CO3)=1.0×10-6.4
D.25 ℃时,CO32-+H2OHCO3-+OH-的平衡常数为1.0×10-7.6
答案 C
解析 A项,溶液中滴加盐酸,先后发生反应:CO32-+H+===HCO3-、HCO3-+H+===CO2↑+H2O,根据图像可知,曲线m表示pH与lg的变化关系,错误;B项,
12
据电荷守恒可得:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)+c(Cl-),当溶液呈中性时,c(H+)=c(OH-),从而可得c(Na+)=c(HCO3-)+2c(CO32-)+c(Cl-),错误;C项,曲线n代表pH与lg的变化关系,N点坐标为(7.4,1),则有c(HCO3-)/c(H2CO3)=10,此时c(H+)=10-7.4 mol·L-1,根据电离平衡常数的定义可得,H2CO3的一级电离平衡常数为Ka1(H2CO3)==10×10-7.4=1.0×10-6.4,正确;D项,反应CO32-+H2OHCO3-+OH-的平衡常数为K=,图中M点坐标为(9.3,-1),则有c(CO32-)/c(HCO3-)=0.1,此时c(H+)=10-9.3 mol·L-1,c(OH-)=[(1×10-14)/(10-9.3)]mol·L-1=10-4.7 mol·L-1,代入平衡常数表达式可得:K=10×10-4.7=10-3.7,错误。
8.镁及其化合物是实验设计的热点载体,查阅资料。
ⅰ
2NO2+2NaOH===NaNO2+NaNO3+H2O
ⅱ
Mg3N2与水反应
ⅲ
常温下,NH3·H2O、CH3COOH的电离常数都等于1.8×10-5
Ⅰ.探究镁的性质。
某学习小组设计实验探究镁与二氧化氮反应的产物,实验装置如图所示。
(1)B中试剂是________;D装置的作用是_____________________________________
________________________________________________________________________。
(2)实验时,先启动A中反应,当C装置中充满红棕色气体时点燃酒精灯,这样操作的目的是________________________________________________________________________
________________________________________________________________________。
(3)确定有N2生成的实验现象是_________________________________________________
________________________________________________________________________。
(4)实验完毕后,设计实验确认产物中有Mg3N2,取少量C中残留固体于试管中,滴加蒸馏水,________________________,则产物中有氮化镁。
(5)经测定,Mg与NO2反应生成MgO、Mg3N2和N2,其中Mg3N2和N2的物质的量相等。C中发生反应的化学方程式为_________________________________________________。
Ⅱ.探究Mg(OH)2在氯化铵溶液中溶解的原因。
供选试剂有:氢氧化镁、蒸馏水、硝酸铵溶液、盐酸、醋酸铵溶液。
取少量氢氧化镁粉末投入氯化铵溶液中,振荡,白色粉末全部溶解。为了探究其原因,他们提出两种假设。
12
假设1:氯化铵溶液呈酸性,H++OH-===H2O,促进Mg(OH)2溶解;
假设2:NH4++OH-===NH3·H2O,促进Mg(OH)2溶解。
(6)请你帮他们设计实验探究哪一种假设正确:_____________________________________
________________________________________________________________________。
答案 (1)P2O5等 吸收E中挥发出来的水蒸气
(2)排尽装置内空气,避免O2、CO2、N2等与镁反应
(3)E中产生气泡,瘪气球缓慢鼓起
(4)有刺激性气味的气体逸出(产生的气体能使湿润红色石蕊试纸变蓝色)
(5)11Mg+4NO28MgO+Mg3N2+N2(写成4Mg+2NO24MgO+N2、3Mg+N2Mg3N2也可)
(6)取少量氢氧化镁于试管中,加入足量CH3COONH4溶液,若白色固体溶解,则假设2正确;若白色固体不溶解,则假设1正确
解析 (1)B中试剂用于干燥NO2,由于NO2与水反应生成酸,故不能用碱性干燥剂,应选择酸性或中性干燥剂,可以是P2O5等;D装置的作用是吸收E中挥发出来的水蒸气(防止E中水蒸气进入C装置的玻璃管中干扰实验)。
(2)实验时,先启动A中反应,当C装置中充满红棕色气体时点燃酒精灯,这样操作的目的是排尽装置内空气,避免O2、CO2、N2等与镁反应。
(3)依据题中信息,过量的二氧化氮可以被氢氧化钠溶液吸收,所以确定有N2生成的实验现象是E中产生气泡,瘪气球缓慢鼓起。
(4)根据表中资料ⅱ知Mg3N2与水反应生成Mg(OH)2和NH3,实验完毕后,设计如下实验确认产物中有Mg3N2:取少量C中残留固体置于试管中,滴加蒸馏水,有刺激性气味的气体逸出(产生的气体能使湿润红色石蕊试纸变蓝色),则产物中有氮化镁。
(5)经测定,Mg与NO2反应生成MgO、Mg3N2和N2,其中Mg3N2和N2的物质的量相等,所以C中发生反应的化学方程式为11Mg+4NO28MgO+Mg3N2+N2。
(6)由题中信息可知,常温下,NH3·H2O和CH3COOH的电离常数相同,则CH3COONH4溶液中CH3COO-和NH4+的水解程度相等,故其溶液显中性。可以设计如下实验:取少量氢氧化镁置于试管中,加入足量CH3COONH4溶液,若白色固体溶解,则假设2正确;若白色固体不溶解,则假设1正确。
9.工业上利用硫铁矿烧渣(主要成分为Fe3O4、Fe2O3、FeO、SiO2)为原料制备高档颜料——铁红(Fe2O3),具体生产流程如下:
12
试回答下列问题:
(1)实验室实现“步骤Ⅱ”中分离操作所用的玻璃仪器有________、玻璃棒和烧杯等;该步骤是为了除去________(填相关物质的化学式)。
(2)检验步骤Ⅲ已经进行完全的操作是_____________________________________________
________________________________________________________________________。
(3)步骤Ⅴ的反应温度一般需控制在35 ℃以下,其目的是_________________________ _______________________________________________;
该步骤中反应生成FeCO3的离子方程式为_____________________________ _____________________________________________________________________________。
(4)步骤Ⅵ中发生反应的化学方程式为___________________________________________。
(5)步骤Ⅴ中,FeCO3达到沉淀溶解平衡时,若c(Fe2+)=1×10-6 mol·L-1,欲使所得的FeCO3中不含有Fe(OH)2,应控制溶液的pH≤________(已知:Ksp[Fe(OH)2]=4.9×10-17,lg7=0.8)。
(6)欲测定硫铁矿矿渣中Fe元素的质量分数,称取a g样品,充分“酸溶”“水溶”后过滤,向滤液中加入足量的H2O2,充分反应后加入NaOH溶液至不再继续产生沉淀,经过滤、洗涤、灼烧至固体恒重,冷却后称得残余固体b g,测得该样品中Fe元素的质量分数为________。
答案 (1)漏斗 SiO2
(2)取步骤Ⅲ反应后的溶液少量于试管中,加入少量KSCN溶液,若溶液未呈现血红色,则说明已经进行完全
(3)防止NH4HCO3分解、减少Fe2+的水解
2HCO3-+Fe2+===FeCO3↓+CO2↑+H2O
(4)4FeCO3+O22Fe2O3+4CO2
(5)8.8 (6)7b/10a
解析 硫铁矿烧渣经稀硫酸溶解后,过滤除去不溶物SiO2,向滤液中加入过量的铁粉调节溶液的pH=1,待溶液中检验不出Fe3+后,再调节pH至5~6.5,过滤除去过量的铁粉,向滤液中加入碳酸氢铵沉淀Fe2+,过滤得到碳酸亚铁,最后在空气中煅烧碳酸亚铁得到氧化铁。
(1)实验室实现“步骤Ⅱ”中分离操作所用的玻璃仪器有漏斗、玻璃棒和烧杯等;该步骤是为了除去SiO2。
(2)检验步骤Ⅲ已经进行完全的操作是取步骤Ⅲ反应后的溶液少量于试管中,
12
加入少量KSCN溶液,若溶液未呈现血红色,则说明已经进行完全。
(3)步骤Ⅴ的反应温度一般需控制在35 ℃以下,其目的是防止NH4HCO3分解、减少Fe2+的水解;该步骤中反应生成FeCO3的离子反应方程式为2HCO3-+Fe2+===FeCO3↓+CO2↑+H2O。
(4)步骤Ⅵ中发生反应的化学反应方程式为4FeCO3+O22F2O3+4CO2。
(5)步骤Ⅴ中,FeCO3达到沉淀溶解平衡时,若c(Fe2+)=1×10-6 mol·L-1,欲使所得的FeCO3中不含有Fe(OH)2,应控制溶液的c(OH-)≤ mol·L-1=7×10-6 mol·L-1,则有c(H+)≥×10-8 mol·L-1,从而可知溶液的pH≤8.8。
(6)由题意可知,称取a g样品,充分“酸溶”“水溶”后过滤,向滤液中加入足量的H2O2,充分反应后加入NaOH溶液至不再继续产生沉淀,经过滤、洗涤、灼烧至固体恒重,冷却后称得氧化铁的质量为b g,则有m(Fe)== g,故该样品中Fe元素的质量分数为=。
10.随着科技的进步,合理利用资源、保护环境成为当今社会关注的焦点。甲胺铅碘(CH3NH3PbI3)可用于全固态钙钛矿敏化太阳能电池的敏化剂,由CH3NH2、PbI2及HI为原料合成。回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g)CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下表:
共价键
C—O
H—O
N—H
C—N
键能/(kJ·mol-1)
351
463
393
293
则该反应的ΔH=________kJ·mol-1。
(2)上述反应中所需的甲醇工业上利用水煤气合成,反应为CO(g)+2H2(g)CH3OH(g) ΔH<0。
在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应。当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为________。
②X轴上a点的数值比b点________(填“大”或“小”)。某同学认为上图中Y轴表示温度,你认为他判断的理由是_______________________________________________。
(3)常温下,已知Ksp(PbI2)=4.0×10-9,Ksp(PbCl2)=1.6×10-5,则反应PbCl2(s)+2I-(aq)
12
PbI2(s)+2Cl-(aq)的平衡常数K=________。
(4)分解HI曲线和液相法制备HI反应曲线分别如图1和图2所示:
①反应H2(g)+I2(g)2HI(g)的ΔH________0(填“>”或“<”)。
②将二氧化硫通入碘水中会发生反应:SO2+I2+2H2O===3H++HSO4-+2I-,I2+I-I3-。图2中曲线a、b分别代表的粒子是________、________(填粒子符号);由图2可知,要提高碘的还原率,除控制温度外,还可以采取的措施是__________________ ______________________________________________________。
答案 (1)-12
(2)①25%
②小 随着Y值的增大,φ(CH3OH)减小,平衡CO(g)+2H2(g)CH3OH(g)向逆反应方向进行(答案合理即可)
(3)4 000
(4)①< ②H+ I3- 减小
解析 (1)根据反应热与键能的关系可知,该反应的ΔH=反应物总键能-生成物总键能=(351 kJ·mol-1+393 kJ·mol-1)-(293 kJ·mol-1+463 kJ·mol-1)=-12 kJ·mol-1。
(2)①将1 mol CO和2 mol H2通入密闭容器中进行反应,设CO的转化率为α,则有
CO(g)+2H2(g)CH3OH(g)
起始量/mol 1 2 0
转化量/mol α 2α α
平衡量/mol 1-α 2-2α α
平衡时,M点CH3OH的体积分数为10%,则有α/(1-α+2-2α+α)×100%=10%,解得α=0.25=25%。
②由图可知,Y一定时,从左至右随着X的变化,φ(CH3OH)逐渐增大;X一定时,随Y的减小,φ(CH3OH)逐渐增大。其他条件不变,升高温度,平衡CO(g)+2H2(g)CH3OH(g)逆向移动,φ(CH3OH)减小,而增大压强,平衡正向移动,φ(CH3OH)增大,故X轴表示压强,Y轴表示温度。a点φ(CH3OH)小于b点,则a点压强小于b点压强。
(3)反应PbCl2(s)+2I-(aq)PbI2(s)+2Cl-(aq)的平衡常数K==
12
eq f(Ksp(PbCl2),Ksp(PbI2))==4 000。
(4)①由图1可知,升高温度,HI的平衡物质的量逐渐减小,H2的物质的量增大,说明升高温度,平衡逆向移动,则有ΔH<0。
②随着n(I2)/n(SO2)的增大n(H+)、n(HSO4-)几乎不发生变化,n(I3-)增大,故曲线a代表H+,曲线b代表I3-。要提高碘的还原率,除控制温度外,还可以采取的措施是减小。
11.[选修—有机化学基础]高分子化合物I为重要的化工原料,其合成路线如下:
已知:①
②R—BrR—CNR—COOH
(1)A的名称为________,H的分子式为________。
(2)B→C的反应条件为_______________________________________________________,
E→F的反应类型为____________。
(3)E的顺式结构式为_________________________________________________________。
(4)C+G→H的化学方程式为__________________________________________________。
(5)依据H→I的反应原理,写出与乙二醇合成有机高分子的化学方程式:________________________________________________________。
(6)B经过完全水解后得到M,则符合下列条件的M的同分异构体有________种(不考虑立体异构)。
①能发生银镜反应
②能与NaOH溶液发生反应
其中核磁共振氢谱有4组峰且峰面积比为9∶2∶2∶1的结构简式为________。
(7)参照上述合成路线,写出由1,3-丁二烯和乙炔为起始原料合成的流程图(无机试剂任选)。
________________________________________________________________________
________________________________________________________________________
12
答案 (1)1-甲基环己烯 C11H14O4
(2)NaOH的醇溶液,加热 取代反应
(3)
(4)
(5)
(6)17 HCOOCH2CH2C(CH3)3
解析 D(C2H2)与Br2/CCl4反应生成E(C2H2Br2),该步反应为加成反应,则D为HC≡CH,E为:BrCH===CHBr;E与HCN反应生成F,FG,结合已知信息②可知,E→F为取代反应,F→G为水解反应,则F为NCCH===CHCN,G为HOOCCH===CHCOOH。C与G在一定条件下反应生成H(),结合已知信息①可知,该步反应为成环反应,则C为。A(C7H12)与Br2/CCl4发生加成反应生成B,B→C(),则B→C的反应为消去反应,从而推知B为,A为。H()与乙二醇在浓H2SO4、加热条件下发生缩聚反应生成I,则I为。
(1)A的结构简式为,其名称为1-甲基环己烯。H为,其分子式为C11H14O4。
12
(2)B→C为消去反应,反应条件为NaOH醇溶液、加热。由上述分析可知,E→F为取代反应。
(3)E为BrCH===CHBr,其顺式结构为。
(4)C()与G(HOOCCH===CHCOOH)在一定条件下发生成环反应生成H(),该反应的实质是加成反应,化学方程式为+。
(5)分子中含有2个—COOH,乙二醇(HOCH2CH2OH)分子中含有2个—OH,在一定条件下可发生缩聚反应生成高分子化合物,化学方程式为n+nHOCH2CH2OH+(2n-1)H2O。
(6)B()中含有—Br,完全水解生成M,则M为。M的同分异构体满足条件:①能发生银镜反应,则含有—CHO;②能与NaOH溶液发生反应,则含有—COOH或—COO—(酯基);结合M的分子组成及不饱和度分析可知,M的同分异构体中含有—OOCH,且不含环状结构,考虑碳链异构及—OOCH在碳链上的位置,符合条件的同分异构体有17种。核磁共振氢谱有4组峰,且峰的面积之比为9∶2∶2∶1的有机物分子中含有4种不同化学环境的氢原子,且原子个数之比为9∶2∶2∶1,该有机物必定含有—C(CH3)3,则该有机物为HCOOCH2CH2C(CH3)3。
(7)结合已知信息①、②,1,3-丁二烯为CH2===CH—CH===CH2,与HC≡CH发生成环反应生成,再与足量Br2发生加成反应生成,与HCN发生取代反应生成,最后发生酸性水解生成。
12
12