- 2021-07-06 发布 |
- 37.5 KB |
- 15页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届二轮复习化学反应原理作业(全国通用)
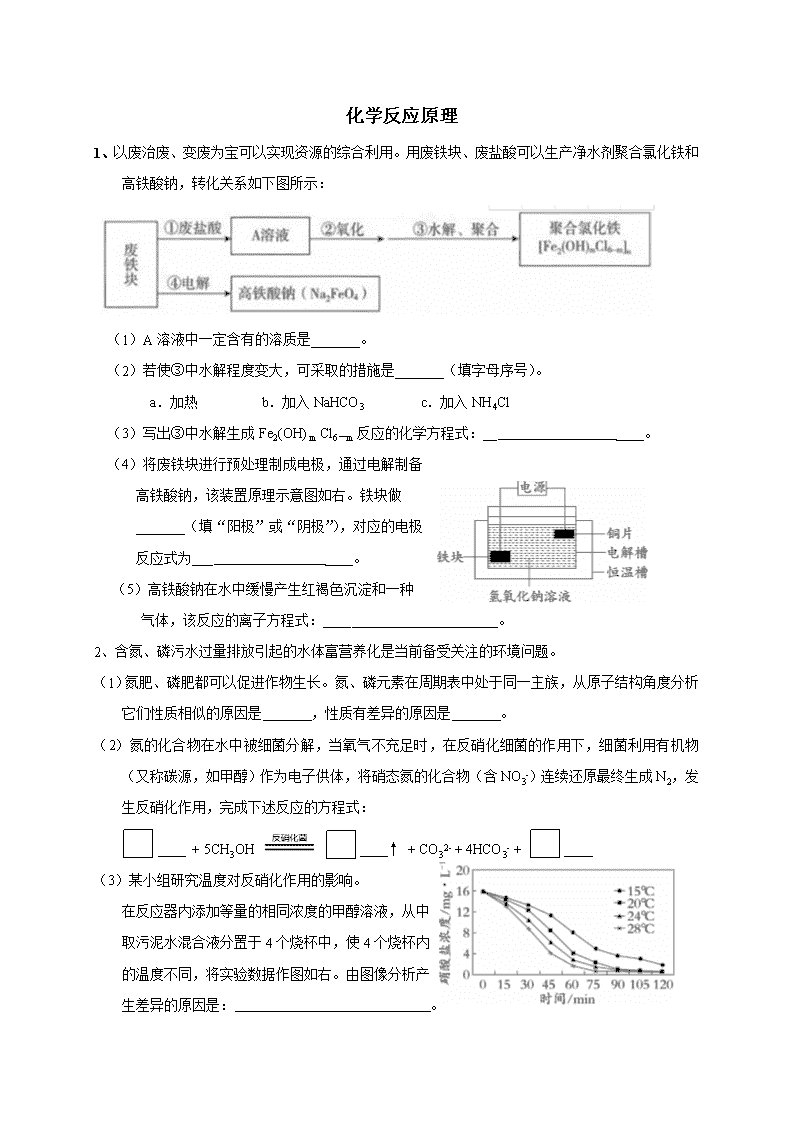
化学反应原理 1、以废治废、变废为宝可以实现资源的综合利用。用废铁块、废盐酸可以生产净水剂聚合氯化铁和高铁酸钠,转化关系如下图所示: (1)A溶液中一定含有的溶质是_______。 (2)若使③中水解程度变大,可采取的措施是_______(填字母序号)。 a.加热 b.加入NaHCO3 c.加入NH4Cl (3)写出③中水解生成Fe2(OH) m Cl6-m反应的化学方程式:__ ____。 (4)将废铁块进行预处理制成电极,通过电解制备 高铁酸钠,该装置原理示意图如右。铁块做 _______(填“阳极”或“阴极”),对应的电极 反应式为___ ____。 (5)高铁酸钠在水中缓慢产生红褐色沉淀和一种 气体,该反应的离子方程式:____ ___。 2、含氮、磷污水过量排放引起的水体富营养化是当前备受关注的环境问题。 (1)氮肥、磷肥都可以促进作物生长。氮、磷元素在周期表中处于同一主族,从原子结构角度分析它们性质相似的原因是 ,性质有差异的原因是 。 (2)氮的化合物在水中被细菌分解,当氧气不充足时,在反硝化细菌的作用下,细菌利用有机物(又称碳源,如甲醇)作为电子供体,将硝态氮的化合物(含NO3-)连续还原最终生成N2,发生反硝化作用,完成下述反应的方程式: + 5CH3OH ↑ + CO32- + 4HCO3- + (3)某小组研究温度对反硝化作用的影响。 在反应器内添加等量的相同浓度的甲醇溶液,从中 取污泥水混合液分置于4个烧杯中,使4个烧杯内 的温度不同,将实验数据作图如右。由图像分析产 生差异的原因是: 。 (4)某小组研究浓度对反硝化作用的影响。 ①保持其他条件相同,在反应器内添加不等量的甲醇溶液,使4个烧杯碳源浓度依次为183 mg•L-1、236 mg•L-1、279 mg•L-1和313 mg•L-1。该小组预测反硝化速率变化的趋势是增大,预测依据是 。 ②碳源为183 mg•L-1的污水经过2 h的反硝化试验,可使NO3-由15.0 mg•L-1降至8.8 mg•L-1。已知M(NO3-) = 62 g•mol-1,NO3-的转化速率是________mol (L•h)-1。 3、为探究不同条件下甘油(丙三醇)和辛酸酯化合成甘油二酯的最佳条件,科研工作者做了甘油二酯的酶法合成工艺研究。 实验1:研究不同投料比对产率的影响 (1)理论分析合成甘油二酯所需辛酸与甘油的投料比(物质的量之比)为2∶1。实验证明提高投料比,甘油二酯的产率会降低,其原因可能是 。 实验2:研究吸水剂对反应的影响 (2)硅胶易与羟基结合,故有较强的亲水性,易于吸附水分子。但是在反应体系里加入硅胶后甘油二酯含量明显降低,说明合成甘油二酯的平衡发生了逆向移动,分析可能的原因是____ ___ _。 实验3:研究不同催化剂的催化效果 曲线 催化剂 纵坐标 ① 脂肪酶I号 辛酸转化率 ② 脂肪酶II号 辛酸转化率 ③ 脂肪酶I号 甘油二酯含量 ④ 脂肪酶II号 甘油二酯含量 图1 (3)其他条件相同时,不同脂肪酶(I号、II号)催化合成甘油二酯的效果如图1所示,选择此实验中催化效果相对最佳的反应条件是________(填字母序号)。 A.12 h,I号 B.24 h,I号 C.12 h,II号 D.24 h,II号 实验4:研究温度对反应速率和产率的影响 图2 图3 (4)选定脂肪酶做催化剂,继续实验。 ①综合图2和图3,选择6 h时比较适宜的反应温度是________。 ②在6 h之后,辛酸的转化率总趋势缓慢上升,30℃、40℃甘油二酯的含量上升,但是50℃的却有所降低,分析可能的原因是___ _____。 4、氢能是一种极具发展潜力的清洁能源,CH4—H2O催化重整是目前大规模制取氢气的重要方法。 (1)CH4-H2O催化重整: 反应Ⅰ:CH4(g) + H2O(g) CO(g) + 3H2(g) △H1 = + 210 kJ·mol-1 反应Ⅱ: CO(g) + H2O(g) CO2(g) + H2(g) △H2 =﹣41 kJ·mol-1 ① 提高CH4平衡转化率的条件是 。 a.增大压强 b.加入催化剂 c.增大水蒸气浓度 ② CH4、H2O催化重整生成CO2、H2的热化学方程式是 。 ③ 在密闭容器中,将2.0 mol CO与8.0 mol H2O混合加热到800℃发生反应Ⅱ,达 到平衡时CO的转化率是80%,其平衡常数为 。 (2)实验发现,其他条件不变,相同时间内,向催化重整体系中投入一定量的CaO可 以明显提高H2的百分含量。做对比实验,结果如下图所示: ① 投入CaO时,H2百分含量增大的原因是: 。 ② 投入纳米CaO时,H2百分含量增大的原因是: 。 (3)反应中催化剂活性会因积炭反应而降低,相关数据如下表: 反应 Ⅰ Ⅱ ∆H(kJ· mol-1) +75 ﹣173 ① 研究发现,如果反应Ⅰ不发生积炭过程,则反应Ⅱ也不会发生积炭过程。因此,若保持催化剂的活性,应采取的条件是 。 ② 如果Ⅰ、Ⅱ均发生了积炭反应,通入过量水蒸气能有效清除积炭,反应的化学方程式是 。 5、Fe3O4呈黑色、有磁性,应用广泛。以Fe3O4为吸附剂去除水中含磷物质是一种新的除磷措施。 (1)检验Fe3O4中铁元素的价态:用盐酸溶解Fe3O4,取少量滴加 ,溶液变红;另取少量滴加K3[Fe(CN)6]溶液,产生蓝色沉淀。 (2)氧化—沉淀法制备Fe3O4 Ⅰ.向稀硫酸中加入过量铁粉,得到FeSO4溶液。空气中存在O2,由于 (用 离子方程式表示),可产生Fe3+。过量铁粉的作用是除去Fe3+。 Ⅱ.在N2保护下,向热NaOH溶液中加入FeSO4溶液,搅拌,得到Fe(OH)2浊液。 将NaNO3溶液滴入浊液中,充分反应得到Fe3O4。 ① 用湿润红色石蕊试纸检验产物, (填现象),证明生成了NH3。 ②。(将反应补充完整) (3)含磷各微粒在溶液中的物质的量分数与pH的关系如下图所示。 下列分析正确的是 。 a.KH2PO4的水溶液中:c(H+)>c(OH-) b.K2HPO4 溶液显碱性,原因是HPO42-的水解程度大于其电离程度 c.H3PO4是强电解质,在溶液中完全电离 (4)将Fe3O4加到KH2PO4溶液中,调节溶液pH。pH对吸附剂Fe3O4表面所带电荷的影响:pH <6.8,Fe3O4表面带正电荷;pH>6.8,Fe3O4表面带负电荷;pH=6.8,Fe3O4表面不带电荷。Fe3O4对含磷微粒的去除率随pH的变化如下。 ① pH=3时,吸附的主要微粒是 。 ② 与pH=5时相比,pH=9时的去除率明显 下降,原因是: 。 6、CO2的有效利用可以缓解温室效应和能源短缺问题。 (1)CO2的分子结构决定了其性质和用途。 ① CO2的电子式是 ,包含的化学键类型为 共价键(填“非极性”或“极性”)。 ② 在温度高于31.26 oC、压强高于7.29×106 Pa时,CO2处于超临界状态,称为超临界CO2流体,可用作萃取剂提取草药中的有效成分。与用有机溶剂萃取相比,超临界CO2萃取的优点有 (答出一点即可)。 (2) 中科院大连化学物理研究所的科研人员在新型纳米催化剂Na-Fe3O4和HMCM-22的表面将CO2转化为烷烃,其过程如下图。 ① 上图中CO2转化为CO的反应为: CO2(g) + H2(g) === CO(g) + H 2O(g) ΔH =﹢41 kJ/mol; 已知:2CO2(g) + 6H2(g) === C2H4(g) + 4H2O(g) ΔH =﹣128 kJ/mol。 则图中CO转化为C2H4的热化学方程式是 。 ② 按系统命名法,图中X的名称是 。 ③ 关于X与Y的说法正确的是 (填序号)。 a. 实验式相同 b. 都有4种一氯代物 c. 都易使酸性KMnO4溶液褪色 ④ 催化剂中Fe3O4的制备方法如下:将一定比例的FeCl3和FeCl2溶于盐酸,然后在60 oC下逐滴加入NaOH溶液至pH≈10,继续搅拌,得Fe3O4。该反应的离子方程式是 。 7、含SO2废气的治理可以变废为宝,使硫资源得以利用。 (1)按每年全国发电燃煤8亿吨,煤中含硫质量分数以2%计,若不经过脱硫处理,则会有_______亿吨SO2排放到大气中(假设S全部转化为SO2)。 (2)下列物质中,能吸收SO2的有_______(填序号)。 a. 氨水 b. 酸性KMnO4溶液 c. 生石灰 d. Na2CO3溶液 (3)某工厂采用(NH4)2SO3和NH4HSO3的混合溶液A吸收烟气中的SO2并制备 (NH4)2SO3·H2O,过程如下: 已知: 溶液(1 mol/L) (NH4)2SO3 NH4HSO3 pH(25℃) 8.0 4.6 ① “吸收”过程中,溶液中(NH4)2SO3和NH4HSO3物质的量之比变_____(填“大”或“小”)。 ② (NH4)2SO3溶液呈碱性的原因是 。 ③ 用不同的溶液A吸收SO2时,SO2吸收率和放空废气含NH3量的变化如下图。解释图中放空废气含NH3量增大的原因:随(NH4)2SO3和NH4HSO3的物质的量之比增大, 。 注:不同溶液A的体积相同,所含(NH4)2SO3和NH4HSO3的总物质的量相同 ④ “制备”过程中,溶液B中发生反应的化学方程式是 。 (4)检验产品(NH4)2SO3·H2O中含有少量的方法如下:取少量产品加水溶解, (将实验操作和现象补充完整)。 8、实验小组研究稀硝酸与铁粉的反应,进行如下实验: 向2.0 mL 0.5 mol·L− 1HNO3中加入过量铁粉,生成无色气体,遇空气不变色。 充分反应后,溶液几乎无色。 (1)N在元素周期表中的位置是________。 (2)经检验,反应后的溶液中含有NH4+,检验NH4+的实验方案是____ ____。 (3)实验中,生成NH4+的离子方程式是____ ____。 (4)若反应后溶液中含有2×10−5 mol NH4+, HNO3得到的电子的物质的量为n(e−),则n(e−)________1.6×10−4 mol(填“>”、“=”或“<”)。 9、直接排放含SO2的烟气会危害环境。利用工业废碱渣(主要成分Na2CO3)可 吸收烟气中的SO2并制备无水Na2SO3,其流程如图1。 图1 已知: H2SO3、HSO3−、SO32−在水溶液中的物质的量分数随pH的分布如图2, Na2SO3·7H2O 和Na2SO3的溶解度曲线如图3。 图2 图3 (1)Na2CO3溶液显碱性,用离子方程式解释其原因:_____ ___。 (2)吸收烟气 ① 为提高NaHSO3的产率,应控制吸收塔中的pH为________。 ② NaHSO3溶液中c(SO32−)>c(H2SO3),结合方程式解释其原因:_____ ___。 ③ 已知下列反应: SO2(g) + 2OH− (aq) == SO32− (aq) + H2O(l) ΔH1=−164.3 kJ·mol− 1 CO2(g) + 2OH− (aq) == CO32− (aq) + H2O(l) ΔH2=−109.4 kJ·mol− 1 2HSO3− (aq) == SO32− (aq) + SO2(g) + H2O(l) ΔH3=+34.0 kJ·mol− 1 吸收塔中Na2CO3溶液吸收SO2生成HSO3−的热化学方程式是____ ____。 ④ 吸收塔中的温度不宜过高,可能的原因是____ ____(写出1种即可)。 (3)制备无水Na2SO3 将中和塔中得到的Na2SO3溶液____ ____(填操作),过滤出的固体用无水乙醇洗涤、干燥,得无水Na2SO3固体。 10、随着人类社会的发展,氮氧化物的排放导致一系列环境问题。 反应1 反应2 (1)NO形成硝酸型酸雨的化学方程式为 。 (2)NO加速臭氧层被破坏,其反应过程如右图所示: ① NO的作用是 。 ②已知:O3(g) + O(g) === 2O2(g) ΔH = -143 kJ/mol 反应1:O3(g) + NO(g) === NO2(g) + O2(g) ΔH1 = -200.2 kJ/mol 反应2:热化学方程式为 。 (3)利用电解法处理高温空气中稀薄的NO(O2浓度约为NO浓度十倍),装置示意图如下,固体电解质可传导O2- ①阴极反应为 。 固体电解质 ②消除一定量的NO所消耗的电量远远大于理论计算 量,可能的原因是(不考虑物理因素) 。 ③通过更换电极表面的催化剂可明显改善这一状况,利用催化剂具有 性。 (4)利用FeSO4吸收尾气(主要含N2及少量NO、NO2)中的氮氧化物,实验流程示意图如下所示。已知:Fe2+(aq) + NO(g) Fe(NO)2+(aq)(棕色) △H < 0 FeSO4吸收液 尾气—→ a b c H2O ①当观察到 时,说明b中FeSO4溶液需要更换。 ②吸收液再生的处理措施是 。 ③若尾气体积为22.4L(标准状况),用0.1mol/L NaOH溶液滴定a中溶液,消耗NaOH体积为V L,尾气中NO2的体积分数为 。 11、联合国将2019年定为“国际化学元素周期表年”,2018年中国化学会制作了新版周期表,包含118种元素。回答下列问题: X (1)碳元素在周期表中的位置是 。 (2)将硅的元素符号填写在上述周期表相应的空格中。 (3)在上述周期表中,用实线画出周期表的上方边界。 (4)从原子结构角度解释碳化硅中碳元素显负价的原因 。 (5)第118号元素为Og(中文名“”,ào),下列说法不正确的是 。 a.Og是第七周期0族元素 b.Og原子的核外有118个电子 c.Og在同周期元素中非金属性最强 d.中子数为179的Og核素符号是 (6)已知X与Y是位于相邻周期的同主族元素。某温度下,X、Y的单质与H2化合生成气态氢化物的平衡常数分别为KX =9.7×1012、KY =5.6×107。Y是 (填元素符号),判断理由是 。 12、氮氧化物的存在会破坏地球环境,人们一直在积极探索改善大气质量的有效措施。 已知:N2(g)+O2(g)2NO(g) △H=+181.5 kJ·mol-1 (1)写出NO2转化为HNO3的化学方程式 。 (2)氮氧化物是形成臭氧层空洞、光化学烟雾、 (列举一种)等大气污染现象的物质之一。北京市为防治大气污染,采取的措施有 (写两点即可)。 (3)NOx在平流层使O3浓度减少,形成臭氧层空洞,其中一种反应机理可用下图表示, 写出其总反应的化学方程式 。 (4)某科研小组尝试利用固体表面催化工艺进行NO的分解。若用 、 、 和 分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如下图所示。从吸附到解吸的过程中,能量状态最低的是 (填字母序号)。 (5)温度为T1时,在容积为1L的恒容密闭容器中充入0.6mol的NO2,达平衡时c(O2)=0.2mol/L,仅发生反应:2NO2(g)2NO(g)+O2 (g)(△H>0)。实验测得: v正=v (NO2)消耗=k正c2(NO2),v逆=v(NO)消耗=2v(O2)消耗=k逆c2(NO) •c(O2),k正、k逆为速率常数,仅受温度影响。当温度改变为T2时,若k正=k逆,则T1 T2(填“>”或“<”),得出该结论的理由是 。 13、25 ℃时,将0.10 mol·L-1的NaOH溶液逐滴滴入20 mL 0.10 mol·L-1 CH3COOH溶液中,pH随滴入NaOH溶液体积的变化如下图所示。 5 10 15 20 0 4 7 12 V(NaOH)/mL pH ① ② ③ (1)点①存在的电离平衡是 。 (2)点②两溶液发生反应的离子方程式是 。 (3)点③溶液的pH 7(填“>”、“<”或“=”),此时c(Na+) c(CH3COO-)(填“>”、“<”或“=”)。 14、天然气是一种清洁能源,用途广泛。 (1)工业上可用焦炉煤气(主要成分为CO、CO2和H2)制备天然气。 已知:I. CO(g) + 3H2(g) = CH4(g) + H2O(g) △H1= -206 kJ/mol II. CO(g) + H2O(g) = H2(g) + CO2(g) △H2= -41 kJ/mol ① CO2转化为CH4的热化学方程式是: 。 ② 有利于提高反应I中 CO的平衡转化率的措施有: 。 a. 使用催化剂 b. 升高温度 c. 及时导出水蒸气 (2)甲烷可制成燃料电池,其装置如下图所示。 ① 电极b是 极(填“正”或“负”)。 ② a极的电极反应式是_______________。 CH4 H2O CO2 O2 电极a 电极b H+ 15、C1O2是常用的自来水消毒剂。 I.已知实验室可用亚氯酸钠固体与氯气反应制备ClO2:2NaClO2+C12 = 2C1O2+2NaCl, 装置如下图所示: NaClO2 气体 收集 装置 气体 吸收 装置 浓HCl MnO2 A B C D E (1)圆底烧瓶内发生反应的化学方程式是:_______ ___。 (2)已知常温常压下,ClO2和Cl2是气体,在下列溶剂中溶解性如下表所示: ClO2 Cl2 水 极易溶于水 溶 CCl4 难溶 溶 B、C、E装置中的试剂依次是 (填序号)。 a、NaOH溶液 b、浓硫酸 c、饱和食盐水 d、CCl4 e、饱和石灰水 II.使用C1O2在给自来水消毒的过程中会产生有害的副产物亚氯酸根(ClO2-),可用Fe2+将其去除。已知ClO2-与Fe2+在pH=5~7的条件下能快速反应,最终形成红褐色沉淀,而ClO2-则被还原成Cl-。 (3)Fe2+消除ClO2-的离子方程式为__ _____。 (4)实际向自来水中加入Fe2+的量要高于理论值,原因是(结合离子方程式解释) ____ ___。 参考答案 1、(1)FeCl2 (2)a b (3)2FeCl3 + mH2O Fe2(OH) mCl6-m + mHCl (4)阳极 Fe - 6e- + 8OH - === FeO42- + 4H2O (5)4FeO42-+10H2O === 4Fe(OH)3↓ + 3O2↑ + 8OH- (Fe2O3或水合物,合理正确给分) 2、(1)最外层电子数相同,都是5个 P原子比N原子多一个电子层,P的原子半径比N的大 (2)6 NO3- + 5CH3OH 3 N2 ↑ + CO32- + 4HCO3- + 8 H2O (3)其他条件不变时,温度升高,反硝化菌活性随之增强,对NO3-的降解(或反硝化作用)速率也加快 (4)①甲醇是反硝化反应的反应物(还原剂),其他条件不变时,增大反应物的浓度,反应速率加快 ② 5X10-5 3、(1)辛酸的量增加,会有更多的甘油三酯生成,导致产物中甘油二酯的产率降低 (2)甘油分子有3个羟基,故硅胶对甘油的吸附能力也较强,降低了体系中反应物甘油的浓度,从而使合成甘油二酯的酯化反应平衡逆向移动,降低了甘油二酯的含量 (3)A (4)①50℃ ②催化合成甘油二酯反应的脂肪酶,长时间处于高温下活性(选择性)下降,导致甘油二酯含量下降,副反应产物含量增加 4、(1)① c ② CH4(g) + 2H2O CO2(g) + 4H2(g) △H = +169 kJ· mol-1 ③ 1 (2)① CaO可吸收,c()减小,使生成的反应正向移动,百分含量增大 ② 纳米CaO颗粒小,表面积大,使反应速率加快 (3)① 降低温度、增大压强 ② C + H2O = CO + H2 5、(1)KSCN溶液 (2)I. II.①试纸变蓝 ② (3)ab (4)① ② pH = 5时,带正电荷,含磷的主要微粒是;pH = 9时,带负电 荷,含磷的主要微粒是。因此在pH = 9时,吸附剂和含磷的主要微粒之间 的静电排斥作用强于pH = 5时。 6、(1) ① 极性 ② 萃取剂与溶质更易分离或萃取剂更环保等 (2) ① 2CO(g) + 4H2(g) === C2H4(g) + 2H2O(g) ΔH =﹣210 kJ/mol ② 2-甲基丁烷 60℃ ③ b ④ Fe2+ + 2Fe3+ + 8OH﹣ ===== Fe3O4↓ + 4H2O 7、(1)0.32 (2)abcd (3) ① 小 ② 、都水解,前者程度更大,使溶液中c(OH-)>c(H+) ③ 溶液中c()和c(OH-)均增大,使 + H2O NH3·H2O + H+平衡向右移动,促使NH3逸出 ④ NH4HCO3 + NH4HSO3 === (NH4)2SO3·H2O↓ + CO2↑ (4)加过量盐酸,充分振荡,再加氯化钡溶液,有白色沉淀产生 8、(1)第二周期第ⅤA族(1分) (2)取少量溶液于试管中,加入浓NaOH溶液,加热,将湿润的红色石蕊试纸接近试管口,若试纸变蓝,则含有NH4+(2分) (3)4Fe + 10H+ + NO3− == 4Fe2+ + NH4+ + 3H2O(2分) (4)>(1分) 9、(1)CO32− + H2O OH− + HCO3−(1分) (2)① 4~5(1分) ② 溶液中,HSO3−存在:HSO3− H+ + SO32−和HSO3− + H2O H2SO3 + OH−,HSO3−的电离程度强于水解程度 ③ 2SO2(g) + CO32− (aq) + H2O(l) == 2HSO3−(aq) + CO2 (g) ΔH=− 88.9 kJ·mol− 1 ④ 防止SO2的溶解度下降;防止HSO3−受热分解;防止HSO3−的氧化速率加快等 (3)隔绝空气,加热浓缩至有大量固体析出,高于34℃过滤 10、(1)4NO + 3O2 + 2H2O ===4HNO3(合理答案给分,2分) (2)①催化剂(2分) ②NO2(g) + O(g) === NO(g) + O2(g)ΔH2= +57.2 kJ/mol(2分) (3)① 2NO +4e-== N2↑+ 2O2- (2分) ② 阴极发生副反应 O2+4e-== 2O2- (1分) ③ 选择(1分) (4)① C中溶液变棕色(1分) ② 加热棕色溶液(1分) ③ 0.15V (1分) 11、(1)第二周期第IVA族(1分) (2)(1分)(3)(1分) Si x (4)C、Si位于同一主族,从上到下随核电荷数递增,原子半径逐渐增大,原子核吸引电子的能力逐渐减弱,C、Si之间形成的共用电子对偏向C,所以碳元素显负价 (5)c、d (6)Br 理由:由KY < KX,可知Y的气态氢化物的稳定性弱于X,Y位于X的下方,为Br 12、(1)3NO2+H2O= 2HNO3+NO (2)雾霾、酸雨、温室效应等 光 NO 新能源汽车;汽车限行;推广使用清洁燃料;煤改电等 (3)2O3 3O2 (4)C (5)T2>T1 达到平衡状态时正逆反应速率相等,根据k正c2(NO2)=k逆c2(NO)•c(O2),且k正=k逆,可知c2(NO2)=c2(NO)•c(O2),T2时化学平衡常数K等于1,大于0.8,且该反应的正反应是吸热反应,说明升高温度平衡正向移动,所以 T2>T1 13、(1)CH3COOHCH3COO- + H+ (2)CH3COOH+OH-CH3COO-+H2O (3)> , > 14、(1) ① CO2(g)+4H2(g)CH4(g)+2H2O(g) △H= -165 kJ/mol ② c (2) ① 正 ② CH4-8e-+2H2OCO2+8H+ 15、I (1)MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O (2)cbd II (3)ClO2-+4Fe2++10H2O4Fe(OH)3↓+Cl-+8H+ (4) Fe2+易被水中溶解的氧气氧化,4Fe2++O2+10H2O4Fe(OH)3↓+8H+。查看更多