- 2021-07-06 发布 |
- 37.5 KB |
- 8页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【推荐】专题1-1-1 焓变 反应热-试题君之K三关2017-2018学年高二化学人教版
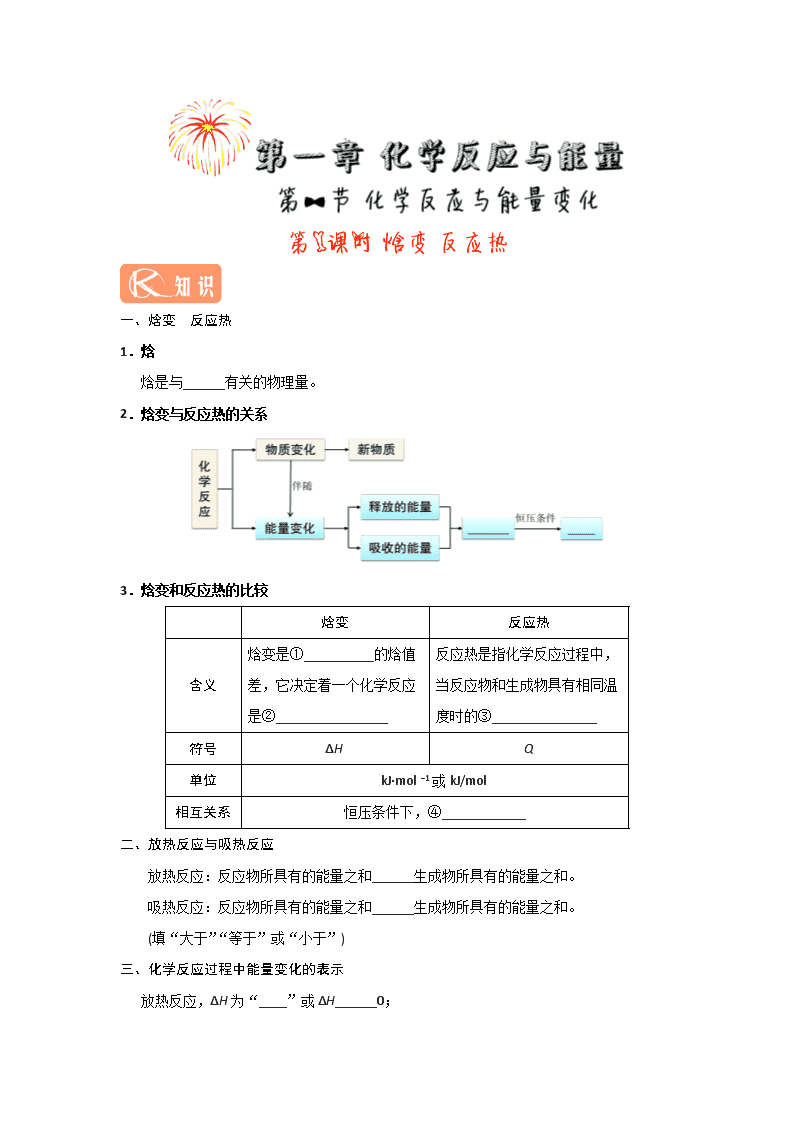
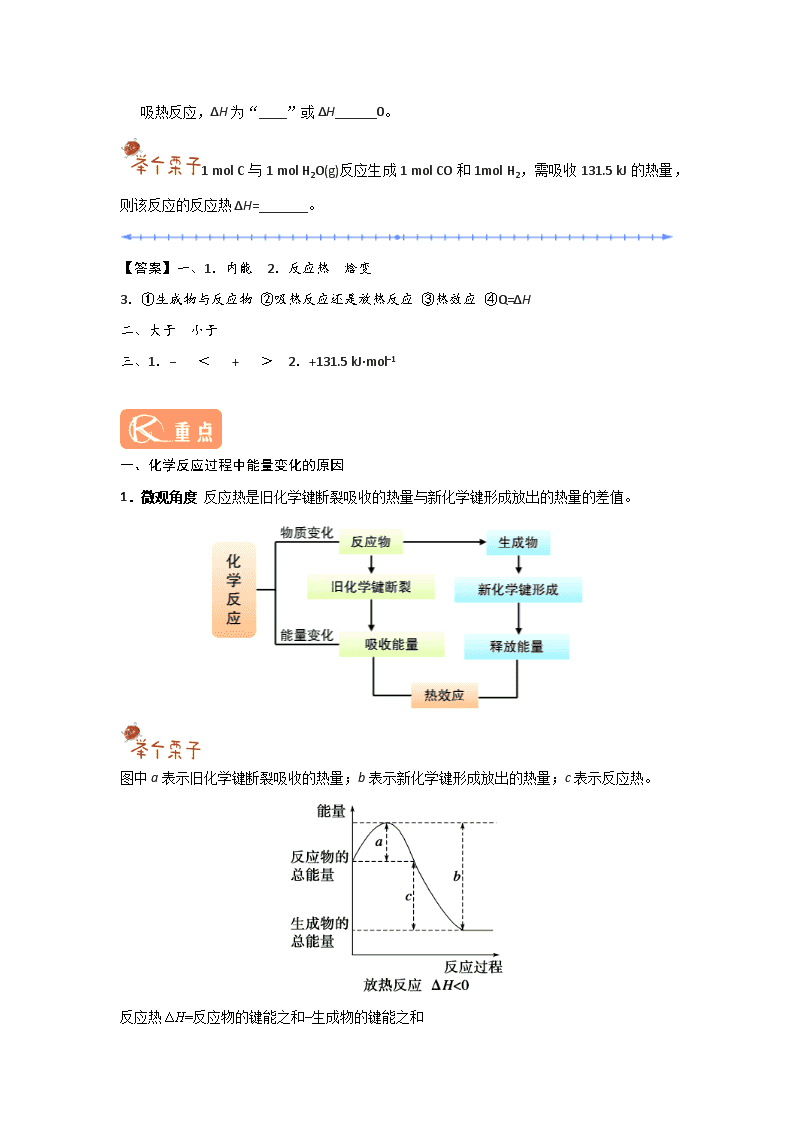
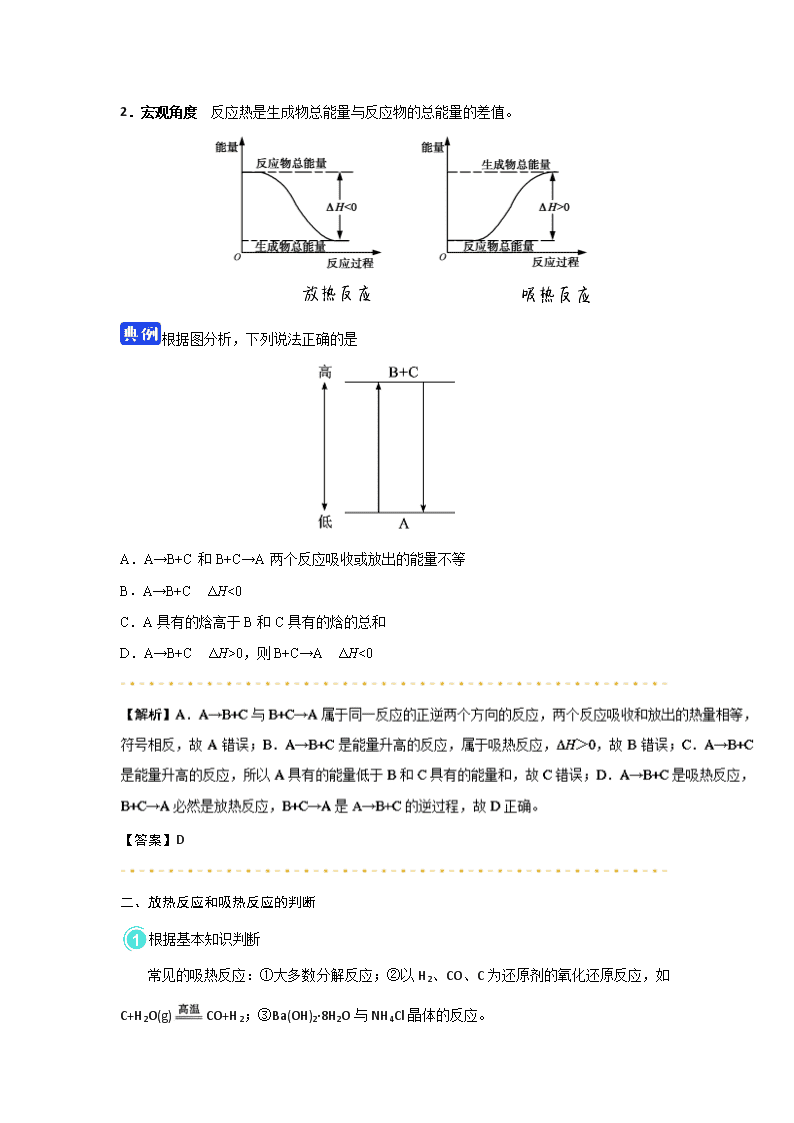
一、焓变 反应热 1.焓 焓是与______有关的物理量。 2.焓变与反应热的关系 3.焓变和反应热的比较 焓变 反应热 含义 焓变是①__________的焓值差,它决定着一个化学反应是②________________ 反应热是指化学反应过程中,当反应物和生成物具有相同温度时的③_______________ 符号 ΔH Q 单位 kJ·mol −1或kJ/mol 相互关系 恒压条件下,④____________ 二、放热反应与吸热反应 放热反应:反应物所具有的能量之和______生成物所具有的能量之和。 吸热反应:反应物所具有的能量之和______生成物所具有的能量之和。 (填“大于”“等于”或“小于”) 三、化学反应过程中能量变化的表示 放热反应,ΔH为“____”或ΔH______0; 吸热反应,ΔH为“____”或ΔH______0。 1 mol C与1 mol H2O(g)反应生成1 mol CO和1mol H2,需吸收131.5 kJ的热量,则该反应的反应热ΔH=_______。 【答案】一、1.内能 2.反应热 焓变 3.①生成物与反应物 ②吸热反应还是放热反应 ③热效应 ④Q=ΔH 二、大于 小于 三、1.− < + > 2.+131.5 kJ·mol−1 一、化学反应过程中能量变化的原因 1.微观角度 反应热是旧化学键断裂吸收的热量与新化学键形成放出的热量的差值。 图中a表示旧化学键断裂吸收的热量;b表示新化学键形成放出的热量;c表示反应热。 反应热ΔH=反应物的键能之和−生成物的键能之和 2.宏观角度 反应热是生成物总能量与反应物的总能量的差值。 根据图分析,下列说法正确的是 A.A→B+C和B+C→A两个反应吸收或放出的能量不等 B.A→B+C ΔH<0 C.A具有的焓高于B和C具有的焓的总和 D.A→B+C ΔH>0,则B+C→A ΔH<0 【答案】D 二、放热反应和吸热反应的判断 根据基本知识判断 常见的吸热反应:①大多数分解反应;②以H2、CO、C为还原剂的氧化还原反应,如C+H2O(g)CO+H2;③Ba(OH)2·8H2O与NH4Cl晶体的反应。 常见的放热反应:①金属与水或酸的反应;②酸碱中和反应;③大多数化合反应;④燃烧反应;⑤铝热反应;⑥营养物质在生物体内的氧化反应。 根据键能变化判断 当生成物分子成键释放的总能量>反应物分子断键吸收的总能量时,该反应表现为放热反应,即ΔH<0;当生成物分子成键释放的总能量<反应物分子断键吸收的总能量时,该反应表现为吸热反应,即ΔH>0。 根据图像判断 当反应物的总能量高于生成物的总能量时,为放热反应;当反应物的总能量低于生成物的总能量时,为吸热反应。 根据反应条件判断 反应开始需要加热,而停止加热后,反应亦可继续进行,则为放热反应;若反应需要持续不断地加热才能进行,则可能为吸热反应也可能为放热反应。 已知反应:A(g)+B(g)C(g)+D(g)的能量变化如图所示,下列说法正确的是 A.若此反应过程中有电子转移,可设计成原电池 B.该反应为吸热反应 C.反应物的总能量高于生成物的总能量 D.该反应只有在加热条件下才能进行 【答案】B (1)反应开始时需要加热的反应可能是吸热反应也可能是放热反应。有些吸热反应不但反应开始时需要加热,反应发生过程中仍需不断加热才能使反应继续进行下去;有的放热反应在反应开始时也需要加热,反应发生后会放出一定的热量,如果放出的热量可使反应维持下去,则反应过程中不需要再加热,否则也必须不断加热才能使反应继续进行下去。 (2)常温下就能进行的反应不一定都是放热反应,如氢氧化钡和氯化铵的反应。 (3)任何化学反应都伴随着能量变化,但能量变化不一定都表现为热量变化,还可能以声、光、电等形式表现出来。 (4)放出热量(或吸收热量)的物质变化过程不一定是放热反应(或吸热反应),如水蒸气冷凝为水放热,干冰升华吸热,它们不是放热反应或吸热反应,而是物理变化过程。 1.下列对化学反应的认识中错误的是 A.有化学键破坏的一定是化学反应 B.会产生新的物质 C.可能会引起物质状态的变化 D.一定伴随着能量的变化 2.下列说法中正确的是 A.吸热反应一定需要加热才能发生 B.放热反应在常温下一定很容易发生 C.反应是放热还是吸热取决于反应物和生成物所具有的总能量的相对大小 D.放热反应比吸热反应更容易发生 3.下列过程中ΔH<0的是 A.氯酸钾分解制备氧气 B.氯化铵加热制备氨 C.氢气还原氧化铜 D.实验室制备氢气 4.在相同条件下,下列两个反应放出的热量分别用ΔH1和ΔH2表示:2H2(g)+O2(g)2H2O(g) ΔH1;2H2(g)+O2(g)2H2O(1) ΔH2。则 A.ΔH2>ΔH1 B.ΔH1>ΔH2 C.ΔH1=ΔH2 D.无法确定 5.下列属于放热反应的是 A.Al+HCl(稀) B.Ba(OH)2·8H2O+NH4Cl(固体) C.KClO3受热分解 D.CaCO3受热分解 6.下列图示变化为吸热反应的是 A B C D 7.下表中的数据是破坏1 mol物质中的化学键所消耗的能量(kJ): 物质 Cl2 Br2 I2 H2 HCl HI HBr 键能/(kJ·mol−1) 243 193 151 436 431 298 366 根据上述数据回答下列问题。 (1)下列物质本身具有的能量最低的是 。 A.H2 B.Cl2 C.Br2 D.I2 (2)下列氢化物中最不稳定的是 。 A.HCl B.HBr C.HI (3)X2+H22HX(X代表Cl、Br、I)的反应是 (填“吸热”或“放热”)反应。 1.【答案】A 2.【答案】C 【解析】化学反应的能量变化主要表现为放热或吸热,反应放热还是吸热主要取决于反应物和生成物所具有的总能量的相对大小。大多数吸热反应在反应过程中需要持续加热,但也有少数例外,如Ba(OH)2·8H2O与固体NH4Cl的反应是吸热反应,但不需要加热;有的放热反应开始时需要加热,反应后会放出一定的热量,如果此热量足够多,可使反应维持下去,则反应过程不需要再加热,如煤的燃烧,一旦加热使煤燃烧起来后就可以继续燃烧下去,不需再加热。 3.【答案】D 4.【答案】B 【解析】气态水液化时要释放能量。 5.【答案】A 【解析】金属与酸的反应及大多数化合反应是放热反应,NH4Cl和Ba(OH)2·8H2O的反应和大多数分解反应是吸热反应。 6.【答案】A 【解析】A项,反应物的能量小于生成物的能量,图示反应为吸热反应,符合题意; B项,反应物的能量大于生成物的能量,反应为放热反应,不符合题意;C项,浓硫酸稀释放热,且不是化学反应,不符合题意;D项,活泼金属与酸的反应是放热反应,不符合题意。 7.【答案】(1)A (2) C (3)放热 【解析】破坏1 mol物质的化学键时所消耗的能量与相同条件下形成1 mol该物质的化学键放出的能量相 等,放出的能量越多,物质本身具有的能量越低,物质越稳定。 (1)生成1 mol H2时放出的能量最多,为436 kJ,则物质本身具有的能量最低的是H2。 (2)在氢化物中,生成1 mol HI时放出的能量最少,为298 kJ,则为最不稳定的物质。 (3)1 mol Cl2、Br2、I2化学键断裂吸收的能量分别为:243 kJ、193 kJ、151 kJ,与H2形成2 mol HCl、2 mol HBr、2 mol HI,放出的能量分别为:862 kJ、732 kJ、596 kJ,则反应热=反应物断键吸收的能量−生成物化学键形成释放的能量,依次为:−183 kJ、−103 kJ和−9 kJ。则均为放热反应。 查看更多