- 2021-07-06 发布 |
- 37.5 KB |
- 6页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020学年高二化学人教版选修4练习 (1)
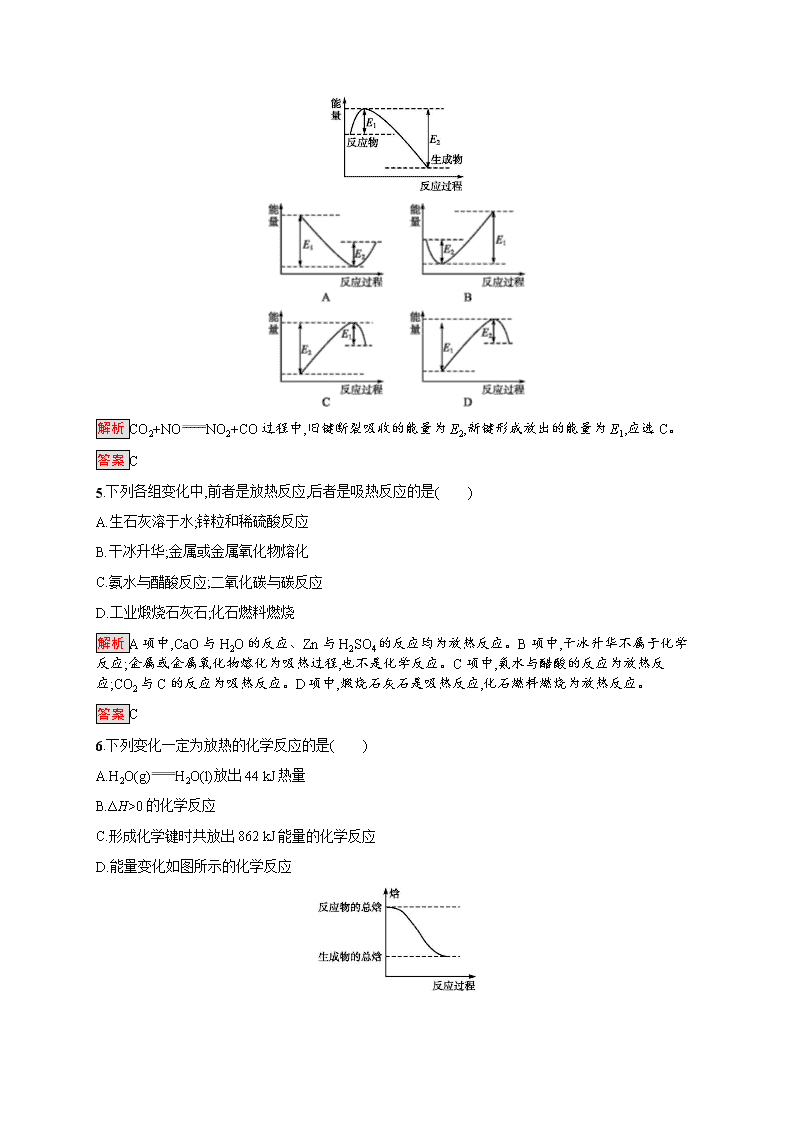
第1课时 焓变 反应热 课后篇巩固提升 基础巩固 1.右图是一个一次性加热杯的示意图。当水袋破裂时,水与固体碎块混合,杯内食物温度逐渐上升。制造此加热杯可选用的固体碎块是( ) A.硝酸铵 B.生石灰 C.氯化镁 D.食盐 解析 生石灰与水反应放出大量的热。 答案 B 2.下列过程中,需要吸收能量的是( ) A.钠与水的反应 B.H+ClHCl C.I2I+I D.S+O2SO2 解析 A中钠与水的反应是放热反应;B中氢原子与氯原子结合生成 HCl分子时,有化学键形成,要放出热量;C项中有化学键的断裂,需要吸收能量;D中S与O2 的反应是放热反应。 答案 C 3.下列说法正确的是( ) A.反应热是1 mol物质参加反应时的能量变化 B.当反应放热时,ΔH>0;反应吸热时,ΔH<0 C.任何条件下,化学反应的焓变都等于化学反应的反应热 D.在一定条件下,某一化学反应是吸热反应还是放热反应,由生成物与反应物的焓的差值来决定 解析 一定量的物质在恒压条件下反应所释放或吸收的热量称为反应热,A项错误。当反应放热时,ΔH<0;反应吸热时,ΔH>0,B项错误。只有在恒压条件下,化学反应的焓变才等于化学反应的反应热,C项错误。一个化学反应是吸热反应还是放热反应,取决于生成物和反应物的焓的差值,D项正确。 答案 D 4.下图所示的是1 mol NO2与足量的CO完全反应生成CO2和NO过程中的能量变化。A、B、C、D四个图像中能够表示出CO2+NONO2+CO的能量变化示意图的是( ) 解析 CO2+NONO2+CO过程中,旧键断裂吸收的能量为E2,新键形成放出的能量为E1,应选C。 答案 C 5.下列各组变化中,前者是放热反应,后者是吸热反应的是( ) A.生石灰溶于水;锌粒和稀硫酸反应 B.干冰升华;金属或金属氧化物熔化 C.氨水与醋酸反应;二氧化碳与碳反应 D.工业煅烧石灰石;化石燃料燃烧 解析 A项中,CaO与H2O的反应、Zn与H2SO4的反应均为放热反应。B项中,干冰升华不属于化学反应;金属或金属氧化物熔化为吸热过程,也不是化学反应。C项中,氨水与醋酸的反应为放热反应;CO2与C的反应为吸热反应。D项中,煅烧石灰石是吸热反应,化石燃料燃烧为放热反应。 答案 C 6.下列变化一定为放热的化学反应的是( ) A.H2O(g)H2O(l)放出44 kJ热量 B.ΔH>0的化学反应 C.形成化学键时共放出862 kJ能量的化学反应 D.能量变化如图所示的化学反应 解析 化学反应放热还是吸热,取决于焓(生成物)与焓(反应物)的相对大小。若焓(生成物)>焓(反应物),则反应吸热,反之放热。A项H2O(g)H2O(l)为物理变化;B项ΔH>0,即焓(生成物)>焓(反应物),反应吸收热量;C项无法确定反应放热还是吸热;D项,由图可知焓(生成物)<焓(反应物),反应放热。 答案 D 7.已知:①能量越低的物质就越稳定;②白磷转化成红磷是放热反应。据此分析下列判断或说法中正确的是( ) A.在相同的条件下,红磷比白磷能量高 B.在相同的条件下,白磷比红磷稳定 C.红磷和白磷的结构不同 D.红磷容易发生自燃而白磷则不会自燃 解析 白磷转化成红磷是放热反应,故白磷的能量比红磷的高。能量越高,物质越不稳定,则A、B、D三项都不正确。 答案 C 8.肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N键为942、OO键为500、N—N键为154,则断裂1 mol N—H键所需的能量(kJ)是( ) A.194 B.391 C.516 D.658 解析 由图知N2H4(g)+O2(g)N2(g)+2H2O(g) ΔH=-534 kJ·mol-1,可设断裂1 mol N—H键所需的能量为x,154 kJ+4x+500 kJ-2 752 kJ=-534 kJ,可求得x=391 kJ。 答案 B 9.在一定条件下,A和B反应可生成C和D,其能量变化如下: (1)下列关于反应A+BC+D的说法正确的是 。 A.反应前后原子的种类和数目一定不变 B.该反应若有热量变化,则一定是氧化还原反应 C.若该反应为放热反应,则不需要加热就一定能进行 D.反应物的总质量与生成物的总质量一定相等,且该反应遵循能量守恒 (2)若E1查看更多