- 2021-07-06 发布 |
- 37.5 KB |
- 13页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年河南省郑州市高二下学期期末考试化学试题(Word版)
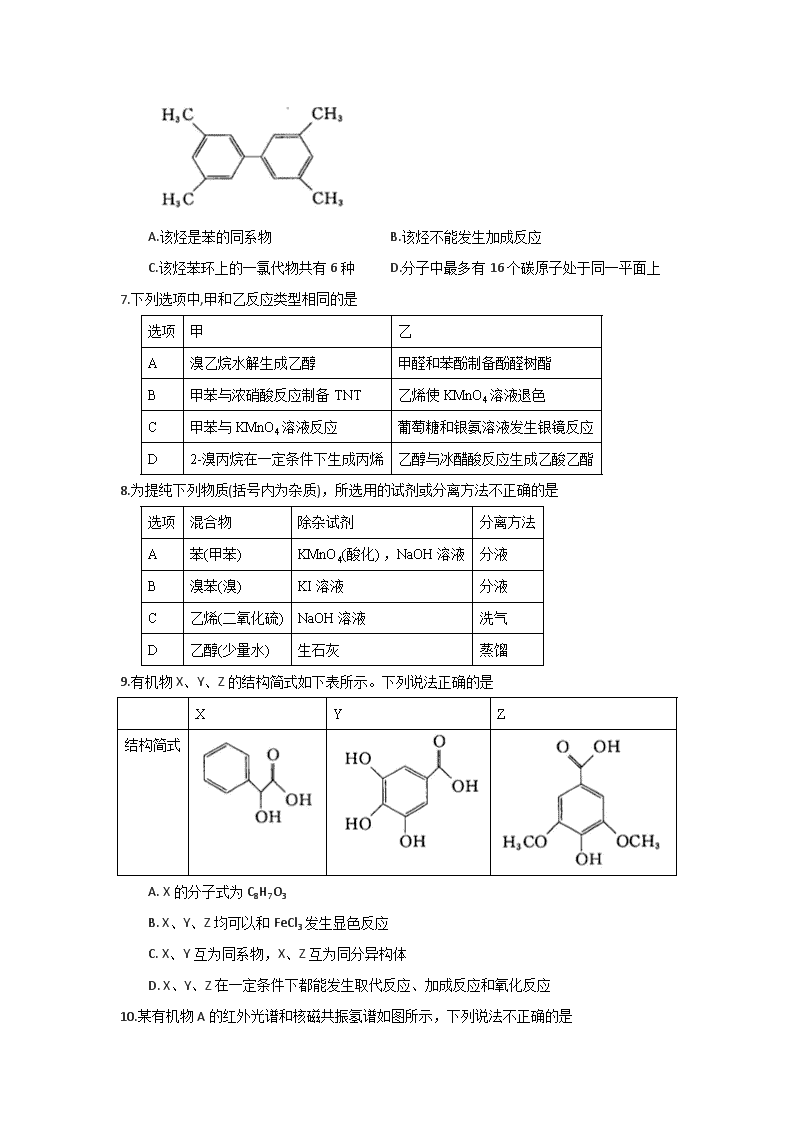
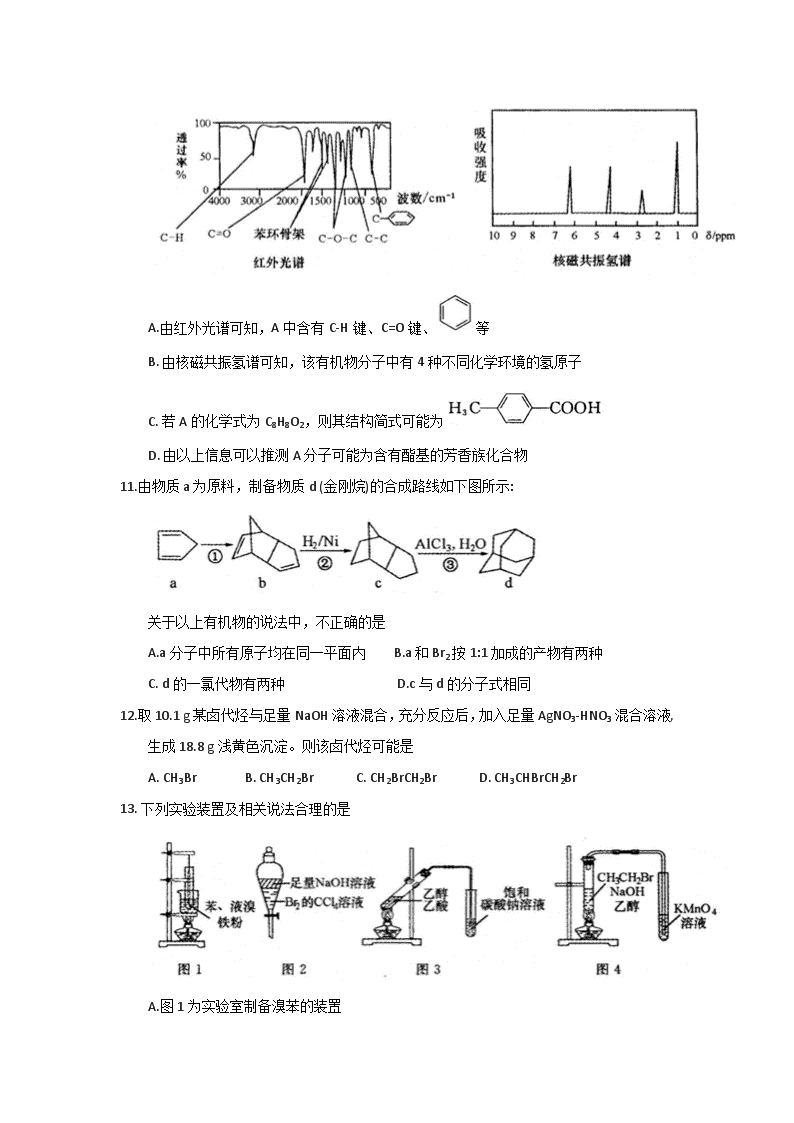
河南省郑州市2017—2018学年高二下学期期末考试 化学试题 相对原子质量:H-1 C-12 N--14 O-16 Na-23 Mg-24 Cl-35.5 Br-80 Ag-108 选择题 共48分 选择题(本题共16小题,每题只有一个选项符合题意,每小题3分,共48分) 1.下列有关生活中常见有机物的叙述正确的是 ①多次咀嚼馒头有甜味,此过程中淀粉发生了水解反应 ②肥皂的主要成分属于高级脂肪酸盐 ③糖类物质均不能使溴水和酸性KMnO4溶液褪色 ④天然蛋白质水解的最终产物均为a-氨基酸 A.①②③ B.①②④ C.②③④ D.①③④ 2.下列化学用语使用不正确的是 A.羟基的电子式: B.聚丙烯的结构简式: C.乙酸的实验式:CH2O D.乙烯的结构简式:CH2=CH2 3.下列各组物质中,全部属于纯净物的是 A.福尔马林、酒、醋 B.苯、汽油、无水酒精 C.甘油、乙醇钠、氯仿 D.豆油、丙烯酸、四氯化碳 4.唐·段成式《西阳杂俎·物异》中记载:“石漆,高奴县石脂水,其浮水上,如漆。采以膏车,极迅;燃灯,极明。”这里的“石漆”是指 A.石油 B.油漆 C.煤焦油 D.油脂 5.二甘醇可用作溶剂、纺织助剂等,一旦进入人体会导致急性肾衰竭,危及生命。二甘醇的结构简式是HO--CH2CH2--O--CH2CH2--OH。下列有关二甘醇的叙述正确的是 A.二甘醇的沸点比乙醇低 B.能溶于水,不溶于乙醇 C.1 mol二甘醇和足量Na反应生成1 mol H2 D.二甘醇在NaOH的乙醇溶液中加热能发生消去反应 6.某烃的结构简式如右图,下列说法中正确的是 A.该烃是苯的同系物 B.该烃不能发生加成反应 C.该烃苯环上的一氯代物共有6种 D.分子中最多有16个碳原子处于同一平面上 7.下列选项中,甲和乙反应类型相同的是 选项 甲 乙 A 溴乙烷水解生成乙醇 甲醛和苯酚制备酚醛树酯 B 甲苯与浓硝酸反应制备TNT 乙烯使KMnO4溶液退色 C 甲苯与KMnO4溶液反应 葡萄糖和银氨溶液发生银镜反应 D 2-溴丙烷在一定条件下生成丙烯 乙醇与冰醋酸反应生成乙酸乙酯 8.为提纯下列物质(括号内为杂质),所选用的试剂或分离方法不正确的是 选项 混合物 除杂试剂 分离方法 A 苯(甲苯) KMnO4(酸化) ,NaOH溶液 分液 B 溴苯(溴) KI溶液 分液 C 乙烯(二氧化硫) NaOH溶液 洗气 D 乙醇(少量水) 生石灰 蒸馏 9.有机物X、Y、Z的结构简式如下表所示。下列说法正确的是 X Y Z 结构简式 A. X的分子式为C8H7O3 B. X、Y、Z均可以和FeCl3发生显色反应 C. X、Y互为同系物,X、Z互为同分异构体 D. X、Y、Z在一定条件下都能发生取代反应、加成反应和氧化反应 10.某有机物A的红外光谱和核磁共振氢谱如图所示,下列说法不正确的是 A.由红外光谱可知,A中含有C-H键、C=O键、等 B. 由核磁共振氢谱可知,该有机物分子中有4种不同化学环境的氢原子 C. 若A的化学式为C8H8O2,则其结构简式可能为 D. 由以上信息可以推测A分子可能为含有酯基的芳香族化合物 11.由物质a为原料,制备物质d (金刚烷)的合成路线如下图所示: 关于以上有机物的说法中,不正确的是 A.a分子中所有原子均在同一平面内 B.a和Br2按1:1加成的产物有两种 C. d的一氯代物有两种 D.c与d的分子式相同 12.取10.1 g某卤代烃与足量NaOH溶液混合,充分反应后,加入足量AgNO3-HNO3混合溶液,生成18.8 g浅黄色沉淀。则该卤代烃可能是 A. CH3Br B. CH3CH2Br C. CH2BrCH2Br D. CH3CHBrCH2Br 13. 下列实验装置及相关说法合理的是 A.图1为实验室制备溴苯的装置 B.图2中充分振荡后下层为无色 C.用图3所示的实验装置制备乙酸乙酯 D.图4装置中KMnO4溶液退色可证明CH3CH2Br发生了消去反应 14.分子式为C5H12O、且含有2个甲基的醇与分子式为C5H10O2的酸发生酯化反应,得到酯的结构可能有(不包括立体异构) A.8种 B.16种 C.24种 D.32种 15.下列基团中: -CH3、-OH、-COOH、,任意取两种不同基团结合,组成的有机物最多有 A.3种 B.4种 C.5种 D.6种 16. K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+ H2O2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验: 结合实验,下列说法正确的是 A.①中溶液变黄,③中溶液橙色加深 B. ②中Cr2O72-被C2H5OH氧化 C. K2Cr2O7在碱性条件下的氧化性比酸性条件更强 D. 若向④中加入70%H2SO4溶液至过量,溶液变为绿色 非选择题 共52分 必做题(本题包括2小题,共20分) 17. (10分)请按要求填空(化学方程式需注明反应条件): (1) 的系统名法名称是___________。 (2)反-2-丁烯的结构简式___________ 。 (3)分子式为C8H11N的有机物,含有苯环和—NH2结构的同分异构体有_________种。 (4)乙酸乙酯在酸性条件下水解的化学方程式____________ 。 (5)苯乙烯和1,3-丁二烯在一定条件下共聚合成丁苯橡胶的化学方程式___________。 18.(10分)苯乙酸铜是合成纳米氧化铜的重要前驱体之一,可采用苯乙腈()为原料在实验室进行合成。制备苯乙酸的装置如右图(加热和夹持仪器略去)。已知苯乙酸的熔点为76.5℃,微溶于冷水,易溶于乙醇。 在250 mL三口瓶A中加入70 mL质量分数为70%的硫酸和几片碎瓷片,加热至100℃,再缓缓滴入46.8 g苯乙腈,然后升温至130℃,发生反应: +2H2O+ H2SO4 + NH4HSO4 请回答: (1)甲同学提出为使反应物受热均匀,可以采取水浴加热。老师否定了这个建议,原因是_______。 (2)乙同学提出装置中缺少温度计,温度计水银球的合理位置是_______。 (3)本实验采用了滴液漏斗。与普通分液漏斗相比,滴液漏斗的优点是_______。 (4)反应结束后需先加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是_______,分离出苯乙酸的操作是_______。 (5)提纯粗苯乙酸最终得到19 g纯品,则苯乙酸的产率是_____%(结果保留整数)。 (6)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后加入Cu(OH)2,搅拌30 min,过滤。滤液静置一段时间可以析出苯乙酸铜晶体。此步骤中用到乙醇的作用是______ ;写出此步发生反应的化学方程式_______。 选做题(以下选做题分为A、B两组,每组试题均包括3个小题,共32分。每位考生只能选做其中的一组,如果多选,按第一组计分。) A组——[选修3:物质结构与性质](32分) A-19. (10分) A、B、C、D、E、G六种元素均为前四周期元素,原子序数依次增大。A原子核外的L层电子数是K层的两倍;C原子核外的最外层中只有两对成对电子,D在元素周期表的各元素中电负性最大,E和C同主族,G是前四周期元素中基态原子未成对电子数最多的元素。 请回答下列问题: (1)A、B、C的第一电离能从小到大的顺序为_______。(用元素符号表示) (2)AC2与EC2分子的空间构型分别是_______和_______。相同条件下EC2在水中的溶解度比AC2更大,理由是_______。 (3)用氢键表示式写出D的氢化物在水溶液中存在的任意一种氢键_______。 (4)G的价电子排布式为_______;G 与CO形成的配合物G(CO)6中,1 mol G(CO)6中含有的σ键数目为_________。 (5)和G同周期的铁元素,其单质及其化合物应用广泛。 ①某有机铁肥[Fe(H2NCONH2)6] (NO3)3的名称叫三硝酸六尿素合铁,是一种配合物。该配合物中所含的阴离子的空间构型为_____ ,写出一个与该阴离子互为等电子体的分子________。 ②氯化亚铁的熔点为674℃,而氯化铁的熔点仅为282℃,二者熔点存在差异的主要原因是________。 A--20. (10分) 在元素周期表中,非金属元素集中于右上角的位置,它们虽然种类少,但其用途却不容小觑。 (1)元素周期表的非金属元素中,属于主族元素的共有________种。 (2)红磷是巨型共价分子、无定型结构。能证明红磷是非晶体的最可靠方法是________。 A.质谱 B.原子发射光谱 C.核磁共振谱 D.X 射线衍射 (3)成语“信口雕黄”中的雌黄分子式为As2S3,分子结构如右图。 其分子中S原子的杂化方式为________。雌黄和SnCl2在盐酸中反应转化为雄黄(As4S4)和SnCl4并放出H2S气体,写出该反应的化学方程式______。 (4)已知pKa=-lgKa。 ①有机酸的酸性强弱受邻近碳上取代原子的影响,如酸性: BrCH2COOH >CH3COOH。据此推测,pKa:ClCH2COOH______FCH2COOH(填“>”、“<”、“=”)。 ②硼酸(H3BO3)是一元酸,它在水中表现出来的弱酸性,并不是自身电离出H+所致,而是H3BO3与水电离出的OH-结合生成一个酸根离子,请写出该酸根离子的结构简式: ________(若存在配位键,请用箭头标出)。 (5)磷化硼的晶胞模型如右图所示,晶胞参数为a pm,已知B、P的原子半径分别表示为rBpm、rP pm。该晶胞中磷原子的配位数为________,晶体中原子的空间利用率为______ 。 A-21. (12分) 离子晶体是常见的晶体类型。请回答以下问题: (1)离子晶体中阴阳离子半径之比是决定晶体构型的重要因素之一,配位数与离子半径之比存在如下关系: 已知在某AB型离子化合物中,A+离子的半径为84 pm,B-离子的半径为140 pm。分析以上信息,与A+离子配位的所有B-离子,在空间构成的立体形状为_______。 (2)硫化亚铜和氧化亚铜均为离子晶体,其中熔点较高的为________ (填化学式),原因是________。 (3)向疏酸铜溶液中加入乙二胺(H2N-CH2-CH2-NH2)溶液后,每个Cu2+可与两个乙二胺分子形成四配位离子,导致溶液由蓝色变为紫色。该四配位离子的结构式为_______。 (4)K3C60是由足球烯(C60)与金属钾反应生成的盐。在K3C60晶胞中,C603-堆积方式为面心立方结构,每个晶胞中形成4个八面体空隙和8个四面体空隙,K+填充在空隙中。晶胞中被K+占据的空隙百分比为__________。 (5)H和Mg能形成一种离子型储氢材料,晶体结构如右图所示: 则该晶体中Mg的配位数是______,其化学式为________。已知该晶体的密度为ρg·cm-3,晶胞的体积为__________(用ρ、NA表示,其中NA表示阿伏加德罗常数的值)。 B组- [选修5:有机化学基础](32分) B- 19.(10分) 小明同学为研究有机物A和B的结构和性质,分别取7.4gA和6.0gB置于密闭容器中完全燃烧,测得有关数据如下: 由以上信息可求出: (1)A物质的分子式为______。 已知A和金属Na不反应,则其可能的结构有______种。 (2)B物质的最简式为_______。 所有符合该最简式的物质中,相对分子质量最小的物质与酸性高锰酸钾反应的离子方程式为______ 。 (3)相同条件下,相同质量B物质的蒸气所占体积为H2体积的1/30,且B可以发生银镜反应,但不能发生水解反应。写出其结构简式______ 。 (4)若B分子中有3个碳原子,能与NaHCO3反应产生CO2气体,且等效氢的个数比为3:1:1:1,则该物质的系统命名法名称为______ 。 (5)若符合B物质最简式的某物质是生命体中重要的能量物质,在一定条件下可以转化为乙醇,写出该转化反应的化学方程式______。 B- 20. (10分) 已知某有机物A有如下的转化关系: 请结合上述转化关系回答问题: (1)A的结构简式为_____;M是比A少一个 CH2原子团的芳香族化合物,能发生银镜反应,且M在所有的同分异构体中核磁共振氢谱信号种类最少,则M的结构简式为_______。 (2)A→B的反应类型为_______。 (3)B→C的化学方程式为_______。 (4)C→E的化学方程式为_______ 。 (5)D、F的结构简式分别为_______、_______。 B- -21.(12分) 化合物H是一种有机光电材料中间体。实验室由芳香族化合物A制备H的一种合成路线如下: 已知: ①RCHO+CH3CHORCH=CHCHO+H2O ② 回答下列问题: (1) 1 mol A完全加成时最多可消耗H2______mol;E的结构简式是_______ 。 (2)F分子中包含的官能团名称是______;D→E的反应类型是______ 。 (3)写出由F生成H的化学方程式_______ 。 (4)芳香族化合物X是F的同分异构体,X能与饱和碳酸氢钠容液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6:2:1:1,则符合要求的X的结构简式有______种。 (5)结合本题信息,仿照上述合成路线,设计由和丙醛合成的流程图:______ (无机试剂任选)。 1.B 2.B 3.C 4.A 5.C 6.D 7.C 8.B 9.D 10.C 11.A 12.D 13.B 14.B 15.C 16.D 17.(10分) (1)2,3-二甲基-1-戊烯 (2分)(2) (2分)(3)14(2分) (4) CH3COOCH2CH3+H2OCH3COOH+CH3CH2OH(2分) (5)(2分) 18.(10分)(1)水浴加热的温度达不到130℃(1分) (2)放在反应混合液中,但不能接触烧瓶内壁(1分) (3)三口瓶和滴液漏斗中气压相通,液体能顺利滴下。(1分) (4)降低温度,减小苯乙酸的溶解度,便于苯乙酸析出(1分)过滤(1分) (5)35(2分) (6)促进苯乙酸的溶解,以利于苯乙酸充分反应(1分) (2分) A-19.(10分) (1)C查看更多