- 2021-07-06 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届二轮复习“7+1”小卷练7(全国通用)
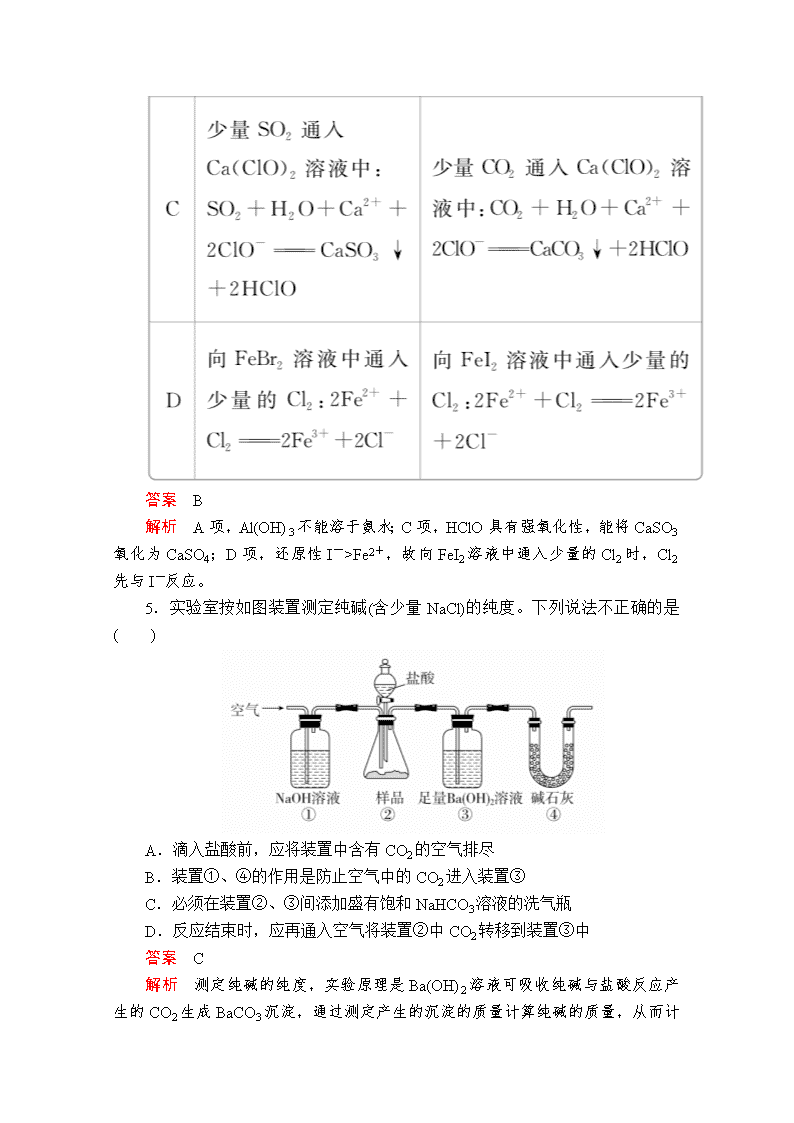
“7+1”小卷练7 1.化学与生产、生活及环境密切相关,下列有关说法正确的是( ) A.有人称“一带一路”是“现代丝绸之路”,丝绸的主要成分是纤维素,属于天然高分子化合物 B.中国古代利用明矾溶液的酸性清洗铜镜表面的铜锈 C.汽车尾气污染物中含有的氮氧化物是汽油不完全燃烧造成的 D.用于光缆通信的光导纤维和制作航天服的聚酯纤维都是新型无机非金属材料 答案 B 解析 丝绸的主要成分是蛋白质,A错误;明矾溶液因Al3+水解而呈酸性,铜锈的主要成分为Cu2(OH)2CO3,其可溶于酸性溶液,故可利用明矾溶液的酸性清洗铜镜表面的铜锈,B正确;汽车尾气污染物中含有的氮氧化物是氮气和氧气在汽车发动机汽缸内发生反应造成的,而不是汽油不完全燃烧造成的,C错误;聚酯纤维不属于新型无机非金属材料,D错误。 2.有机物甲的发光原理如下: 关于有机物甲和有机物乙的说法正确的是( ) A.互为同分异构体 B.均可发生加成反应 C.均可与碳酸氢钠溶液反应 D.均最多有7个碳原子共平面 答案 B 解析 根据有机物甲和有机物乙的结构简式可知,两者分子式不同,故不互为同分异构体,A错误;有机物甲和有机物乙中均含有苯环、碳碳双键,均可以发生加成反应,B正确;有机物甲中含有羧基,其能与碳酸氢钠溶液反应,有机物乙不能与碳酸氢钠溶液反应,C错误;有机物甲和有机物乙中均至少有9个碳原子共平面,D错误。 3.设NA为阿伏加德罗常数的值。下列说法正确的是( ) A.常温下,pH=1的盐酸中,由水电离出的H+数目为10-13NA B.1 mol金属钠与氧气完全反应,转移的电子数一定为NA C.标准状况下,11.2 L乙烯和丙烯的混合气体中含C—H键的数目为2.5NA D.用铂电极电解100 mL 1 mol·L-1的CuSO4溶液足够长时间,转移电子数一定为0.2NA 答案 B 解析 A项,常温下,pH=1的盐酸中,由水电离出的H+浓度为10-13 mol·L-1,但缺少溶液的体积,不能计算出由水电离出的H+的个数,错误;B项,1 mol金属钠与氧气完全反应,Na转化为Na+,转移的电子数一定为NA,正确;C项,1个乙烯分子含有4个C—H键,1个丙烯分子含有6个C—H键,标准状况下,11.2 L乙烯和丙烯的混合气体的物质的量为0.5 mol,但二者各自物质的量不能确定,故无法计算混合气体中C—H键的数目,错误;D项,用铂电极电解100 mL 1 mol·L-1的CuSO4溶液足够长时间,溶剂水也可能会被电解,转移电子数不一定为0.2NA,错误。 4.下列四个选项中的两个离子方程式都正确的是( ) 答案 B 解析 A项,Al(OH)3不能溶于氨水;C项,HClO具有强氧化性,能将CaSO3氧化为CaSO4;D项,还原性I->Fe2+,故向FeI2溶液中通入少量的Cl2时,Cl2先与I-反应。 5.实验室按如图装置测定纯碱(含少量NaCl)的纯度。下列说法不正确的是( ) A.滴入盐酸前,应将装置中含有CO2的空气排尽 B.装置①、④的作用是防止空气中的CO2进入装置③ C.必须在装置②、③间添加盛有饱和NaHCO3溶液的洗气瓶 D.反应结束时,应再通入空气将装置②中CO2转移到装置③中 答案 C 解析 测定纯碱的纯度,实验原理是Ba(OH)2溶液可吸收纯碱与盐酸反应产生的CO2生成BaCO3 沉淀,通过测定产生的沉淀的质量计算纯碱的质量,从而计算纯碱的纯度。由于装置内空气中含有的CO2对测定结果有影响,因此滴入盐酸前,应将装置中含有CO2的空气排尽,A正确;空气中含有的CO2对测定结果有影响,装置①、④可以吸收空气中的CO2,防止空气中的CO2进入装置③,B正确;由于盐酸容易挥发,装置②中产生的CO2中含有HCl,但HCl的存在对测定结果无影响,装置②、③间不能添加盛有饱和NaHCO3溶液的洗气瓶,否则饱和NaHCO3溶液吸收HCl的同时会生成CO2,导致测得的CO2的质量偏大,C错误;反应结束时,为了使②中CO2被③中Ba(OH)2溶液充分吸收,应再通入空气将装置②中CO2转移到装置③中,D正确。 6.四种短周期元素在元素周期表中的相对位置如图所示,Y元素原子最外层电子数是其电子层数的3倍。下列说法正确的是( ) A.四种元素的原子半径最大的是W B.Z单质与Y2反应生成化合物ZY3 C.最简单氢化物的稳定性:X>Y D.最高价氧化物对应水化物的酸性:W>X 答案 D 解析 短周期元素中原子最外层电子数是其电子层数的3倍的元素只有O,故Y是O;结合题图可进一步推知X、Z、W分别是N、S、Cl。同主族元素从上到下原子半径逐渐增大,同周期主族元素从左到右原子半径逐渐减小,故S的原子半径最大,A错误。S与O2反应生成SO2,而不是SO3,B错误。由于O的非金属性强于N,所以H2O的稳定性强于NH3,C错误。HClO4的酸性强于HNO3,D正确。 7.LiOH和钴氧化物可用于制备锂离子电池正极材料。利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。下列说法不正确的是( ) A.每产生标准状况下2.24 L氢气,有0.1 mol阳离子通过阳离子交换膜进入阴极区 B.电解过程中B极区溶液的pH变大 C.阳极的电极反应式为2Cl--2e-===Cl2↑ D.A极区电解液为LiCl溶液 答案 A 解析 由题图可知,B极区产生H2,说明H+在电极B上放电,故电极B为阴极,Li+通过阳离子交换膜向阴极移动,结合实验目的是制备LiOH,可知B极区的电解液为LiOH溶液,否则无法得到纯净的LiOH,因此A极区的电解液为LiCl溶液,阳极上Cl-放电,电极反应式为2Cl--2e-===Cl2↑,所以B、C、D正确;每产生0.1 mol H2,转移0.2 mol e-,就有0.2 mol Li+通过阳离子交换膜进入阴极区,A错误。 8.亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,使用过量会使人中毒,国际上对食品中亚硝酸钠的用量控制在很低的水平上。某学习小组针对亚硝酸钠设计了如下实验: 【实验Ⅰ】制备NaNO2 该小组查阅资料知:2NO+Na2O2===2NaNO2;2NO2+Na2O2===2NaNO3。 制备装置如图所示(夹持装置略去): (1)装置D可将剩余的NO氧化成NO,发生反应的离子方程式为_____________________________________________________________________。 (2)如果没有B装置,C中发生的副反应有____________________、________________、______________________________________________。 (3)甲同学检查完装置气密性良好后进行实验,发现制得的NaNO2中混有较多的NaNO3杂质。于是进行了适当的改进,改进后提高了NaNO2的纯度,则其改进措施是________________________________。 【实验Ⅱ】测定制取的样品中NaNO2的含量 步骤: a.在5个有编号的带刻度试管(比色管)中分别加入不同量的NaNO2溶液,各加入1 mL的M溶液(M遇NaNO2呈紫红色,NaNO2浓度越大颜色越深),再加蒸馏水至总体积均为10 mL并振荡,制成标准色阶: 试管编号 ① ② ③ ④ ⑤ NaNO2含量/(mg·L-1) 0 20 40 60 80 b.称量0.10 g制得的样品,溶于水配成500 mL溶液。取5 mL待测液,加入1 mL M溶液,再加蒸馏水至10 mL并振荡,与标准色阶比较。 (4)步骤b中比较结果是:待测液颜色与③标准色阶相同,则甲同学制得的样品中NaNO2的质量分数是________。 (5)用目视比色法证明维生素C可以有效降低NaNO2的含量。设计并完成下列实验报告。 答案 (1)5NO+3MnO+4H+===5NO+3Mn2++2H2O (2)2Na2O2+2H2O===4NaOH+O2↑ 2NO+O2===2NO2 2NO2+Na2O2===2NaNO3 (3)在A、B之间增加装有水的洗气瓶 (4)40% (5)维生素C 加入蒸馏水至总体积为10 mL 紫红色比③标准色阶浅 解析 (1)酸性KMnO4溶液具有强氧化性,能将NO氧化为NO,反应的离子方程式为5NO+3MnO+4H+===5NO+3Mn2++2H2O。 (2)铜和稀硝酸反应制得的NO中含有杂质水蒸气。 (3)制得的NaNO2中混有较多的NaNO3杂质,说明制得的NO中混有NO2,故应在装置A、B之间增加装有水的洗气瓶,以除去杂质NO2。 (4)待测液颜色与③标准色阶相同,则甲同学制得的样品中NaNO2的质量是40 mg·L-1 ×0.01 L×=40 mg=0.04 g,故样品中NaNO2的质量分数=×100%=40%。 (5)取5 mL待测液,然后加入维生素C,再加入1 mL M溶液,最后加入蒸馏水至总体积为10 mL,若紫红色比③标准色阶浅,说明NaNO2的含量低,则可以证明维生素C可以有效降低NaNO2的含量。查看更多