- 2021-07-06 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2节化学反应与能量转化第2课时化学反应能量转化的重要应用--化学电池课时作业含解析鲁科版第二册2
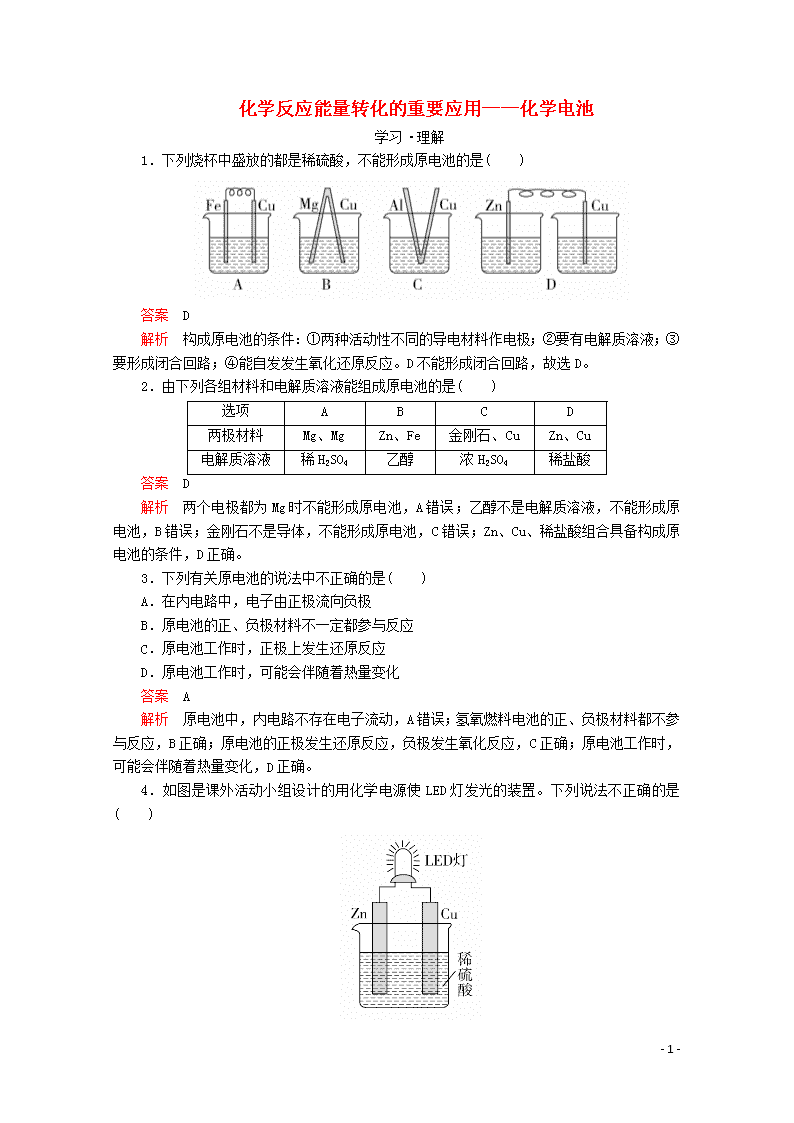
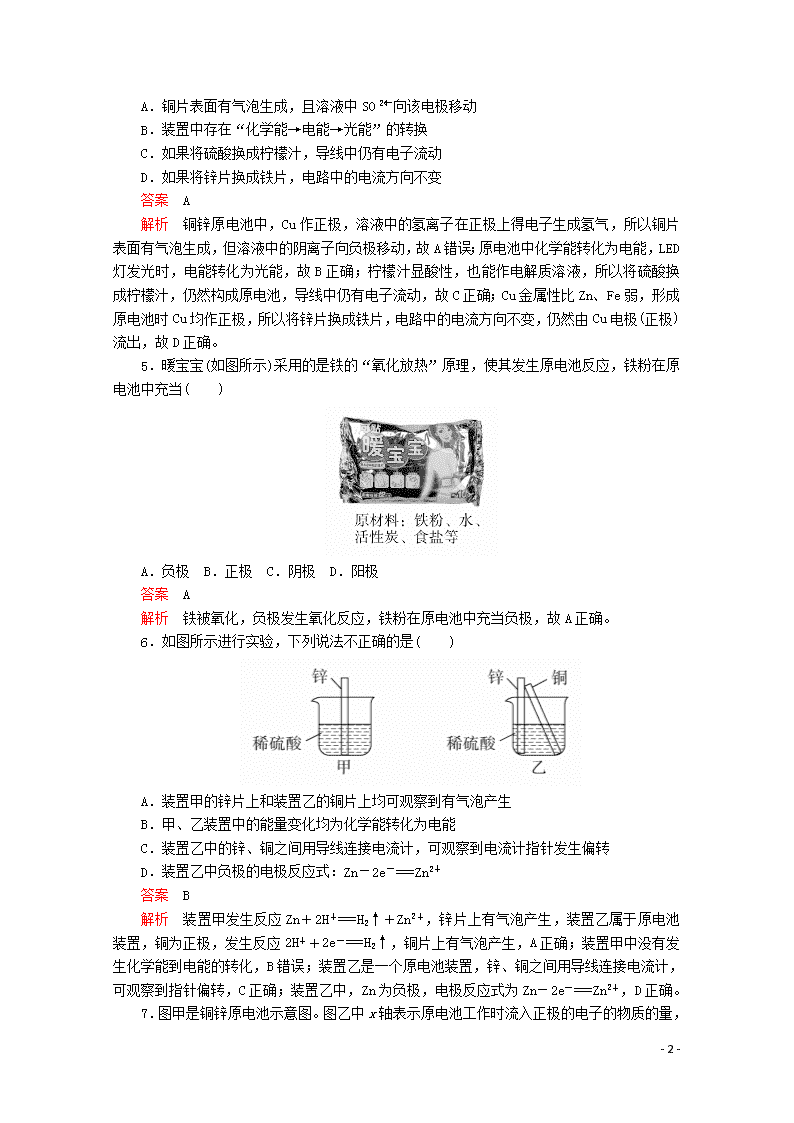
化学反应能量转化的重要应用——化学电池 学习·理解 1.下列烧杯中盛放的都是稀硫酸,不能形成原电池的是( ) 答案 D 解析 构成原电池的条件:①两种活动性不同的导电材料作电极;②要有电解质溶液;③要形成闭合回路;④能自发发生氧化还原反应。D不能形成闭合回路,故选D。 2.由下列各组材料和电解质溶液能组成原电池的是( ) 选项 A B C D 两极材料 Mg、Mg Zn、Fe 金刚石、Cu Zn、Cu 电解质溶液 稀H2SO4 乙醇 浓H2SO4 稀盐酸 答案 D 解析 两个电极都为Mg时不能形成原电池,A错误;乙醇不是电解质溶液,不能形成原电池,B错误;金刚石不是导体,不能形成原电池,C错误;Zn、Cu、稀盐酸组合具备构成原电池的条件,D正确。 3.下列有关原电池的说法中不正确的是( ) A.在内电路中,电子由正极流向负极 B.原电池的正、负极材料不一定都参与反应 C.原电池工作时,正极上发生还原反应 D.原电池工作时,可能会伴随着热量变化 答案 A 解析 原电池中,内电路不存在电子流动,A错误;氢氧燃料电池的正、负极材料都不参与反应,B正确;原电池的正极发生还原反应,负极发生氧化反应,C正确;原电池工作时,可能会伴随着热量变化,D正确。 4.如图是课外活动小组设计的用化学电源使LED灯发光的装置。下列说法不正确的是( ) - 7 - A.铜片表面有气泡生成,且溶液中SO向该电极移动 B.装置中存在“化学能→电能→光能”的转换 C.如果将硫酸换成柠檬汁,导线中仍有电子流动 D.如果将锌片换成铁片,电路中的电流方向不变 答案 A 解析 铜锌原电池中,Cu作正极,溶液中的氢离子在正极上得电子生成氢气,所以铜片表面有气泡生成,但溶液中的阴离子向负极移动,故A错误;原电池中化学能转化为电能,LED灯发光时,电能转化为光能,故B正确;柠檬汁显酸性,也能作电解质溶液,所以将硫酸换成柠檬汁,仍然构成原电池,导线中仍有电子流动,故C正确;Cu金属性比Zn、Fe弱,形成原电池时Cu均作正极,所以将锌片换成铁片,电路中的电流方向不变,仍然由Cu电极(正极)流出,故D正确。 5.暖宝宝(如图所示)采用的是铁的“氧化放热”原理,使其发生原电池反应,铁粉在原电池中充当( ) A.负极 B.正极 C.阴极 D.阳极 答案 A 解析 铁被氧化,负极发生氧化反应,铁粉在原电池中充当负极,故A正确。 6.如图所示进行实验,下列说法不正确的是( ) A.装置甲的锌片上和装置乙的铜片上均可观察到有气泡产生 B.甲、乙装置中的能量变化均为化学能转化为电能 C.装置乙中的锌、铜之间用导线连接电流计,可观察到电流计指针发生偏转 D.装置乙中负极的电极反应式:Zn-2e-===Zn2+ 答案 B 解析 装置甲发生反应Zn+2H+===H2↑+Zn2+,锌片上有气泡产生,装置乙属于原电池装置,铜为正极,发生反应2H++2e-===H2↑,铜片上有气泡产生,A正确;装置甲中没有发生化学能到电能的转化,B错误;装置乙是一个原电池装置,锌、铜之间用导线连接电流计,可观察到指针偏转,C正确;装置乙中,Zn为负极,电极反应式为Zn-2e-===Zn2+,D正确。 7.图甲是铜锌原电池示意图。图乙中x - 7 - 轴表示原电池工作时流入正极的电子的物质的量,则y轴可以表示( ) ①c(Zn2+) ②c(H+) ③c(SO) ④锌棒的质量 ⑤铜棒的质量 ⑥溶液的质量 A.①⑥ B.②④ C.③⑤ D.⑥ 答案 D 解析 由题图可知,y轴表示的物理量随流入正极的电子的物质的量增加而增大,根据铜锌原电池工作原理,锌失电子作负极,所以锌棒的质量减小;溶液中开始没有Zn2+,随着反应进行,溶液中c(Zn2+)从0开始逐渐增大,溶液的质量增加;H+得电子生成氢气,所以c(H+)减小,c(SO)不变;铜棒作正极材料,铜棒的质量不变,故D正确。 应用·实践 8.为将反应2Al+6H+===2Al3++3H2↑的化学能转化为电能,下列装置能达到目的的是(铝条均已除去氧化膜)( ) 答案 B 解析 A项能构成原电池,铝作负极,但电池总反应为2Al+2OH-+6H2O===2[Al(OH)4]-+3H2↑,不符合题意;B项为原电池装置,铝的金属性强于铜,铝作负极,电池总反应为2Al+6H+===2Al3++3H2↑,符合题意;C项为原电池装置,但硝酸是氧化性酸,则电池总反应为Al+4H++NO===Al3++NO↑+2H2O,不符合题意;D项为电能转化为化学能的装置,不符合题意。 9.已知X、Y、Z都是金属,若把X浸入Z的硝酸盐溶液中,X的表面有Z析出;若X、Y和盐酸形成原电池,Y为电池的负极。则X、Y、Z的金属活动性顺序为( ) A.Y>X>Z B.X>Z>Y C.X>Y>Z D.Y>Z>X 答案 A 解析 把X浸入Z的硝酸盐溶液中,X的表面有Z析出,说明金属X可以把金属Z从其盐溶液中置换出来,所以金属活动性:X>Z;X和Y组成原电池时,Y为电池的负极,所以金属活动性:Y>X,则X、Y、Z三种金属的活动性顺序为Y>X>Z,A正确。 10.如图所示,电流表的指针发生偏转,正极变粗,负极变细,符合这种情况的是( ) - 7 - A.正极为Cu,负极为Zn,S为稀H2SO4 B.正极为Zn,负极为Cu,S为CuSO4溶液 C.正极为Ag,负极为Zn,S为AgNO3溶液 D.正极为Fe,负极为Cu,S为AgNO3溶液 答案 C 解析 原电池中,负极发生失去电子的氧化反应,根据题意知负极变细,即金属单质失电子,负极应为活泼金属,故B、D错误;又因为正极变粗,即该电池的正极反应生成金属,故A错误,C正确。 11.有如图所示的装置,当电流表中显示产生持续电流时,下列说法正确的是( ) A.Cu作原电池的负极 B.Al作原电池的负极 C.电子由铝沿导线流向铜 D.铝片上的电极反应式为Al-3e-===Al3+ 答案 A 解析 铜、铝、浓硝酸(常温)构成原电池,金属铝遇到浓硝酸会发生钝化,所以当电流表中显示产生持续电流时,金属铜做负极,金属铝做正极,负极上金属发生失电子的氧化反应,正极上发生得电子的还原反应,A正确,B错误;电子从负极经外电路流向正极,即从铜沿导线流向铝,C错误;铝是正极,该电极上金属不发生反应,而是硝酸中的硝酸根离子发生得电子的还原反应,D错误。 12.干电池中发生的反应为Zn+2NH===Zn2++2NH3↑+H2↑,工作原理示意图如图所示。下列说法正确的是( ) A.碳棒为电池的负极 B.H2在Zn片上生成 C.电流由锌片流向碳棒 D.Zn片上发生氧化反应 答案 D 解析 - 7 - 根据反应方程式,放电时,Zn元素化合价由0价升高为+2价,H元素化合价由+1价降低为0价,所以Zn片作负极,碳棒作正极,故A错误;Zn片作负极,电极反应式为Zn-2e-===Zn2+,H2在碳棒电极上生成,故B错误;电流由正极经外电路流向负极,应是由碳棒流向锌片,故C错误;Zn片作负极,电极上发生失电子的氧化反应,故D正确。 13.氢氧燃料电池可以用在航天飞机上,其反应原理如图所示。下列有关氢氧燃料电池的说法不正确的是( ) A.该电池工作时化学能转化为电能 B.该电池中电极b是正极 C.外电路中电子由电极b通过导线流向电极a D.该电池的总反应为2H2+O2===2H2O 答案 C 解析 燃料电池属于原电池,是将化学能转化为电能的装置,A正确;通入氧化剂的电极为正极,所以电极b为正极,B正确;通入氢气的电极为负极,通入氧气的电极为正极,电子从负极a沿导线流向正极b,C错误;该电池中,负极的电极反应式为2H2-4e-===4H+,正极的电极反应式为O2+4H++4e-===2H2O,正、负极电极反应式相加可得电池的总反应:2H2+O2===2H2O,D正确。 迁移·创新 14.某化学研究性学习小组针对原电池的形成条件,设计了实验方案,进行如下探究。 (1)请填写有关实验现象并得出相关结论。 - 7 - ①通过实验2和3,可得出原电池的形成条件是____________________。 ②通过实验1和3,可得出原电池的形成条件是____________。 ③若将3装置中稀硫酸换成乙醇,电流计指针将不发生偏转,从而可得出原电池的形成条件是__________。 (2)分别写出实验3中Zn棒和Cu棒上发生的电极反应式。 Zn棒:________________。 Cu棒:________________。 (3)实验3的电流是从________棒流出的(填“Zn”或“Cu”),反应过程中若有0.4 mol电子发生了转移,则Zn电极质量减轻________g。 答案 (1)有气体生成 发生偏转 ①有活动性不同的两个电极 ②形成闭合回路 ③有电解质溶液 (2)Zn-2e-===Zn2+ 2H++2e-===H2↑ (3)Cu 13 解析 (1)实验3中构成原电池,锌棒作负极,铜棒作正极,溶液中的氢离子放电,则铜棒表面的现象是有气体生成,电流计指针发生偏转。①实验2和3相比,电极不同,因此可得出原电池的形成条件是有活动性不同的两个电极。②实验1和3相比,实验3中构成闭合回路,由此可得出原电池的形成条件是形成闭合回路。③若将3装置中稀硫酸换成乙醇,电流计指针将不发生偏转,由于乙醇是非电解质,硫酸是电解质,因此可得出原电池的形成条件是有电解质溶液。 (2)锌棒作负极,发生失去电子的氧化反应,则Zn棒上发生的电极反应式为Zn-2e- - 7 - ===Zn2+。铜棒作正极,溶液中的氢离子放电,则Cu棒上发生的电极反应式为2H++2e-===H2↑。 (3)实验3中锌棒作负极,铜棒作正极,则电流是从Cu棒流出的,反应过程中若有0.4 mol电子发生转移,根据Zn-2e-===Zn2+可知消耗0.2 mol Zn,则Zn电极质量减轻0.2 mol×65 g·mol-1=13.0 g。 - 7 -查看更多