- 2021-07-06 发布 |
- 37.5 KB |
- 26页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021届一轮复习鲁科版电解池、金属的腐蚀与防护学案
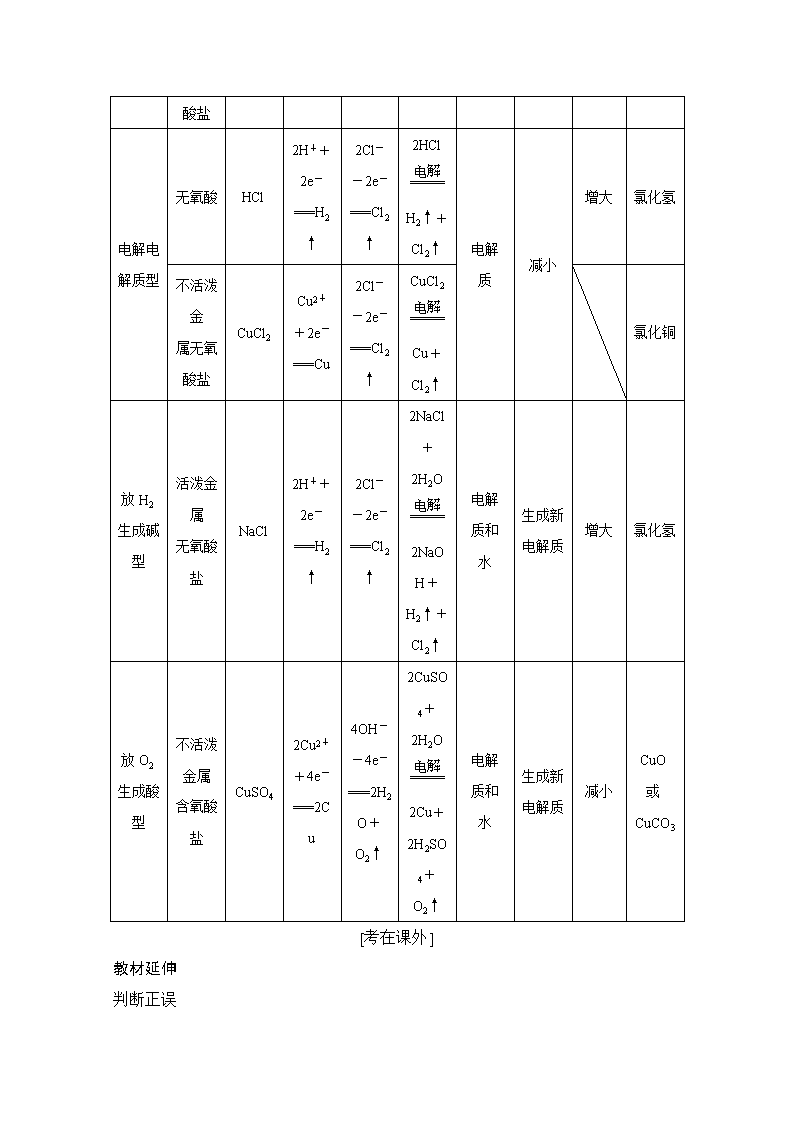
第2讲 电解池、金属的腐蚀与防护 学习指导意见 核心素养 1.了解电解池的构成,理解电解池的工作原理及应用,并能设计简单的电解池。 2.了解金属发生电化学腐蚀的原因并能解释相关现象,了解金属腐蚀的危害,选择、设计相关防腐措施。 1.变化观念与平衡思想:认识化学变化的本质是有新物质生成,并伴有能量的转化;能多角度、动态地分析电解池中发生的反应,并运用电解池原理解决实际问题。 2.科学态度与社会责任:肯定电解原理对社会发展的重大贡献,能对与电解有关的社会热点问题做出正确的价值判断。 考点一 电解原理 [学在课内] 1.电解与电解池 [名师点拨] 在电解池中反应可自发也可不自发,不自发的反应可发生,自发反应进行更快。 2.构成条件 (1)电源或一可作电源的原电池。 (2)形成闭合回路—电极用导线与电源相连后插入电解质溶液中或熔融电解质中。 3.电解池工作原理示意图 [名师点拨] (1)易错警示 内电路中导电微粒为阴、阳离子,导线、电极上导电微粒为电子。 (2)电子和离子的移动方向(惰性电极) 4.阴、阳两极上放电顺序 (1)阴极:(与电极材料无关)。氧化性强的先放电,放电顺序: 注意:①阴极不管是什么材料,电极本身都不反应,一定是溶液(或熔融电解质)中的阳离子放电。 ②常用放电顺序阴极:Ag+>Fe3+>Cu2+>H+。 (2)阳极:若是活性电极作阳极,则活性电极首先失电子,发生氧化反应。 若是惰性电极作阳极,放电顺序为 注意:常用放电顺序阳极:活性电极S2->I->Br->Cl->OH- 5.以惰性电极电解的几种类型 注意:电解时溶液酸碱性口诀:氢出碱增,氧出酸增,氢氧失去,“酸”酸、“碱”碱、“中”中。 类型 电解质特点 实例 电极反应式 电解 方程式 电解 对象 电解质溶液浓度的变化 溶液 pH 变化 电解质溶液复原的方法 阴极 阳极 电解水型 含氧酸 H2SO4 4H++4e-===2H2↑ 4OH-+4e-===2H2O+O2↑ 2H2O2H2↑+O2↑ 水 增大 减小 加水 可溶性强碱 NaOH 增大 KNO3 不变 活泼金属含氧酸盐 电解电解质型 无氧酸 HCl 2H++2e-===H2↑ 2Cl--2e-===Cl2↑ 2HClH2↑+ Cl2↑ 电解 质 减小 增大 氯化氢 不活泼金 属无氧 酸盐 CuCl2 Cu2++2e-===Cu 2Cl--2e-===Cl2↑ CuCl2Cu+Cl2↑ 氯化铜 放H2生成碱型 活泼金属 无氧酸盐 NaCl 2H++2e-===H2↑ 2Cl--2e-===Cl2↑ 2NaCl+2H2O2NaOH+H2↑+ Cl2↑ 电解 质和 水 生成新 电解质 增大 氯化氢 放O2生成酸型 不活泼金属 含氧酸盐 CuSO4 2Cu2++4e-===2Cu 4OH--4e-===2H2O+O2↑ 2CuSO4+2H2O2Cu+2H2SO4+O2↑ 电解 质和 水 生成新 电解质 减小 CuO或CuCO3 [考在课外] 教材延伸 判断正误 (1)任何化学反应都可以设计成电解池反应。(×) (2)某些不能自发进行的氧化还原反应,通过电解可以实现。(√) (3)电解硫酸等溶液,H+放电,溶液的pH逐渐增大。(×) (4)电解时,电解液中阳离子移向阳极,阴离子移向阴极。(×) (5)电解时,电子的移动方向为:电源负极→阴极→阳极→电源正极。(×) (6)电解池的阳极发生氧化反应,阴极发生还原反应。(√) (7)用铁作电极电解饱和食盐水时,阳极上Cl-失电子变为Cl2。(×) (8)工业上采用电解MgCl2溶液冶炼金属镁。(×) 拓展应用 (1)以铝材为阳极,电解H2SO4溶液,铝材表面形成氧化膜 阳极反应式:____________________________________________; 阴极反应式:_____________________________________________; 总反应方程式:____________________________________________。 答案 2Al-6e-+3H2O===Al2O3+6H+ 6H++6e-===3H2↑ 2Al+3H2OAl2O3+3H2↑ (2)①电解饱和食盐水装置如图所示 阳极反应式:______________________________________________ 阴极反应式:______________________________________________ 总反应式:_________________________________________________ 答案 ①2Cl--2e-===Cl2↑ 2H++2e-===H2↑(2H2O+2e-===H2↑+2OH-) 2Cl-+2H2OCl2↑+H2↑+2OH- ②a.如将装置中右侧碳电极换成铁电极,对电极反应有无影响?________ b.如果将装置中左侧碳电极换成铁电极,对电极反应有无影响?________。 c.上述情况如对电极反应影响,请写出电极反应式及总反应式。 阳极反应式:_____________________________________________ 阴极反应式:_____________________________________________ 总反应式:_______________________________________________ 答案 a.无 b.有 c.Fe-2e-===Fe2+ 2H++2e-===H2↑(2H2O+2e-===H2↑+2OH-) Fe+2H+===Fe2++H2↑ 思维探究 Cu不溶于稀硫酸,现欲使Cu溶于稀硫酸,可采取什么措施? 答案 Cu溶解为氧化反应,应采取氧化措施。 方法1:设计成电解池,如图所示 方法2:加入氧化剂如H2O2、O2等微热 [基础点巩固] 1.某小组为研究电化学原理,设计了甲、乙、丙三种装置(C1、C2、C3均为石墨)。下列叙述正确的是( ) A.甲、丙中化学能转化为电能,乙中电能转化为化学能 B.C1、C2分别是阳极、阴极;锌片、铁片上都发生氧化反应 C.C1上和C3上放出的气体相同,铜片上和铁片上放出的气体也相同 D.甲中溶液的pH逐渐增大,丙中溶液的pH逐渐减小 解析 A项,甲没有外接电源,是将化学能转化为电能的装置,为原电池;乙、丙有外接电源,是将电能转化为化学能的装置,为电解池,错误。B项,C1、C2分别连接电源的正、负极,分别是电解池的阳极、阴极;锌片作负极发生氧化反应,铁片作阴极发生还原反应,错误。C项,C1和C3 都是阳极,氯离子在阳极上失电子生成氯气,铜片上和铁片上都是氢离子得电子生成氢气,正确。D项,甲中正极和丙中阴极上都是氢离子得电子生成氢气,随着反应的进行,溶液的pH均增大,错误。 答案 C 2.取一张用饱和NaCl溶液浸湿的pH试纸,两根铅笔芯做电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圆为白色,外圈呈浅红色。 则下列说法错误的是( ) A.b电极是阴极 B.a电极与电源的正极相连接 C.电解过程中,水是氧化剂 D.b电极附近溶液的pH变小 解析 电解饱和NaCl溶液,阳极生成Cl2,Cl2与水反应生成HClO和HCl,盐酸具有酸性,可使pH试纸变红色,HClO具有漂白性,HClO可将红色漂白,故内圆为白色,外圈为红色,可推出a为阳极,A项正确;a为阳极与电源正极相连,B项正确;电解过程中,H2O得电子,为氧化剂,C项正确;b电极附近有OH-生成,pH增大,D项错误。 答案 D [名师点拨] 阴、阳极的判断 3.用惰性电极电解一定浓度的CuSO4溶液时,通电一段时间后,向所得的溶液中加入0.1 mol Cu2(OH)2CO3后恰好恢复到电解前的浓度和pH(不考虑二氧化碳的溶解)。则电解过程中转移电子的物质的量为( ) A.0.4 mol B.0.5 mol C.0.6 mol D.0.8 mol 解析 电解硫酸铜时,开始硫酸铜和水反应生成铜、氧气和硫酸,后来电解水生成氢气与氧气。如果只按照第一阶段的电解,反应后只需要加入氧化铜或碳酸铜即可恢复原电解质溶液。而题目中加入的是碱式碳酸铜,相当于加入了0.2 mol氧化铜和0.1 mol水,而0.1 mol水是第二阶段的反应所消耗的,该阶段转移了0.2 mol电子,第一阶段转移了0.4 mol电子,即一共转移了0.6 mol电子,C项正确。 答案 C [名师点拨] 用惰性电极电解电解质溶液的复原措施 电解后的溶液恢复到原状态,应遵循“出来是什么加什么,出来多少加多少”的原则。一般加入阴极产物与阳极产物化合的产物。如用惰性电极电解CuSO4溶液(足量)一段时间后,若使溶液复原,应加入适量CuO或CuCO3,但不能加Cu(OH)2,因为加Cu(OH)2水的量增多了。 [能力点提升] 4.锂—液态多硫电池具有能量密度高、储能成本低等优点,以熔融金属锂、熔融硫和多硫化锂[Li2Sx(2≤x≤8)]分别作两个电极的反应物,固体Al2O3陶瓷(可传导Li+)为电解质,其反应原理如图所示。下列说法错误的是( ) A.该电池比钠—液态多硫电池的比能量高 B.放电时,内电路中Li+的移动方向为从a到b C.Al2O3的作用是导电、隔离电极反应物 D.充电时,外电路中通过0.2 mol电子,阳极区单质硫的质量增加3.2 g 解析 A项,电池提供2 mol e-电量时,该电池对应Li2Sx质量为(14+32x)g,而钠—液态多硫电池对应质量为(46+32x)g,故该电池比能量高,正确;B项由图分析知a为负极,b为正极,Li+从a极移向b极,正确;C项Al2O3 为固体电解质,故能导电,同时将两极反应物隔开,正确;D项当外电路中通过0.2 mol e-时,阳极区生成0.1x mol硫,故阳极区生成硫的质量为3.2x g,错误。 答案 D 5.某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是( ) A.该装置将化学能转化为光能和电能 B.该装置工作时,H+从b极区向a极区迁移 C.每生成1 mol O2,有44 g CO2被还原 D.a 电极的反应为:3CO2+18H+-18e-===C3H8O+5H2O 解析 A项,该装置是电解池,在电解和光的作用下H2O在光催化剂的表面转化为O2和H+,故该装置是将电能和光能转化为化学能,错误;B项,根据同种电荷相互排斥、异种电荷相互吸引的原则,该装置工作时,H+从阳极b极区向阴极a极区迁移,正确;C项,该电解池的总反应式为:6CO2+8H2O2C3H8O+9O2。根据总反应方程式可知,每生成1 mol O2,有 mol CO2被还原,其质量为 g,错误;D项,a电极为阴极,发生还原反应,电极反应式为:3CO2+18H++18e-===C3H8O+5H2O,错误。 答案 B 6.(1)用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为H2SO4-H2C2O4混合溶液。下列叙述错误的是( ) A.待加工铝质工件为阳极 B.可选用不锈钢网作为阴极 C.阴极的电极反应式为Al3++3e-===Al D.硫酸根离子在电解过程中向阳极移动 (2)①电解熔融Al2O3时,电解过程中作阳极的石墨易消耗,原因是________________________________________________________________。 ②电解Na2CO3溶液,原理如图所示。阳极的电极反应式为__________________________,阴极产生的物质A的化学式为________。 答案 (1)C (2)①石墨电极被阳极上产生的O2氧化 ②4CO+2H2O-4e-===4HCO+O2↑ H2 7.铅蓄电池在日常生活中应用广泛。回答下列问题: (1)铅蓄电池放电时的工作原理为Pb+PbO2+2H2SO4===2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4 mol电子时铁电极的质量减少11.2 g。请回答下列问题: ①A是铅蓄电池的________极。 ②Cu电极的电极反应式是__________________________________________, CuSO4溶液的浓度________(填“减小”“增大”或“不变”)。 (2)铅蓄电池的PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为________________________________________________________________; PbO2也可以石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液制取。阳极发生的电极反应式为___________________________________________ ________________________________________________________________。 (3)将Na2S溶液加入如图所示的电解池的阳极区,用铅蓄电池进行电解,电解过程中阳极区发生如下反应:S2--2e-===S,(n-1)S+S2-===S。 电解时阴极的电极反应式:__________________________________________。 电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成________________________________________________________________。 (4)Na2FeO4是一种既能杀菌、消毒,又能絮凝净水的水处理剂,其电解制法如图所示,请根据图示分析:Fe电极的电极反应为___________________________, 与铁电极相连的为电源的________极。 解析 (1)①因电解过程中铁电极质量减少,判断A是电源负极,B是电源正极。 ②右侧U形管相当于电镀装置,Zn电极作阴极,电极反应式为Cu2++2e-===Cu,铜电极作阳极,电极反应式为Cu-2e-===Cu2+,电镀过程中CuSO4溶液的浓度保持不变。 (2)根据电子得失守恒可得PbO+ClO-===PbO2+Cl-。用电解法制PbO2,Pb化合价态升高,PbO2应为阳极产物,即Pb2++2H2O-2e-===PbO2↓+4H+。 (3)阴极只有H+得电子生成H2;反应物为S、H+,产物有S,所以S中S的化合价既升高也降低,有H2S生成,配平即可。 答案 (1)①负 ②Cu-2e-===Cu2+ 不变 (2)PbO+ClO-===PbO2+Cl- Pb2++2H2O-2e-===PbO2↓+4H+ (3)2H++2e-===H2↑ S+2H+===(n-1)S↓+H2S↑ (4)Fe+8OH--6e-===FeO+4H2O 正 [名师点拨] 电解池电极反应分析及电极反应式的书写规律 (1)放电物质 ①首先分析阳极材料,如为活性电极(Pt,电极除外),则电极本身放电。 ②如为惰性电极,则分析电解液的成分,找全离子并分成阴、阳两组。结合放电顺序确定放电微粒。 ③电解水溶液时,应注意放电顺序中H+、OH-之后的离子一般不参与放电,电镀除外。 (2)放电产物 ①依据放电规律判断 ②分析介质,介质是否参与电极反应 ③明确电解目的,①、②应服从电解目的 (3)电极反应式,总反应式的书写 ①书写电解池中电极反应式时,如果氢离子来自于水,那电极反应式书写水或氢离子都可以,但书写电解总反应方程时,要写水分子。 ②书写电解质中电极反应式一般分三步:列物质,标得失→ 选离子、配电荷→巧用水,配个数。 ③在两极得失电子数相等时两式相加可得总式,复杂电极式=总反应式-简单电极式。 ④注明“电解”或通电条件。 8.电解Na2CO3溶液,原理如图所示。阳极的电极反应式为________________________________________________________________, 阴极产生的物质A的化学式为______________________________________。 解析 电解Na2CO3溶液,实际上是电解水,观察电解池装置可知,阳极产物有NaHCO3和O2,则阳极反应式为4CO+2H2O-4e-===4HCO+O2↑,阴极发生还原反应,2H2O+2e-===H2↑+2OH-,产物为H2。 答案 4CO+2H2O-4e-===4HCO+O2↑ H2 9.(1)制备Na2S2O5也可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3。阳极的电极反应式为 ________________________________________________________________。 电解后,________室的NaHSO3浓度增加。将该室溶液进行结晶脱水,可得到Na2S2O5。 (2)KIO3也可采用“电解法”制备,装置如图所示。 ①写出电解时阴极的电极反应式_____________________________________ ________________________________________________________________。 ②电解过程中通过阳离子交换膜的离子主要为________________,其迁移方向是________。 (3)O2辅助的AlCO2电池工作原理如图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。 电池的负极反应式:_________________________________________。 电池的正极反应式:6O2+6e-===6O 6CO2+6O===3C2O+6O2 反应过程中O2的作用是________________________________________。 该电池的总反应式:___________________________________________。 解析 (1)阳极发生氧化反应:2H2O-4e-===4H++O2↑(或4OH--4e-===2H2O+O2↑),阳极室H+向a室迁移,a室中的Na2SO3转化成NaHSO3。阴极发生还原反应,析出H2,OH-增多,Na+由a室向b室迁移,则b室中Na2SO3浓度增大。 (2)①电解法制备KIO3时,H2O在阴极得到电子,发生还原反应:2H2O+2e-===2OH-+H2↑或2H++2e-===H2↑。②电解池中阳离子向阴极移动,即由电极a向电极b迁移,阳离子交换膜只允许阳离子通过,故主要是K+通过阳离子交换膜。 (3)该电池中Al作负极,电解质为含AlCl3的离子液体,故负极反应式为Al-3e-===Al3+。正极为多孔碳电极,根据正极反应式,得正极总反应为6CO2+6e-===3C2O,O2不参与正极的总反应,故O2为催化剂。将负极反应式:2Al-6e-===2Al3+和正极反应式:6CO2+6e-===3C2O相加,可得该电池的总反应式为2Al+6CO2===Al2(C2O4)3。 答案 (1)2H2O-4e-===4H++O2↑(或4OH--4e-===2H2O+O2↑) a (2)①2H2O+2e-===2OH-+H2↑(或2H++2e-===H2↑) ②K+ 由a到b (3)Al-3e-===Al3+(或2Al-6e-===2Al3+) 催化剂 2Al+6CO2===Al2(C2O4)3 考点二 电解原理的应用 [学在课内] 1.电解饱和食盐水 (1)原理 (2)装置 装置 离子交换膜 阳极 钛网(涂有钛、钌等氧化物涂层) 阴极 碳钢网 阳离子交换膜 ①只允许阳离子通过,能阻止阴离子和气体通过 ②将电解槽隔成阳极室和阴极室 [名师点拨] ①NaOH的产生位置:阴极室。 ②如去掉阳离子交换膜,让阴极室与阳极室产物充分反应,总反应式为NaCl+H2ONaClO+H2↑。 2.电镀铜 3.电解精炼铜 4.电冶金 利用电解熔融盐的方法来冶炼活泼金属Na、Ca、Mg、Al等 总方程式 阳极、阴极反应式 冶炼钠 2NaCl(熔融)2Na+Cl2↑ 2Cl--2e-===Cl2↑ 2Na++2e-===2Na 冶炼镁 MgCl2(熔融)Mg+Cl2↑ 2Cl--2e-===Cl2↑ Mg2++2e-===Mg 冶炼铝 2Al2O3(熔融)4Al+3O2↑ 6O2--12e-===3O2↑ 4Al3++12e-===4Al [考在课外] 教材延伸 判断正误 (1)电解饱和食盐水时,两个电极均不能用金属材料。(×) (2)用惰性电极电解饱和食盐水,阴极逸出的气体可使湿润的淀粉碘化钾试纸变蓝。(×) (3)用惰性电极电解MgCl2溶液所发生反应的离子方程式为2Cl-+2H2OCl2↑+H2↑+2OH-。(×) (4)在镀件上电镀铜时,镀件应连接电源的正极。(×) (5)电解精炼时,阳极泥可以作为提炼贵重金属的原料。(√) (6)用Zn作阳极,Fe作阴极;ZnCl2作电解质溶液,由于放电顺序H+>Zn2+,不可能在铁上镀锌。(×) (7)粗铜电解精炼时,若电路中通过2 mol e-,阳极减少64 g。(×) (8)工业上采用电解MgCl2溶液法冶炼金属镁。(×) (9)用铜作阳极、石墨作阴极电解CuCl2溶液时,阳极电极反应式为2Cl--2e-===Cl2↑。(×) 拓展应用 如图是一个用铂丝作电极,电解稀MgSO4溶液的装置,电解液中加有中性红指示剂,此时溶液呈红色。(指示剂的pH变色范围:6.8~8.0,酸性——红色,碱性——黄色) 回答下列问题: (1)下列关于电解过程中电极附近溶液颜色变化的叙述正确的是________(填序号)。 ①A管溶液由红变黄 ②B管溶液由红变黄 ③A管溶液不变色 ④B管溶液不变色 (2)写出A管中发生反应的反应式_______________________________ ________________________________________________________________。 (3)检验b管中气体的方法是___________________________________ ________________________________________________________________。 答案 (1)①④ (2)2H++2e-===H2↑(或2H2O+2e-===2OH-+H2↑),Mg2++2OH-===Mg(OH)2↓ (3)用拇指按住管口,取出试管正立,放开拇指,将带有火星的木条伸入试管内会复燃 思维探究 电解过程中A中CuSO4溶液浓度________,而B中CuSO4溶液浓度________,试分析其原因是_____________________________________ ________________________________________________________________。 答案 逐渐减小 基本不变 A中阳极反应:Zn-2e-===Zn2+等及Cu-2e-===Cu2+、阴极反应:Cu2++2e-===Cu;阳极生成Cu2+的量少于阴极消耗Cu2+的量,溶液中[Cu2+]减小。 B中阳极反应:Cu-2e-===Cu2+、阴极反应Cu2++2e-===Cu;阳极生成Cu2+ 的量与阴极生成Cu2+的量相等,溶液中[Cu2+]不变 [基础点巩固] 1.电浮选凝聚法处理污水的原理如图所示。电解过程生成的胶体能使污水中的悬浮物凝聚成团而除去,电解时阳极也会产生少量气体。下列说法正确的是( ) A.可以用铝片或铜片代替铁片 B.阳极产生的气体可能是O2 C.电解过程中H+向阳极移动 D.若污水导电能力较弱,可加入足量硫酸 解析 电解原理是铁作阳极发生氧化反应生成Fe2+,阴极水中H+放电生成H2,阳极区生成胶体吸附水中悬浮杂质沉降而净水。A项,铜盐无净水作用,错误;B项,阳极可能有少量OH-放电,正确;C项,H+在阴极放电,错误;D项,加入的硫酸会与胶体反应,错误。 答案 B 2.在电解液不参与反应的情况下,采用电化学法还原CO2可制备ZnC2O4,原理如图所示。下列说法正确的是( ) A.电解结束后电解液Ⅱ中[Zn2+]增大 B.电解液Ⅰ应为ZnSO4溶液 C.Pt极反应式为2CO2+2e-===C2O D.当通入44 g CO2时,溶液中转移1 mol电子 解析 因为右室Zn失去电子生成Zn2+,溶液中的Zn2+ 通过阳离子交换膜进入左室,根据电荷守恒,阴离子浓度不变,[Zn2+]不变,A项错误;右室生成的Zn2+通过阳离子交换膜进入左室与生成的C2O结合为ZnC2O4,因此,电解液Ⅰ为稀的ZnC2O4溶液,不含杂质,电解液Ⅱ只要是含Zn2+的易溶盐溶液即可,B项错误;Pt极反应式为2CO2+2e-===C2O,C项正确;当通入44 g CO2时,外电路中转移1 mol电子,溶液中不发生电子转移,D项错误。 答案 C 3.全钒液流储能电池一次性充电后,续航能力可达1 000 km,而充电时只需3~5 min,被誉为“完美电池”,其原理如图所示(已知V2+呈紫色,V3+呈绿色)。电池放电时,左槽溶液质量增加。下列说法正确的是( ) A.充电时的阴极反应为VO+2H++e-===VO2++H2O B.放电时的正极反应为V3++e-===V2+ C.放电过程中,右槽溶液由紫色变为绿色 D.若负载为用石墨电极电解食盐水的装置,生成4 g NaOH时该电池中消耗0.1 mol H+ 解析 放电时,左槽溶液质量增加可推知H+移向左槽,故放电时左侧为正极,右侧为负极。充电时,左侧为阳极,右侧为阴极。A项充电时阴极反应式为V3++e-===V2+,错误;B项放电时正极反应式为VO+e-+2H+===VO2++H2O,错误;C项放电过程中右槽V2+转变为V3+,故溶液颜色由紫色变为绿色,正确;D项电解食盐水生成4 g NaOH时,电路中转移0.1 mol e-,由VO+e-+2H+===VO2++H2O可知消耗0.2 mol H+,错误。 答案 C 4.(1)将粗品PbO溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液生成Pb的装置如图所示: ①阴极的电极反应式为___________________________________________; ②当有2.07 g Pb生成时,通过质子交换膜的n(H+)=________。 (2)利用“NaCO2”电池将CO2变废为宝。我国科研人员研制出的可充电“NaCO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO22Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示: ①放电时,正极的电极反应式为_____________________________________。 ②若生成的Na2CO3和C全部沉积在电极表面,当转移0.2 mol e-时,两极的质量差为________g。 解析 (1)由电解目的电解Na2PbCl4溶液生成Pb可知在阴极反应式为:PbCl+2e-===Pb+4Cl-。②当有2.07 g Pb生成时,电路中通过的电量为0.02 mol e-故通过质子交换膜的n(H+)=0.02 mol。 (2)①由总反应式4Na+3CO22Na2CO3+C可知正极反应为3CO2+4e-+4Na+===2Na2CO3+C ②当转移0.2 mol e-时,负极失重:0.2×23=4.6(g),正极增重0.1×106+0.05×12=11.2(g),故两极质量差为11.2+4.6=15.8(g)。 答案 (1)①PbCl+2e-===Pb+4Cl- ②0.02 mol (2)①3CO2+4e-+4Na+===2Na2CO3+C ②15.8 [名师点拨] 电解计算的三种方法 如可以通过4 mol e-为桥梁构建如下关系式: (式中M为金属,n为其离子的化合价数值) 注意:涉及气体时一定要注意气体状态为标准状况。 [能力点提升] 5.某太阳能电池的工作原理如图所示。下列说法正确的是( ) A.光照时,b极的电极反应式为VO2+-e-+H2O===VO+2H+ B.光照时,每转移2 mol电子,有2 mol H+由a极区经质子交换膜向b极区迁移 C.夜间a极的电极反应式为V3++e-===V2+ D.硅太阳能电池供电原理与该电池相同 解析 由图中e-移动方向可知b为负极,a为正极。A项,光照时b极发生VO2+-e-+H2O===VO+2H+,正确;B项,H+ 移动方向为b极区到a极区,错误;C项,夜间a极应发生氧化反应,电极反应式为V2+-e-===V3+,错误;D项,该电池供电时发生氧化还原反应,与硅太阳能电池工作原理不同,错误。 答案 A 6.用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴、阳离子交换膜组合循环再生机理如图所示,下列有关说法不正确的是( ) A.X为直接电源的负极,Y为直流电源的正极 B.阳极的电极反应式为4OH--4e-===2H2O+O2↑ C.图中的b>a D.该过程中的产品主要为H2SO4和H2 解析 根据Na+和SO、HSO的移动方向可知Pt(Ⅰ)为阴极,电极反应式为2H++2e-===H2↑,Pt(Ⅱ)为阳极,电极反应式为SO-2e-+H2O===SO+2H+。 答案 B 7.最近我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中CO2和H2S的高效去除。示意图如图所示,其中电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯电极区发生反应为: ①EDTAFe2+-e-===EDTAFe3+ ②2EDTAFe3++H2S===2H++S+2EDTAFe2+ 该装置工作时,下列叙述错误的是( ) A.阴极的电极反应:CO2+2H++2e-===CO+H2O B.协同转化总反应:CO2+H2S===CO+H2O+S↓ C.石墨烯上的电势比ZnO@石墨烯上的低 D.若采用Fe3+/Fe2+取代EDTAFe3+/EDTAFe2+,溶液需为酸性 解析 阴极发生还原反应,氢离子由交换膜右侧向左侧迁移,阴极的电极反应式为CO2+2e-+2H+===CO+H2O,A项正确;结合阳极区发生的反应,可知协同转化总反应为CO2+H2S===S+CO+H2O,B项正确;石墨烯作阳极,其电势高于ZnO@石墨烯的,C项错误;Fe3+、Fe2+在碱性或中性介质中会生成沉淀,它们只稳定存在于酸性较强的介质中,D项正确。 答案 C 8.三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。 下列叙述正确的是( ) A.通电后中间隔室的SO离子向正极迁移,正极区溶液pH增大 B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品 C.负极反应为2H2O-4e-===O2↑+4H+,负极区溶液pH降低 D.当电路中通过1 mol电子的电量时,会有0.5 mol的O2生成 解析 电解池中阴离子向阳极(即正极)移动,阳离子向阴极(即负极)移动,即SO离子向正极区移动,Na+ 向负极区移动,正极区水电离的OH-发生氧化反应生成氧气,H+留在正极区,该极得到H2SO4产品,溶液pH减小,负极区水电离的H+发生还原反应生成氢气,OH-留在负极区,该极得到NaOH产品,溶液pH增大,故A、C项错误,B正确;该电解池相当于电解水,根据电解水的方程式可计算出当电路中通过1 mol电子的电量时,会有0.25 mol的O2生成,错误。 答案 B “多池组合”装置 提升学生模型认知素养 素养说明:电化学在高考中属于必考内容。近几年多池组合在高考中出现频度较高。综合考查化学反应中的能量变化、氧化还原反应、化学计算等知识。通过数学建模解答电化学中电极判断、电极反应式、现象、电解液的恢复、电量守恒计算等问题,从而提升学生的模型认知素养。 [题组训练] 题型一 外加电源型 1.用石墨电极完成下列电解实验。 实验一 实验二 装置 现象 a、d处试纸变蓝;b处变红,局部退色;c处无明显变化 两个石墨电极附近有气泡产生;n处有气泡产生;…… 下列对实验现象的解释或推测不合理的是( ) A.a、d处:2H2O+2e-===H2↑+2OH- B.b处:2Cl--2e-===Cl2↑ C.c处发生了反应:Fe-2e-===Fe2+ D.根据实验一的原理,实验二中m处能析出铜 解析 A项,a、d处试纸变蓝,说明溶液显碱性,是溶液中的氢离子得到电子生成氢气,氢氧根离子剩余造成的,正确;B项,b处变红,局部退色,说明是溶液中的氯离子放电生成氯气同时与H2O反应生成HClO和H+,Cl--2e-+H2O===HClO+H+,错误;C项,c处为阳极,铁失去电子生成亚铁离子,正确;D项,实验一中ac形成电解池,bd形成电解池,所以实验二中形成3个电解池,n(右面)有气泡生成,为阴极产生氢气,n的另一面(左面)为阳极产生Cu2+,Cu2+在m的右面得电子析出铜,正确。 答案 B 2.用铅蓄电池电解AgNO3、Na2SO4的溶液,a、b、c、d电极材料均为石墨。已知铅蓄电池的总反应为Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(l),通电时a电极质量增加,下列说法正确的是( ) A.电路中通过1 mol电子时,Y电极质量增加48 g B.放电时铅蓄电池负极的电极反应式为PbO2(s)+4H+(aq)+SO(aq)+2e-===PbSO4(s)+2H2O(l) C.c,d电极产生气体的物质的量之比为1∶2 D.X极为负极 解析 铅蓄电池为外加电源。由a极质量增加可知a为阴极,由此可知X为正极,Y为负极,b为阳极,c为阴极,d为阳极,故D项错误。A项,Y极电极反应式为Pb-2e-+SO===PbSO4,转移1 mol e-时,增重48 g,正确;B项负极上发生氧化反应失e-,错误;C项,c、d两极上产生气体分别为H2、O2,二者物质的量之比为2∶1,错误。 答案 A 题型二 无外加电源型 3.某同学组装了如图所示的电化学装置,电极Ⅰ为Al,其他均为Cu,则( ) A.电流方向:电极Ⅳ→Ⓐ→电极Ⅰ B.电极Ⅰ发生还原反应 C.电极Ⅱ逐渐溶解 D.电极Ⅲ的电极反应:Cu2++2e-===Cu 解析 分析图可知:左侧两个烧杯的装置形成原电池,且Ⅰ为负极,Ⅱ为正极,而最右边的装置为电解池,因此,该装置中电子流向:电极Ⅰ→Ⓐ→电极Ⅳ,则电流方向:电极Ⅳ→Ⓐ→电极Ⅰ,A正确;电极Ⅰ发生氧化反应,B错误;电极Ⅱ的电极反应为Cu2++2e-===Cu,有铜析出,C错误;电极Ⅲ为电解池的阳极,其电极反应为Cu-2e-===Cu2+,D错误。 答案 A 4.我国预计在2020年前后建成自己的载人空间站。为了实现空间站的零排放,循环利用人体呼出的CO2并提供O2,我国科学家设计了一种装置(如下图),实现了“太阳能-电能-化学能”转化,总反应方程式为2CO2===2CO+O2。关于该装置的下列说法中正确的是( ) A.图中N型半导体为正极,P型半导体为负极 B.图中离子交换膜为阳离子交换膜 C.反应完毕,该装置中电解质溶液的碱性增强 D.人体呼出的气体参与X电极的反应:CO2+2e-+H2O===CO+2OH- 解析 根据题图中左边电源内负电荷的移向,可知N型半导体为负极,P型半导体为正极,A错误;N型半导体为负极,X极为电解池的阴极,电极反应为:CO2+2e-+H2O===CO+2OH- ,生成的氢氧根离子通过离子交换膜在Y极参加反应,所以图中的离子交换膜为阴离子交换膜,B错误,D正确;总反应方程式为2CO2===2CO+O2,根据总反应可知,反应前后电解质溶液的碱性不变,C错误。 答案 D [名师点拨] “多池组合”电池分析 电极判断 (1)有外加电源:各池均为电解池,电源正极—阳极,电源负极—阴极,电极位置相同,作用也相同。 (2)无外加电源:其一为原电池,其余为电解池。 a.燃料电池为原电池,其余为电解池。电极判断同上。 b.一般金属电极其中最活泼的金属为原电池的负极,另一极为正极,其余为电解池,电极判断同上。 c.光电池只需确定电子或阴、阳离子的移动方向即可判断阴、阳极。 计算,闭合回路中电量守恒。突破一点,其余据此就可解决。查看更多