西藏拉萨中学2020届高三第七次月考理综化学试题
西藏自治区拉萨市拉萨中学2020届高三第七次月考试理综化学
可能用到的相对原子质量:H—1 Li—7 B—11 C—12 N—14 O—16 F—19 S—32 K—39 Ca—40 Cu—64
7.下列关于文献记载的说法正确的是( )
A.《天工开物》中“世间丝麻裘褐皆具素质”,文中“丝、麻”的主要成分都是蛋白质
B.《肘后备急方》中“青蒿一握,以水二升渍,绞取汁”,该提取过程属于化学变化
C.《抱朴子》中“丹砂(HgS)烧之成水银,积变又还成丹砂”,描述的是升华和凝华过程
D.《本草纲目》中“用浓酒和糟入甑,蒸令气上,用器承滴露”,涉及的实验操作是蒸馏
8.为阿伏加德罗常数的值。下列说法正确的是( )
A.0.1 mol 的中,含有个中子
B.pH=1的H3PO4溶液中,含有个
C.2.24L(标准状况)苯在O2中完全燃烧,得到个CO2分子
D.密闭容器中1 mol PCl3与1 mol Cl2反应制备 PCl5(g),增加个P-Cl键
9.化合物(a)、(b)、(c)同属于薄荷系有机物,下列说法正确的是( )
A.a、b、c 都属于芳香族化合物 B.a、b、c都能使溴水褪色
C.由a生成c的反应是氧化反应 D.b、c互为同分异构体
10.短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是( )
A.原子半径:r(W) > r(Z) > r(Y)
B.由X、Y 组成的化合物中均不含共价键
C.Y 的最高价氧化物的水化物的碱性比Z的弱
D.X 的简单气态氢化物的热稳定性比W的强
实验
现象
结论
A
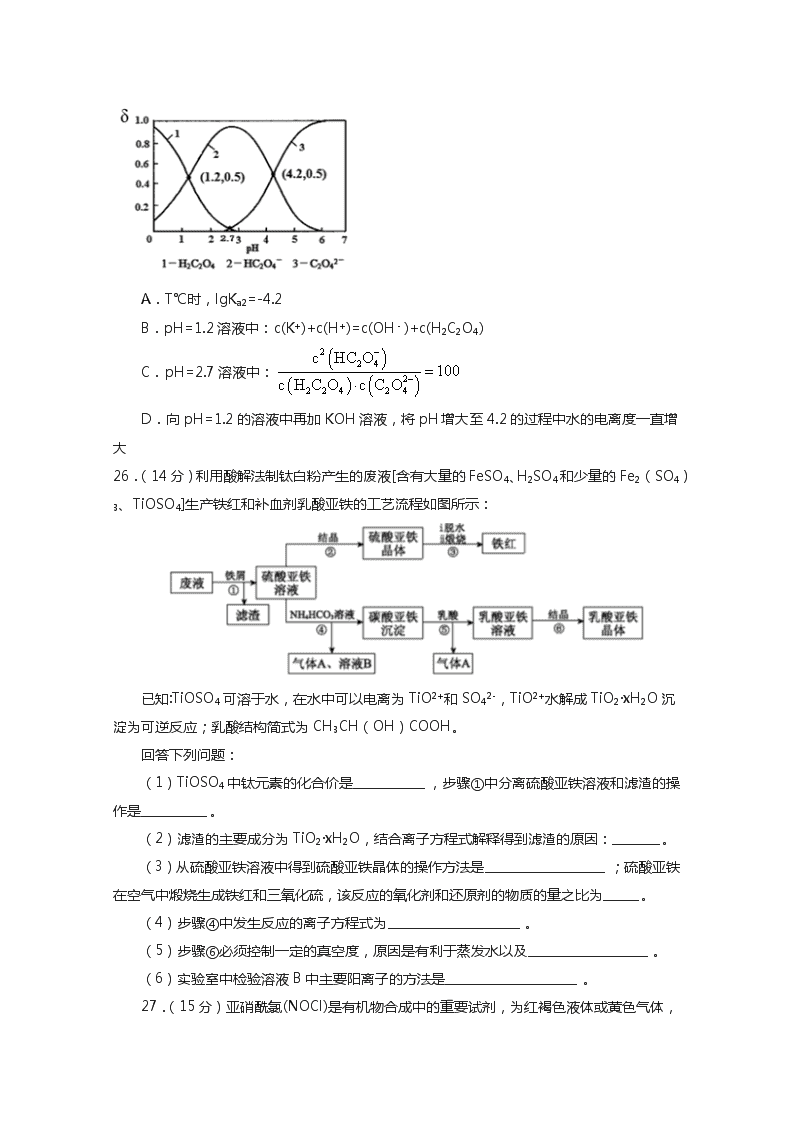
向2mL0.1mol·L-1的FeCl3溶液中加足量铁粉,振荡,加1滴KSCN溶液
黄色逐期消失,加KSCN溶液颜色不变
还原性:Fe>Fe2+
B
将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶
集气瓶中产生大量白烟,瓶内有黑色颗粒产生
CO2具有氧化性
C
加热盛有少NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸
石蕊试纸变蓝
NH4HCO3显碱性
D
向2支盛有2mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液
一只试管中产生黄色沉淀,另一支中无明显现象
Ksp(AgI)
”、“<”或“=”)。
(3)NO2存在如下平衡:2NO2(g)N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
一定温度下,k1、k2与平衡常数kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是k1=____________;在上图标出点中,指出能表示反应达到平衡状态的点是___,理由是________。
35.[化学——选修3:物质结构与性质](15分)
铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。回答下列问题:
(1)基态Fe3+的电子排布式为________。
(2)实验室用KSCN溶液、苯酚()检验Fe3+。N、O、S的第一电离能由大到小的顺序为_______(用元素符号表示),苯酚中碳原子的杂化轨道类型为______。
(3)FeCl3的熔点为306℃,沸点为315℃ FeCl3的晶体类型是______。FeSO4常作补铁剂,SO42-的立体构型是_______。
(4)羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等,1 mol Fe(CO)5分子中含σ键数目为_______,与CO互为等电子体的离子是__________(填化学式,写一种)
(5)氮化铁晶体的晶体结构示意图如图1所示。该晶体中铁、氮的微粒个数之比为______。
(6)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg·cm-1,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为_____;Fe2+与O2-的最短间距为_______ pm。
36.[化学——选修5:有机化学基础](15分)
有机物M是有机合成的重要中间体,制备M的一种合成路线如下(部分反应条件和试剂略去):
已知:①A的密度是相同条件下H2密度的38倍;其分子的核磁共振氢谱中有3组峰;
②(-NH2容易被氧化);
③R-CH2COOH
请回答下列问题:
(1)B的化学名称为______。A中官能团的电子式为______。
(2)CD的反应类型是______,I的结构简式为______。
(3)FG的化学方程式为______。
(4)M不可能发生的反应为______(填选项字母)。
a.加成反应 b.氧化反应 c.取代反应 d.消去反应
(5)请写出任意两种满足下列条件的E的同分异构体有______。
①能与FeCl3溶液发生显色反应②能与NaHCO3反应③含有-NH2
(6)参照上述合成路线,以为原料(无机试剂任选),设计制备的合成路线:______。
化学答案
一、选择题(42分)
7.D
8.A
9. D
10.D
11.C
12.D
13.C
二、非选择题
(一)必考题:共43分。
26.(14分)
(1)+4(1分) 过滤(1分)
(2)TiO2++(x+1)H2OTiO2•xH2O+2H+,铁屑与H+反应,c(H+)降低,平衡向正反应方向移动,促使TiO2+转化为TiO2•xH2O(2分)
(3)蒸发浓缩、冷却结晶、过滤(2分) 1: 4(2分)
(4)Fe2++2HCO3-===FeCO3↓+H2O+CO2↑(2分)
(5)防止Fe2+被氧化(2分)
(6)取少量溶液B于试管中,加人NaOH溶液,加热,将湿润的红色石蕊试纸靠近试管口,石蕊试纸变蓝,说明溶液B中含有NH4+(2分)
27.(15分)
(1)A或B(1分) MnO2+4H++2Cl-Mn2++Cl2↑+2H2O或2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O(2分)
(2)fgcbdejh(2分) 饱和食盐水(1分)
(3)①排除装置内空气的干扰;可以随开随用,随关随停(2分) ②K3(1分) 排尽三颈烧瓶中的空气防止NO和NOCl变质(2分) ③2NOCl+H2O===2HCl+NO↑+NO2↑(2分)
(4)14.7375c/m×100%或写成[c×22.5×10-3×10×65.5]/m×100%(2分)
28.(14分)
(1)①2NO(g)N2O2(g) △H=-(E3-E4)kJ·mol-1(2分) ②反应Ⅱ(1分) 温度升高后反应I平衡逆向移动,导致N2O2浓度减小,温度升高对反应Ⅱ的影响弱于N2O2浓度减小的影响,导致反应Ⅱ速度变慢,最终总反应速率变慢(2分)
(2)①0.56(2分) ②减小二氧化碳浓度(1分) ③<(1分)
(3)k1=2k2·KP(2分) BD(1分) 达到平衡时,N2O4与NO2的消耗速率满足条件v(NO2)=2v(N2O4)(2分)
35.(15分)
(1)1s22s22p63s23p63d5或[Ar] 3d5(2分) N>O>S(1分)
(2)sp2(1分)
(3)分子晶体(1分) 正四面体形(1分)
(4)10NA(1分) CN- 或C22-(2分)
(5)3∶1(2分)
(6)12(1分) (3分)
36.(15分)
(1)丙二醛(2分) (2分)
(2)取代反应(1分) (2分)
(3)+(CH3CO)2O+CH3COOH(2分)
(4)d(1分)
(5)、(符合要求均可)(2分)
(6)(3分)