- 2021-07-06 发布 |
- 37.5 KB |
- 6页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2012届高考化学二轮专题复习:实验专题训练(八)
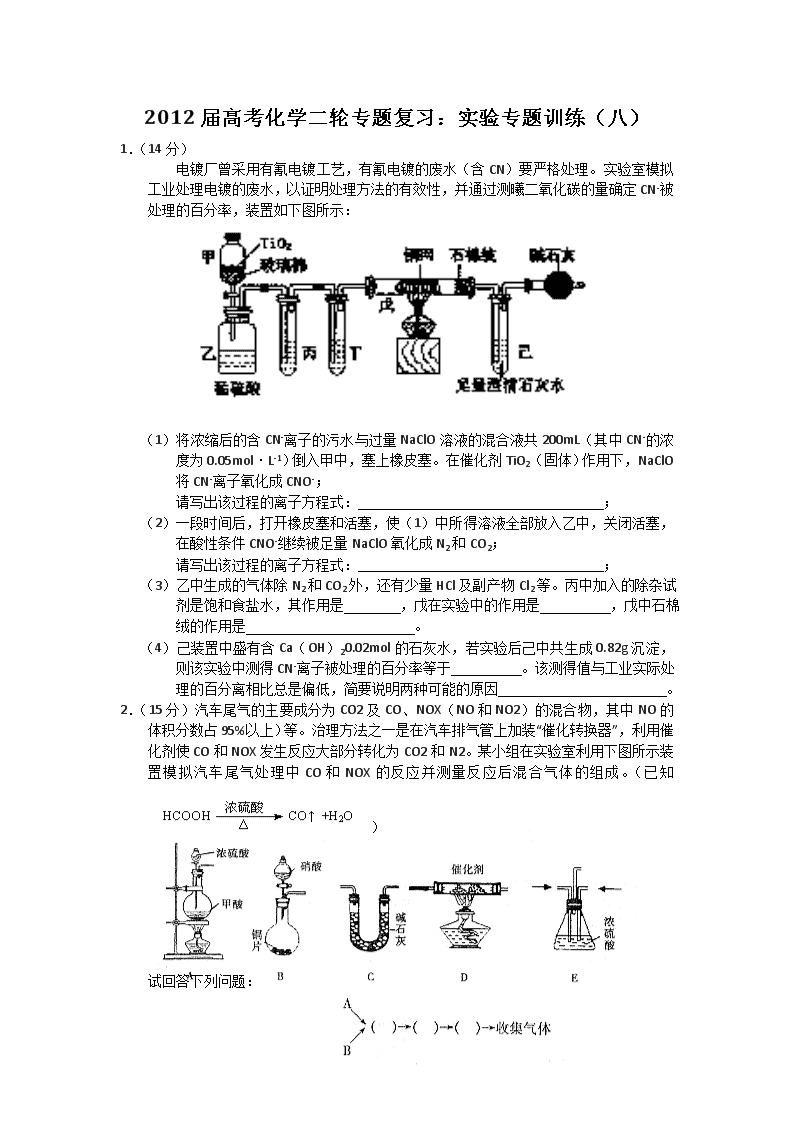
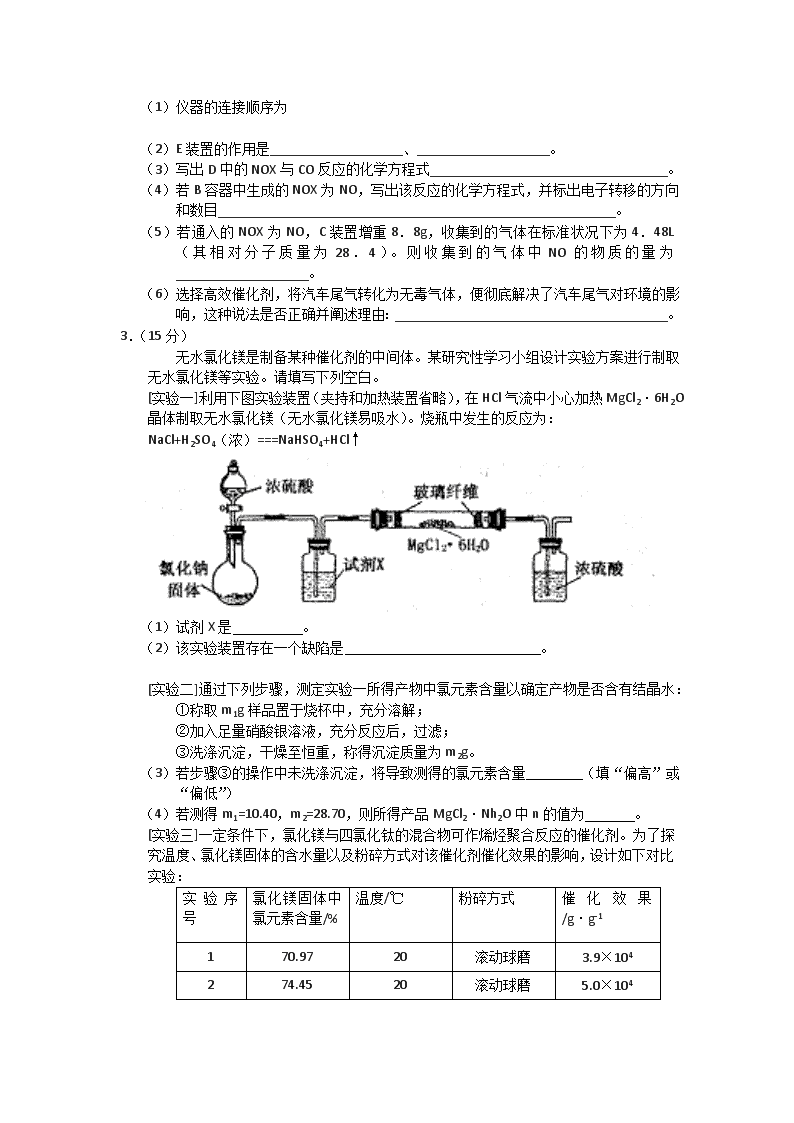
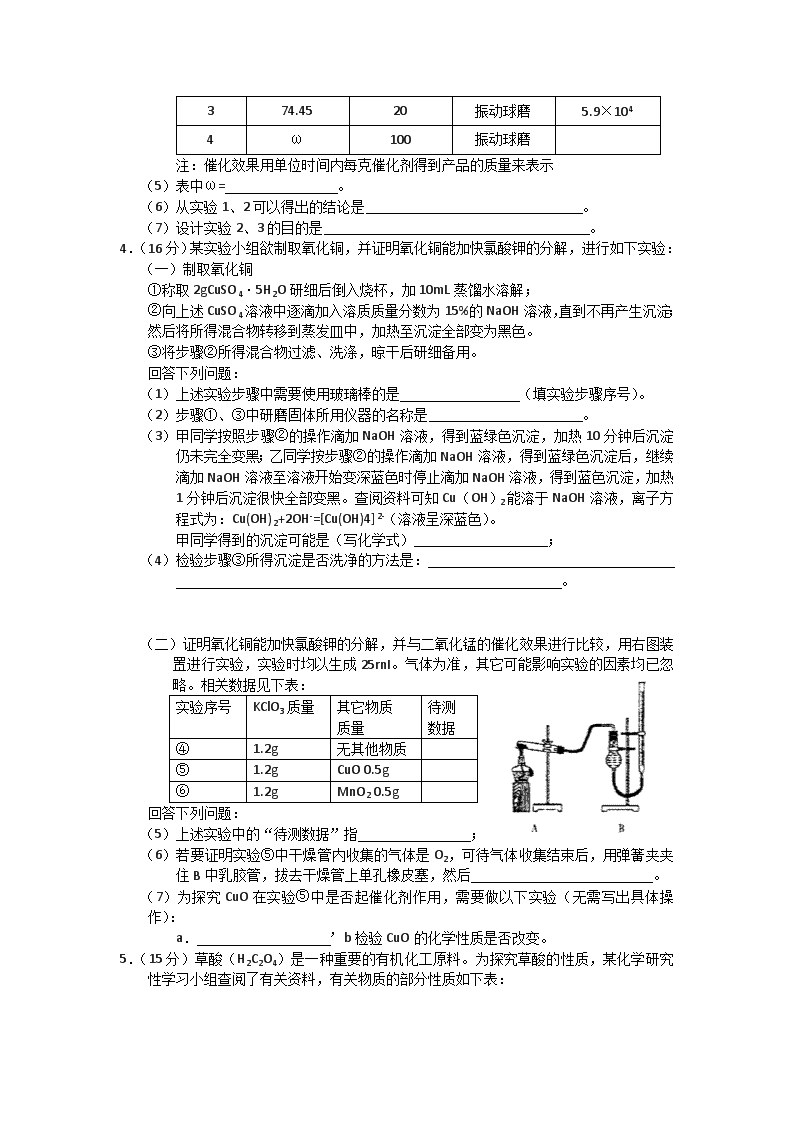
2012届高考化学二轮专题复习:实验专题训练(八) 1.(14分) 电镀厂曾采用有氰电镀工艺,有氰电镀的废水(含CN)要严格处理。实验室模拟工业处理电镀的废水,以证明处理方法的有效性,并通过测曦二氧化碳的量确定CN-被处理的百分率,装置如下图所示: (1)将浓缩后的含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.05mol·L-1)倒入甲中,塞上橡皮塞。在催化剂TiO2(固体)作用下,NaClO将CN-离子氧化成CNO-; 请写出该过程的离子方程式: ; (2)一段时间后,打开橡皮塞和活塞,使(1)中所得溶液全部放入乙中,关闭活塞,在酸性条件CNO-继续被足量NaClO氧化成N2和CO2; 请写出该过程的离子方程式: ; (3)乙中生成的气体除N2和CO2外,还有少量HCl及副产物Cl2等。丙中加入的除杂试剂是饱和食盐水,其作用是 ,戊在实验中的作用是 ,戊中石棉绒的作用是 。 (4)己装置中盛有含Ca(OH)20.02mol的石灰水,若实验后己中共生成0.82g沉淀,则该实验中测得CN-离子被处理的百分率等于 。该测得值与工业实际处理的百分离相比总是偏低,简要说明两种可能的原因 。 2.(15分)汽车尾气的主要成分为CO2及CO、NOX(NO和NO2)的混合物,其中NO的体积分数占95%以上)等。治理方法之一是在汽车排气管上加装“催化转换器”,利用催化剂使CO和NOX发生反应大部分转化为CO2和N2。某小组在实验室利用下图所示装置模拟汽车尾气处理中CO和NOX的反应并测量反应后混合气体的组成。(已知) 试回答下列问题: (1)仪器的连接顺序为 (2)E装置的作用是___________________、___________________。 (3)写出D中的NOX与CO反应的化学方程式__________________________________。 (4)若B容器中生成的NOX为NO,写出该反应的化学方程式,并标出电子转移的方向和数目_________________________________________________________。 (5)若通入的NOX为NO,C装置增重8.8g,收集到的气体在标准状况下为4.48L(其相对分子质量为28.4)。则收集到的气体中NO的物质的量为___________________。 (6)选择高效催化剂,将汽车尾气转化为无毒气体,便彻底解决了汽车尾气对环境的影响,这种说法是否正确并阐述理由:_______________________________________。 3.(15分) 无水氯化镁是制备某种催化剂的中间体。某研究性学习小组设计实验方案进行制取无水氯化镁等实验。请填写下列空白。 [实验一]利用下图实验装置(夹持和加热装置省略),在HCl气流中小心加热MgCl2·6H2O晶体制取无水氯化镁(无水氯化镁易吸水)。烧瓶中发生的反应为: NaCl+H2SO4(浓)===NaHSO4+HCl↑ (1)试剂X是 。 (2)该实验装置存在一个缺陷是 。 [实验二]通过下列步骤,测定实验一所得产物中氯元素含量以确定产物是否含有结晶水: ①称取m1g样品置于烧杯中,充分溶解; ②加入足量硝酸银溶液,充分反应后,过滤; ③洗涤沉淀,干燥至恒重,称得沉淀质量为m2g。 (3)若步骤③的操作中未洗涤沉淀,将导致测得的氯元素含量 (填“偏高”或“偏低”) (4)若测得m1=10.40,m2=28.70,则所得产品MgCl2·Nh2O中n的值为 。 [实验三]一定条件下,氯化镁与四氯化钛的混合物可作烯烃聚合反应的催化剂。为了探究温度、氯化镁固体的含水量以及粉碎方式对该催化剂催化效果的影响,设计如下对比实验: 实验序号 氯化镁固体中氯元素含量/% 温度/℃ 粉碎方式 催化效果/g·g-1 1 70.97 20 滚动球磨 3.9×104 2 74.45 20 滚动球磨 5.0×104 3 74.45 20 振动球磨 5.9×104 4 ω 100 振动球磨 注:催化效果用单位时间内每克催化剂得到产品的质量来表示 (5)表中ω= 。 (6)从实验1、2可以得出的结论是 。 (7)设计实验2、3的目的是 。 4.(16分)某实验小组欲制取氧化铜,并证明氧化铜能加快氯酸钾的分解,进行如下实验: (一)制取氧化铜 ①称取2gCuSO4·5H2O研细后倒入烧杯,加10mL蒸馏水溶解; ②向上述CuSO4溶液中逐滴加入溶质质量分数为15%的NaOH溶液,直到不再产生沉淀;然后将所得混合物转移到蒸发皿中,加热至沉淀全部变为黑色。 ③将步骤②所得混合物过滤、洗涤,晾干后研细备用。 回答下列问题: (1)上述实验步骤中需要使用玻璃棒的是 (填实验步骤序号)。 (2)步骤①、③中研磨固体所用仪器的名称是 。 (3)甲同学按照步骤②的操作滴加NaOH溶液,得到蓝绿色沉淀,加热10分钟后沉淀仍未完全变黑;乙同学按步骤②的操作滴加NaOH溶液,得到蓝绿色沉淀后,继续滴加NaOH溶液至溶液开始变深蓝色时停止滴加NaOH溶液,得到蓝色沉淀,加热1分钟后沉淀很快全部变黑。查阅资料可知Cu(OH)2能溶于NaOH溶液,离子方程式为:Cu(OH)2+2OH-=[Cu(OH)4]2-(溶液呈深蓝色)。 甲同学得到的沉淀可能是(写化学式) ; (4)检验步骤③所得沉淀是否洗净的方法是: 。 (二)证明氧化铜能加快氯酸钾的分解,并与二氧化锰的催化效果进行比较,用右图装置进行实验,实验时均以生成25rnI。气体为准,其它可能影响实验的因素均已忽略。相关数据见下表: 实验序号 KClO3质量 其它物质 质量 待测 数据 ④ 1.2g 无其他物质 ⑤ 1.2g CuO 0.5g ⑥ 1.2g MnO2 0.5g 回答下列问题: (5)上述实验中的“待测数据”指 ; (6)若要证明实验⑤中干燥管内收集的气体是O2,可待气体收集结束后,用弹簧夹夹住B中乳胶管,拔去干燥管上单孔橡皮塞,然后 。 (7)为探究CuO在实验⑤中是否起催化剂作用,需要做以下实验(无需写出具体操作): a. ’b检验CuO的化学性质是否改变。 5.(15分)草酸(H2C2O4)是一种重要的有机化工原料。为探究草酸的性质,某化学研究性学习小组查阅了有关资料,有关物质的部分性质如下表: 物质 熔点/℃ 化学性质 H2C2O4 189.5℃ 有毒,具有腐蚀性,易溶于水,二元弱酸。 100℃开始升华,157℃时开始分解。 草酸与浓硫酸混合加热产生CO2、CO和H2O。 草酸钙和草酸氢钙均为白色不溶物 [实验一]根据下图提供的仪器和试剂(可重复使用),设计实验证明草酸的受热分解产物中含有CO2和CO(部分夹持仪器和加热装置省略) (1)用字母表示接口的正确连接顺序。 a→b→c→( )→( )→d→e→( )→( )→( )→( )→尾气处理 (2)用上图提供的仪器和试剂做实验时,装置B中出现白色浑浊,也不能说明一定有CO2,原因是 ;请你提出改进意见 。 (3)利用改进后装置进行的实验时,要先加热 装置,(填“A”、“B”、“C”、“D”、“E”,下同)后加热 装置;能证明分解产物中有CO的实验依据是 。 [实验二] 探究草酸与酸性高锰酸钾的反应 (4) 向草酸溶液中逐滴加入硫酸酸化高锰酸钾溶液时,可观察到溶液由紫红色变为近乎无色,可推测草酸可能具有 。 (5)学习小组的同学发现,当向草酸溶液中逐滴加入硫酸酸化高锰酸钾溶液时,溶液褪色总是先慢后快。为探究其原因,同学们做了如下的对比实验: 实验序号 H2C2O4(aq) KMnO4(H+)(aq) MnSO4(S) (g) 褪色时间 (S) C(mol·L-1) V(mL) C(mol·L-1) V(mL) 实验1 0.1 2 0.01 4 0 30 实验2 0.1 2 0.01 4 5 4 该对比实验的结论是 。 参考答案 1.(14分) (1)ClO-+CN-=CNO-+ Cl- (2分) (2)2CNO-+ 3ClO- + 2H+ =3Cl-+2CO2↑ + N2 ↑+ H2O (2分) (3)除去HCl气体(2分);除去Cl2 (2分); 防止生成的CuCl2(烟)阻塞导管或进入己中影响测定准确度(2分); (4)82% (2分); ①装置(乙、丙、丁、戊)中可能滞留有CO2 ②CO2产生的速度较快未与己中的澄清石灰水充分反应 ; ③Cl2、HCl在丙、戊中未吸收完全。 (三点中任意答两点即可,每答对一点给1分,共2分) 2.(15分) (1) (3分) (2)①干燥混合气体(1分) ② 通过观察气泡,调节气体流速(1分) 6e- (3)2 NOx + 2x CO N2 + 2x CO2 (2分) (4)3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O(3分)(其它合理答案也给分) (5)0.04mol (3分) (6)不正确。(1分)①该反应为可逆反应,不能反应完全。②没达到“零碳排放”的目的,对气候的变化存在潜在的影响和危害。(1分) 3.(15分) (1)浓硫酸 (2分) (2)没有尾气处理装置 (2分) (3)偏高 (2分) (4) (3分) (5)74.45 (2分) (6)氯化镁固体含水量越高,催化剂催化效果越差 (2分) (7)探究粉碎方式对催化剂催化效果的影响 (2分) 4.(共16分) (1)①②③(3分,各1分) (2)研钵(1分) (3)Cu2(OH)2SO4(2分) (4)取洗涤液于试管中,用pH试纸测试的酸碱性,若溶液呈碱性,说明沉淀末洗净: (或滴加硝酸酸化的BaCl2 溶液,产生沉淀,说明沉淀末洗净;或用铂丝蘸取洗涤液作焰色实验,若火焰呈黄色,说明沉淀未洗净。)(答任意一种方法均可,3分,操作、现象、结果各1分) (5)时间(2分) (6)用带火星的木条伸入干燥管中,木条复燃,证明收集的是氧气。(3分,操作、现象、结果各1分) (7)检验CuO的质量是否改变(2分) 5.(15分)(1)a→b→c→( f)→( g)→d→e→(h )→(i )→(b )→(c )(2分) (2)草酸蒸气也可以使澄清石灰水变浑浊,无法确定二氧化碳的存在,故应在A前添加一个盛水的洗气瓶,除去草酸蒸气(或在烧瓶上连接冷凝管)(5分) (3)A E ; E中黑色氧化铜变红,E后的澄清石灰水变浑浊 (4分) (4)还原性(2分) (5)反应生成的Mn2+有催化作用,加快了反应速率(2分)查看更多