- 2021-07-06 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年四川省棠湖中学高一下学期期末模拟化学试题
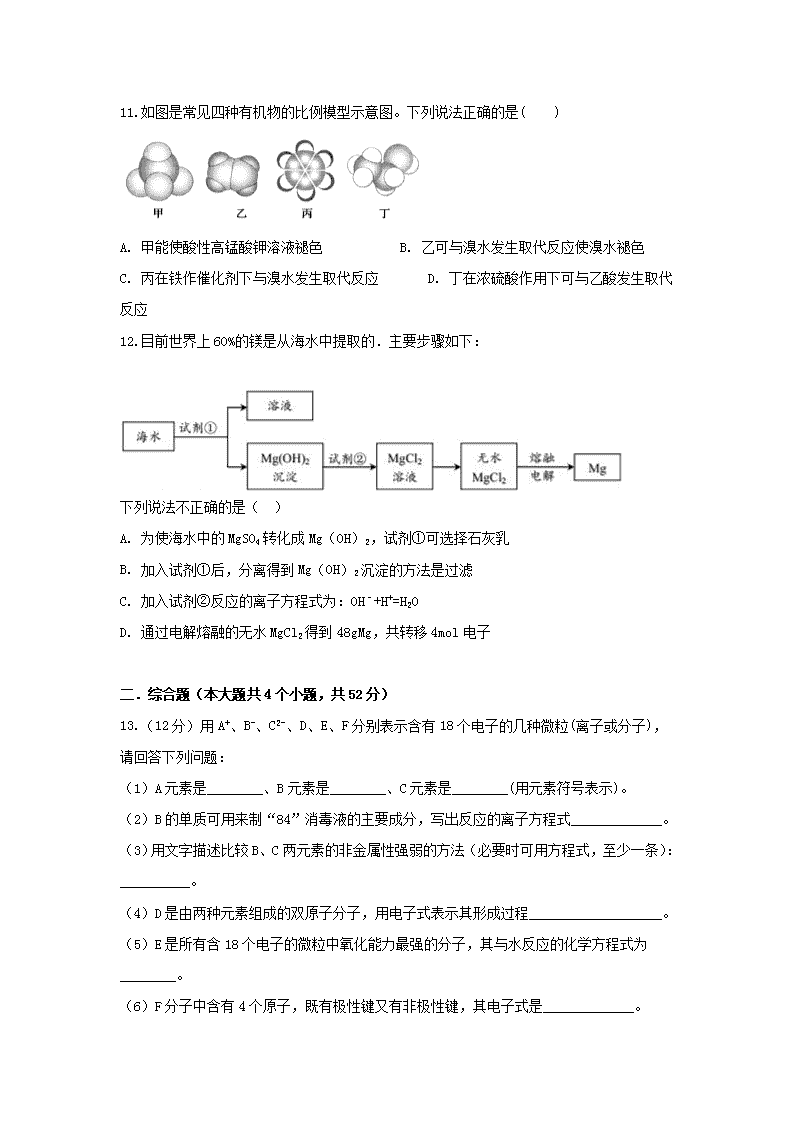
2018-2019学年四川省棠湖中学高一下学期期末模拟化学试题 试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题) 注意事项:1.答题前,考生务必在答题卡上将自己的姓名、班级、准考证号用0.5毫米黑色签字笔填写清楚,考生考试条码由监考老师粘贴在答题卡上的“条码粘贴处”。 2.选择题使用2B铅笔填涂在答题卡上对应题目标号的位置上,如需改动,用橡皮擦擦干净后再填涂其它答案;非选择题用0.5毫米黑色签字笔在答题卡的对应区域内作答,超出答题区域答题的答案无效;在草稿纸上、试卷上答题无效。 3.考试结束后由监考老师将答题卡收回。 一.选择题(本题共12小题,每小题4分;共48分,在每小题给出的四个选项中只有一项符合题目要求) 1.南京大屠杀死难者国家公祭鼎用青铜铸造。关于铜的一种核素Cu,下列说法正确的是( ) A. Cu的核电荷数为29 B. Cu的质子数为35 C. Cu的中子数为64 D. Cu的核外电子数为64 2.下列关于铝及其化合物叙述中,正确的是( ) A. 不能用铝制的器皿来盛放酸梅汤或碱水是因为铝会和酸或碱反应 B. 铝制品在空气中有很强的抗腐蚀性是因为铝的化学性质很稳定 C. 氯化铝溶液与NaOH溶液互滴现象完全相同 D. 纯铝比铝合金的硬度更大、熔点更低 3.用铝制易拉罐收集满 CO2,加入过量 NaOH 浓溶液,立即把口封闭。发现易拉罐“咔咔” 作响并变瘪了,过了一会儿,易拉罐又作响并鼓起来,下列有关判断正确的是( ) A.导致易拉罐变瘪的离子反应是 CO2+OH−==HCO3- B.导致易拉罐又鼓起来的原因是:又生成了二氧化碳气体使得压强增大 C.上述过程中共发生了三个化学反应,且反应结束后的溶液呈碱性 D.若将 CO2 换为 NH3,浓 NaOH 溶液换为水,易拉罐也会出现先瘪后鼓的现象 4.在含有Fe2+、Al3+、Fe3+、Na+的溶液中,加入足量的Na2O2 固体,充分反应后,再加入过量的稀盐酸,完全反应后,溶液中离子数目几乎没有变化的是( ) A. Fe2+ B. Al3+ C. Fe3+ D. Na+ 5.已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构.则下列叙述正确的是( ) A. 原子半径 A>B>D>C B. 原子序数 d>c>b>a C. 离子半径 C>D>B>A D. 原子结构的最外层电子数目 A>B>D>C 6.下列各项中表达正确的是( ) A. HCl的电子式: B. N2的结构式: C. H2S的电子式: D. 次氯酸的电子式: 7.下列化学用语的表达正确的是( ) A. Cl-的结构示意图: B. 醋酸铵的电离方程式:CH3COONH4 == CH3COOˉ+ NH4+ C. 漂白粉的有效成分是CaClO D. 中子数为20的氯原子: 8.有BaCl2和NaCl的混合溶液VL,将它分成两等份。一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl-完全沉淀。反应中消耗amolH2SO4、bmolAgNO3。则原混合溶液中的c(Na+)为( ) A. mol/L B. mol/L C. mol/L D. mol/L 9.根据下列反应的化学方程式:①I2+SO2+2H2O=H2SO4 +2HI;②2FeCl2+Cl2=2FeCl3;③2FeCl3+2HI=2FeCl2+2HCl+I2 判断有关物质的还原性强弱顺序是( ) A. I->Fe2+>Cl->SO2 B. Cl->Fe2+>SO2>I- C. Fe2+>I->Cl->SO2 D. SO2>I->Fe2+>Cl- 10.已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性,下列说法正确的是( ) A. X、Y、Z、W的原子半径依次减小 B. W与X形成的化合物中只含离子键 C. W的气态氢化物的沸点一定高于Z的气态氢化物的沸点 D. 若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3 11.如图是常见四种有机物的比例模型示意图。下列说法正确的是( ) A. 甲能使酸性高锰酸钾溶液褪色 B. 乙可与溴水发生取代反应使溴水褪色 C. 丙在铁作催化剂下与溴水发生取代反应 D. 丁在浓硫酸作用下可与乙酸发生取代反应 12.目前世界上60%的镁是从海水中提取的.主要步骤如下: 下列说法不正确的是( ) A. 为使海水中的MgSO4转化成Mg(OH)2,试剂①可选择石灰乳 B. 加入试剂①后,分离得到Mg(OH)2沉淀的方法是过滤 C. 加入试剂②反应的离子方程式为:OH﹣+H+=H2O D. 通过电解熔融的无水MgCl2得到48gMg,共转移4mol电子 二.综合题(本大题共4个小题,共52分) 13.(12分)用A+、B-、C2-、D、E、F分别表示含有18个电子的几种微粒(离子或分子),请回答下列问题: (1)A元素是________、B元素是________、C元素是________(用元素符号表示)。 (2)B的单质可用来制“84”消毒液的主要成分,写出反应的离子方程式_____________。 (3)用文字描述比较B、C两元素的非金属性强弱的方法(必要时可用方程式,至少一条):__________。 (4)D是由两种元素组成的双原子分子,用电子式表示其形成过程___________________。 (5)E是所有含18个电子的微粒中氧化能力最强的分子,其与水反应的化学方程式为________。 (6)F分子中含有4个原子,既有极性键又有非极性键,其电子式是_____________。 14.(14分)下表为元素周期表的一部分, 表中列出10种元素在周期表中的位置,按要求回答下列各题。 族 周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0 2 ⑧ ⑩ 3 ① ③ ⑤ ⑥ ⑦ ⑨ 4 ② ④ (1)写出下列序号所代表的元素符号③_____;⑩______ (2)写出⑥的一种用途_________________;常温下可与表中_______单质反应(填化学式) (3)元素④的原子结构示意图为________________________; (4)⑤和⑨形成的化合物的化学式为:_____________;向该化合物的水溶液里逐滴滴入苛性钠溶液,现象为__________________________________________________. (5)②⑤⑦⑧的原子半径由大到小的顺序是__________________________(用元素符号表示) (6)将①⑤同时投入到水中,发生反应的化学方程式有:______________ 15.(12分)Ⅰ.我国的青海省有许多盐湖盛产食盐,人类与食盐关系密切,食盐在老百姓生活和现代社会的工农业生产中均有重要作用。粗盐中含Ca2+、Mg2+、SO42-以及泥沙等杂质,为了除去可溶性杂质,有以下实验步骤进行提纯: ①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液。 (1)以下操作顺序不合理的是 _______。 A.②⑤④③① B.④⑤②①③ C.⑤②④①③ D.⑤④②①③ (2)用提纯的NaCl配制450 mL 4.00 mol·L-1NaCl溶液,所用仪器除天平、药匙、烧杯、玻璃棒外还有________(填仪器名称)。 (3)通过步骤①中过滤后的滤液,检验SO42-是否除尽的操作方法是_________________________ Ⅱ.向100 mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入2.0 mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。回答下列问题: (1)图1中通入CO2后所得溶液的溶质成分为____________________; (2)图3中通入CO2后所得溶液的溶质成分为____________________。 Ⅲ.已知氮化镁极易与水反应:Mg3N2+6H2O===2NH3↑+3Mg(OH)2↓。将足量的镁条置于空气燃烧,可能会发生下列反应①2Mg+O22MgO;②3Mg+N2Mg3N2;③2Mg+CO22MgO+C;④Mg+H2O(g)MgO+H2。请设计一个实验,验证产物中含有氮化镁(Mg3N2):_________________________。 16.(14分)工业生产需要大量原料,消耗大量能源,在得到所需产品同时产生了大量废气、废水、废渣。某工厂排放的废水中含有Cu2+、Fe2+、Hg2+、H+等离子,某化学小组为了充分利用资源和保护环境,准备回收废水中的铜和汞,同时得到绿矾。他们设计了如下实验方案: (1)现有仪器:酒精灯、玻璃棒、坩埚、蒸发皿、蒸馏烧瓶、烧杯、铁架台等,完成步骤Ⅳ的实验操作还需要选择的玻璃仪器是__________设计简单实验检验绿矾是否变质,简述你的操作:__________。 (2)步骤Ⅰ中加入过量铁粉的目的是__________,步骤Ⅱ中__________(填“能”或“不能”)用盐酸代替硫酸。 (3)步骤V利用氧化铜制取铜有如下四种方案: 方案甲:利用氢气还原氧化铜; 方案乙:利用一氧化碳还原氧化铜; 方案丙:利用炭粉还原氧化铜; 方案丁:先将氧化铜溶于稀硫酸,然后加入过量的铁粉、过滤,再将滤渣溶于过量的稀硫酸,再过滤、洗涤、烘干。 从安全角度考虑,方案__________不好;从产品纯度考虑,方案__________不好。 (4)写出步骤Ⅱ中涉及反应的离子方程式:__________;步骤Ⅳ得到绿矾的操作蒸发浓缩__________、__________。 四川省棠湖中学2018-2019学年下高一年级期末模拟考试 化学试题答案 1.A 2.A 3.C 4.B 5.C 6.B 7.B 8.A 9.D 10.A 11.D 12.C 13. K Cl S Cl2+2OH-=Cl-+ClO-+H2O Cl2+S2-=2Cl-+S或Cl2+H2S=2HCl+S 2F2+2H2O=4HF+O2 14.Mg Ne 半导体等 F2 AlCl3 先有白色沉淀产生,而后沉淀溶解 K > Al > P> F 2Na + 2H2O = 2NaOH + H2 ↑、2Al + 2NaOH +6H2O = 2 Na[Al(OH)4] +3 H2 ↑ 15.AB 500 mL容量瓶、胶头滴管 取少量滤液于一支试管中,滴加BaCl2溶液,若试管中的溶液无明显变化则证明SO42-已除尽,若试管中的溶液出现浑浊则证明SO42-未除尽。 Na2CO3 Na2CO3和NaOH 取适量产物放入试管中,滴加蒸馏水,将润湿的红色石蕊试纸靠近试管口,如果红色石蕊试纸变蓝,则可以证明有氮化镁生成 16. 漏斗 取产品少量溶于水,加入KSCN溶液,如溶液变血红色,则产品变质 将Cu2+ Hg2+全部置换出来 不能 甲 乙 丙 Fe+2H+=Fe2+ +H2↑ 冷却结晶 过滤查看更多