- 2021-07-06 发布 |
- 37.5 KB |
- 16页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届一轮复习人教版一定物质的量浓度的溶液及其配制学案(1)
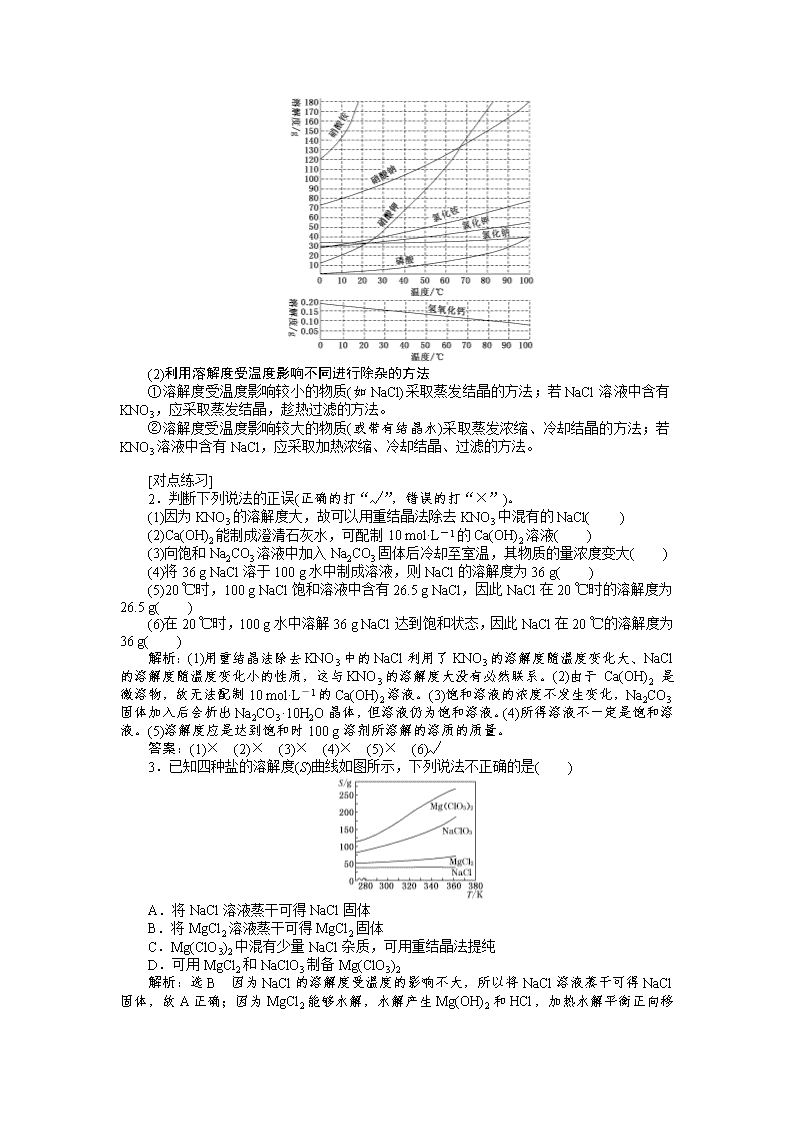
第二节 一定物质的量浓度的溶液及其配制 [高考导航] 1.了解溶解度、饱和溶液的概念。 2.了解物质的量浓度的含义。 3.能按要求配制一定物质的量浓度的溶液,会进行有关误差分析。 4.会根据物质的量与溶液的体积、溶液的物质的量浓度之间的相互关系进行有关计算。 学案一 物质的量浓度及相关计算 1.物质的量浓度 (1)概念:表示单位体积溶液里所含溶质B的物质的量的物理量,符号为cB。 (2)表达式:cB=。 (3)单位:mol·L-1或mol/L。 (4)相同浓度溶液中某些物理量之间的关系 现有两种溶液:①1 mol·L-1KCl溶液、②1 mol·L-1 BaCl2溶液,请用“相同”或“不同”填写下表 取不同体积的KCl溶液 取相同体积的两种溶液 c(溶质) 相同 相同 ρ(溶液) 相同 不同 n(溶质) 不同 相同 m(溶质) 不同 不同 2.溶解度 (1)固体的溶解度(S) 定义 在一定温度下,某固体物质在100 g溶剂里达到饱和状态时所溶解溶质的质量,叫做这种物质在这种溶剂里的溶解度 关键词 ①条件:在一定温度下;②标准:100_g溶剂; ③状态:饱和状态;④单位:g 影响 因素 ①内因:物质本身的性质(由结构决定)。 ②外因:a.溶剂的影响(如NaCl易溶于水不易溶于汽油);b.温度的影响:升温,大多数固体物质的溶解度增大,少数物质却相反,如Ca(OH)2;温度对NaCl的溶解度影响不大 (2)气体的溶解度 通常指该气体(其压强为101 kPa)在一定温度下溶解于1体积水里达到饱和状态时气体的体积,常记为1∶x。如NH3、HCl、SO2、CO2等气体常温时的溶解度分别为1∶700、1∶500、1∶40、1∶1。 气体溶解度的大小与温度和压强有关,温度升高,溶解度减小,压强增大,溶解度增大。 1.防范物质的量浓度相关计算的4个易错点 (1)溶液中溶质判断错误 ①与水反应的物质,如SO3溶于水后变为H2SO4且水量减少。 ②含结晶水的物质,如CuSO4·5H2O溶于水,其溶质是CuSO4且水的量会增加。 ③溶质发生变化,如弱酸、弱碱和可水解的盐,溶质的离子组成会发生变化。 (2)混淆溶液体积和溶剂体积 ①不能用水的体积代替溶液的体积,尤其是固体、气体溶于水。 ②溶液混合体积会发生变化。 (3)一定物质的量浓度溶液的稀释与混合 ①溶液稀释定律(守恒观点) a.溶质的质量在稀释前后保持不变,即m1w1=m2w2。 b.溶质的物质的量在稀释前后保持不变,即c1V1=c2V2。 c.溶液质量守恒,m(稀)=m(浓)+m(水)(体积一般不守恒)。 ②同溶质不同物质的量浓度的溶液的混合计算 a.混合后溶液体积保持不变时,c1V1+c2V2=c混×(V1+V2)。 b.混合后溶液体积发生改变时,c1V1+c2V2=c混V混,其中V混=。 (4)部分与整体的关系 溶质的浓度和离子的浓度不同,要注意根据化学式具体分析计算,如1 mol·L-1的Al2(SO4)3溶液中SO的物质的量浓度是 3_mol·L-1。 [对点练习] 1.判断下列说法的正误(正确的打“√”,错误的打“×”)。 (1)32.2 g Na2SO4·10H2O溶于67.8 g水中,w(Na2SO4)=32.2%( ) (2)31 g Na2O溶于水,配成1 L溶液,c(Na2O)=0.5 mol·L-1( ) (3)标准状况下22.4 L HCl溶于1 L水,盐酸的物质的量浓度为1 mol·L-1( ) (4)欲配制1.00 L 1.00 mol·L-1的NaCl溶液,可将 58.5 g NaCl溶于1.00 L水中( ) (5)将10 mL 1 mol·L-1的H2SO4稀释成0.1 mol·L-1的H2SO4,可向该溶液中加入90 mL水( ) (6)将1 mol·L-1的NaCl溶液和0.5 mol·L-1的BaCl2溶液等体积混合后,不考虑体积变化c(Cl-)=0.75 mol·L-1( ) (7)1 L 0.5 mol·L-1CaCl2溶液中,Ca2+与Cl-的物质的量浓度都是0.5 mol·L-1( ) 解析:(1)溶质为Na2SO4,m(Na2SO4)=×32.2 g=14.2 g,w(Na2SO4)=×100%=×100%=14.2%。(2)Na2O溶于水生成NaOH,溶质为NaOH,而不是Na2O。(3)HCl溶于水后,没指出溶液的密度,无法计算溶液的体积,无法求 c(HCl)。(4)加入水的体积是1 L,形成的NaCl溶液的体积不是1 L。(5)应该加入水形成100 mL溶液。(6)二者 c(Cl-)是相等的,混合后不考虑体积变化,c(Cl-) 不变,仍为 1 mol·L-1。(7)Cl-的物质的量浓度是 1.0 mol·L-1。 答案:(1)× (2)× (3)× (4)× (5)× (6)× (7)× 2.溶解度及溶解度曲线的应用 (1)溶解度曲线 (2)利用溶解度受温度影响不同进行除杂的方法 ①溶解度受温度影响较小的物质(如NaCl)采取蒸发结晶的方法;若NaCl溶液中含有KNO3,应采取蒸发结晶,趁热过滤的方法。 ②溶解度受温度影响较大的物质(或带有结晶水)采取蒸发浓缩、冷却结晶的方法;若KNO3溶液中含有NaCl,应采取加热浓缩、冷却结晶、过滤的方法。 [对点练习] 2.判断下列说法的正误(正确的打“√”,错误的打“×”)。 (1)因为KNO3的溶解度大,故可以用重结晶法除去KNO3中混有的NaCl( ) (2)Ca(OH)2能制成澄清石灰水,可配制10 mol·L-1的Ca(OH)2溶液( ) (3)向饱和Na2CO3溶液中加入Na2CO3固体后冷却至室温,其物质的量浓度变大( ) (4)将36 g NaCl溶于100 g水中制成溶液,则NaCl的溶解度为36 g( ) (5)20 ℃时,100 g NaCl饱和溶液中含有26.5 g NaCl,因此NaCl在20 ℃时的溶解度为26.5 g( ) (6)在20 ℃时,100 g水中溶解36 g NaCl达到饱和状态,因此NaCl在20 ℃的溶解度为36 g( ) 解析:(1)用重结晶法除去KNO3中的NaCl利用了KNO3的溶解度随温度变化大、NaCl的溶解度随温度变化小的性质,这与KNO3的溶解度大没有必然联系。(2)由于 Ca(OH)2 是微溶物,故无法配制10 mol·L-1的Ca(OH)2溶液。(3)饱和溶液的浓度不发生变化,Na2CO3固体加入后会析出Na2CO3·10H2O晶体,但溶液仍为饱和溶液。(4)所得溶液不一定是饱和溶液。(5)溶解度应是达到饱和时100 g溶剂所溶解的溶质的质量。 答案:(1)× (2)× (3)× (4)× (5)× (6)√ 3.已知四种盐的溶解度(S)曲线如图所示,下列说法不正确的是( ) A.将NaCl溶液蒸干可得NaCl固体 B.将MgCl2溶液蒸干可得MgCl2固体 C.Mg(ClO3)2中混有少量NaCl杂质,可用重结晶法提纯 D.可用MgCl2和NaClO3制备Mg(ClO3)2 解析:选B 因为NaCl的溶解度受温度的影响不大,所以将NaCl溶液蒸干可得NaCl固体,故A正确;因为MgCl2能够水解,水解产生Mg(OH)2 和HCl,加热水解平衡正向移动,HCl易挥发,所以将MgCl2溶液蒸干可得固体 Mg(OH)2,故B错误;因为 Mg(ClO3)2的溶解度随温度升高而增大且受温度影响变化较大,NaCl的溶解度随温度升高而减小且受温度影响较小,所以 Mg(ClO3)2中混有少量NaCl杂质,可用重结晶法提纯,故C正确;反应MgCl2+2NaClO3===Mg(ClO3)2+2NaCl类似于侯德榜制碱法生成 NaHCO3的原理,因为NaCl溶解度小而从溶液中析出,使反应向生成Mg(ClO3)2的方向进行,故D正确。 3.掌握物质的量浓度与其他量的换算 (1)物质的量浓度和质量分数的关系 如图所示,体积为 V L,密度为ρ g·cm-3的溶液,含有摩尔质量为M g·mol-1的溶质m g,溶质的质量分数为w,则物质的量浓度c与质量分数w的关系是:c=====,w=。 (2)物质的量浓度与溶解度的换算 若某饱和溶液的密度为ρ g·cm-3,溶质的摩尔质量为 M g·mol-1,溶解度为S g,则溶解度S与物质的量浓度的关系是:c===;S=。 [对点练习] 4.(2017·江西六校联考)体积为V(mL)、密度为ρ(g·cm-3)的溶液,含有摩尔质量为M的溶质质量为m(g),物质的量浓度为c,质量分数为w。下列表达式中不正确的是( ) A.c= B.m=V·ρ· C.w= D.c= 解析:选B 已知溶质摩尔质量、质量分数和溶液密度时,c=的含义为1 L溶液中所含溶质的物质的量;若已知溶质摩尔质量、溶液的物质的量浓度和溶液密度时,可计算出溶质质量分数w=,其含义为1 L溶液中,溶质占溶液的质量分数,故A、C选项正确;B选项中求溶质质量,应通过溶液体积、密度、质量分数三者相乘而得,即m=V·ρ·w,故B选项错误;D选项是根据物质的量浓度的定义,由溶质质量、溶质摩尔质量和溶液体积计算而得,即c==,故D选项正确。 5.已知某饱和NaCl溶液的体积为V mL,密度为ρ g·cm-3,质量分数为w,物质的量浓度为 c mol·L-1,溶液中含NaCl的质量为m g。 (1)用m、V表示溶液的物质的量浓度_________________________________。 (2)用w、ρ表示溶液的物质的量浓度__________________________________。 (3)用c、ρ表示溶质的质量分数_______________________________________。 (4)用w表示该温度下NaCl的溶解度__________________________________。 解析:(1)c== mol·L-1。 (2)c== mol·L-1。 (3)w=×100%= ×100%。 (4)=,S= g。 答案:(1) mol·L-1 (2) mol·L-1 (3)×100% (4) g [学案验收·块块过] 1.若20 g密度为ρ g·cm-3 的Ca(NO3)2溶液中含有2 g Ca(NO3)2,则溶液中NO的物质的量浓度为( ) A. mol·L-1 B. mol·L-1 C. mol·L-1 D. mol·L-1 解析:选C Ca(NO3)2的物质的量浓度为= mol·L-1,NO的物质的量浓度为 mol·L-1。 2.V L Fe2(SO4)3溶液中含有a g SO,取此溶液 0.5V L,用水稀释至2V L,则稀释后溶液中Fe3+的物质的量浓度为( ) A. mol·L-1 B. mol·L-1 C. mol·L-1 D. mol·L-1 解析:选A 依题意知,c(SO)= mol·L-1,c(Fe3+)== mol·L-1,故有×0.5V=2V×cB,cB= mol·L-1。 3.将标准状况下的a L氯化氢气体溶于100 g水中,得到的盐酸的密度为b g·mL-1,则该盐酸的物质的量浓度(mol·L-1)是( ) A. B. C. D. 解析:选C 根据c=进行计算,n= mol,V=,可知C正确。 4.质量分数为a的某物质的溶液m g与质量分数为b的该物质的溶液n g混合后,蒸发掉p g 水,得到的溶液密度为q g·cm-3(此过程中无溶质析出),物质的量浓度为c mol·L-1。则溶质的相对分子质量为( ) A. B. C. D. 解析:选C 溶质的摩尔质量M==== g·mol-1,相对分子质量在数值上与摩尔质量相等。 5.(2017·豫南九校联考)t ℃时,CuSO4在水中溶解度为25 g,将32 g CuSO4白色粉末加入到m g水中,形成饱和CuSO4溶液,并有CuSO4·5H2O晶体析出,则m的取值范围是( ) A.18 g≤m≤128 g B.36 g查看更多