- 2021-07-06 发布 |
- 37.5 KB |
- 10页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学一轮复习化学反应速率和化学平衡图像解题方法作业
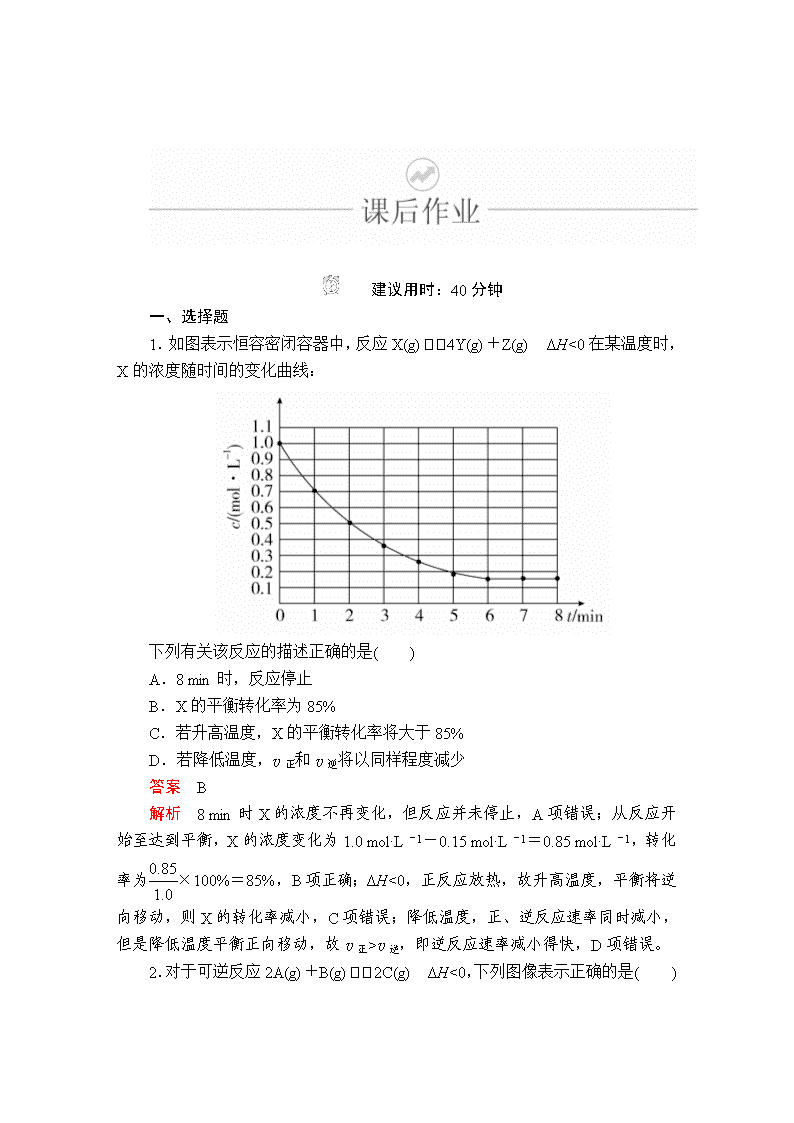
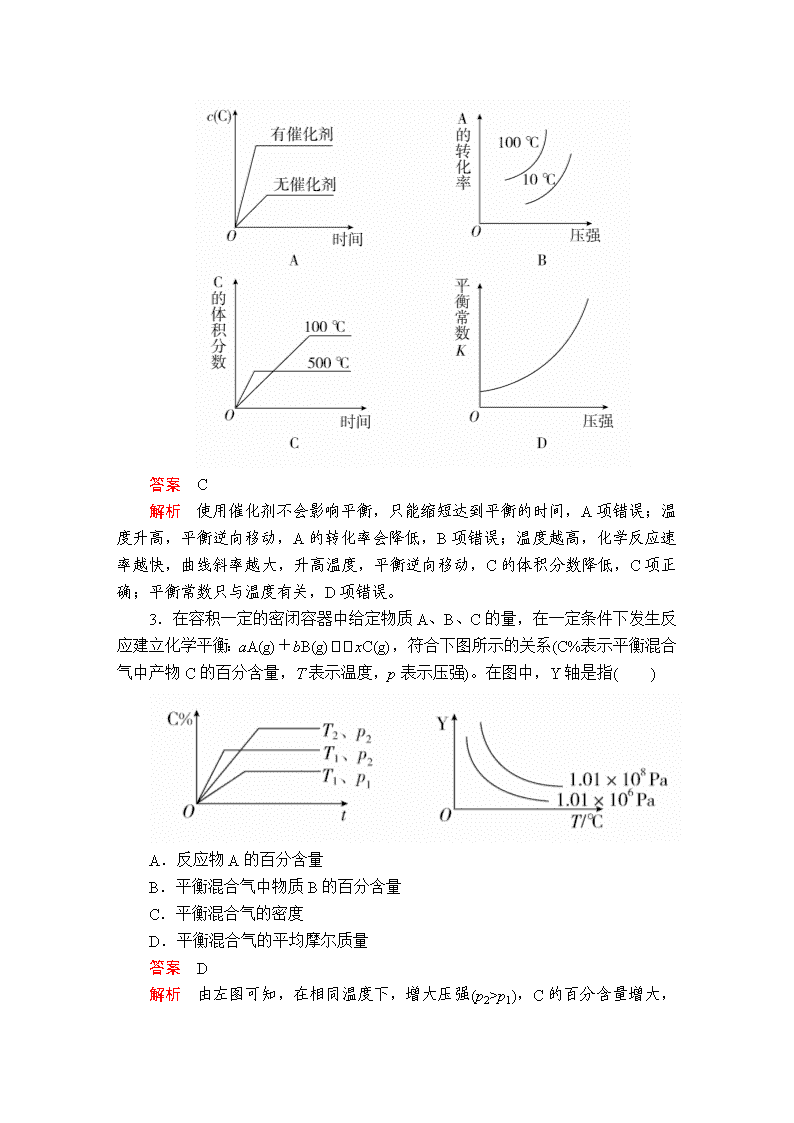
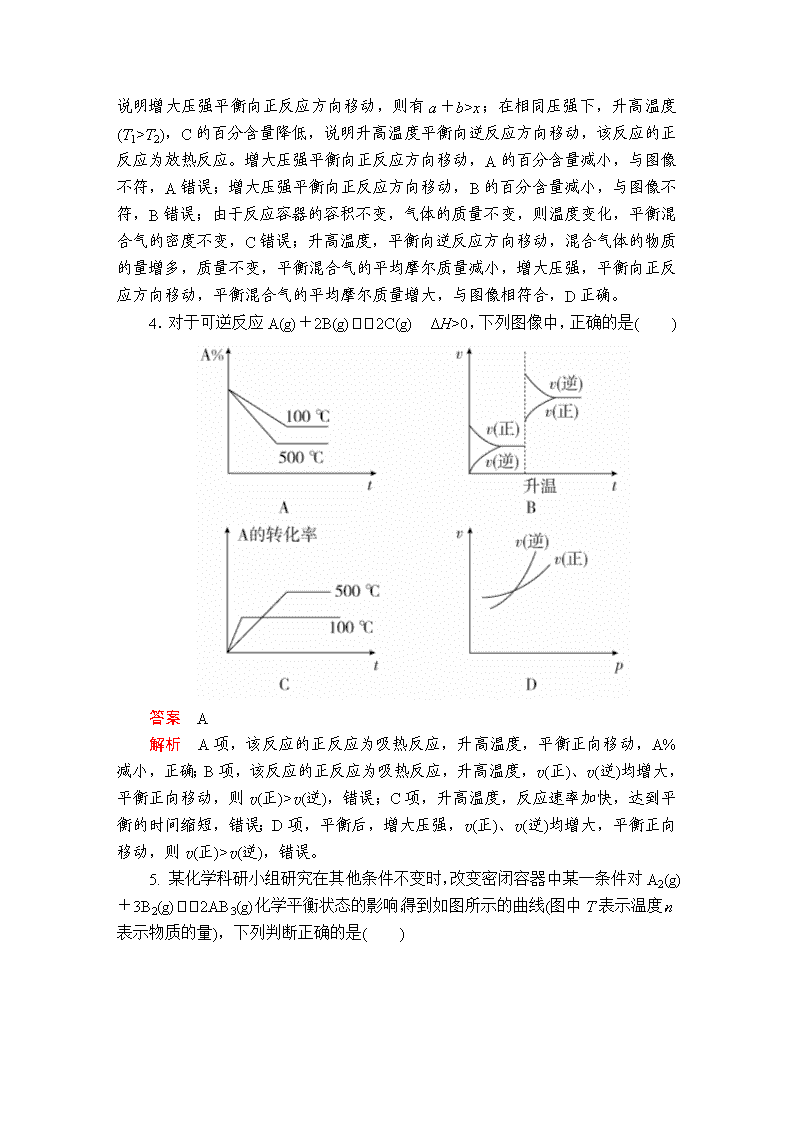
建议用时:40分钟 一、选择题 1.如图表示恒容密闭容器中,反应X(g)4Y(g)+Z(g) ΔH<0在某温度时,X的浓度随时间的变化曲线: 下列有关该反应的描述正确的是( ) A.8 min时,反应停止 B.X的平衡转化率为85% C.若升高温度,X的平衡转化率将大于85% D.若降低温度,v正和v逆将以同样程度减少 答案 B 解析 8 min时X的浓度不再变化,但反应并未停止,A项错误;从反应开始至达到平衡,X的浓度变化为1.0 mol·L-1-0.15 mol·L-1=0.85 mol·L-1,转化率为×100%=85%,B项正确;ΔH<0,正反应放热,故升高温度,平衡将逆向移动,则X的转化率减小,C项错误;降低温度,正、逆反应速率同时减小,但是降低温度平衡正向移动,故v正>v逆,即逆反应速率减小得快,D项错误。 2.对于可逆反应2A(g)+B(g)2C(g) ΔH<0,下列图像表示正确的是( ) 答案 C 解析 使用催化剂不会影响平衡,只能缩短达到平衡的时间,A项错误;温度升高,平衡逆向移动,A的转化率会降低,B项错误;温度越高,化学反应速率越快,曲线斜率越大,升高温度,平衡逆向移动,C的体积分数降低,C项正确;平衡常数只与温度有关,D项错误。 3.在容积一定的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立化学平衡:aA(g)+bB(g)xC(g),符合下图所示的关系(C%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指( ) A.反应物A的百分含量 B.平衡混合气中物质B的百分含量 C.平衡混合气的密度 D.平衡混合气的平均摩尔质量 答案 D 解析 由左图可知,在相同温度下,增大压强(p2>p1 ),C的百分含量增大,说明增大压强平衡向正反应方向移动,则有a+b>x;在相同压强下,升高温度(T1>T2),C的百分含量降低,说明升高温度平衡向逆反应方向移动,该反应的正反应为放热反应。增大压强平衡向正反应方向移动,A的百分含量减小,与图像不符,A错误;增大压强平衡向正反应方向移动,B的百分含量减小,与图像不符,B错误;由于反应容器的容积不变,气体的质量不变,则温度变化,平衡混合气的密度不变,C错误;升高温度,平衡向逆反应方向移动,混合气体的物质的量增多,质量不变,平衡混合气的平均摩尔质量减小,增大压强,平衡向正反应方向移动,平衡混合气的平均摩尔质量增大,与图像相符合,D正确。 4.对于可逆反应A(g)+2B(g)2C(g) ΔH>0,下列图像中,正确的是( ) 答案 A 解析 A项,该反应的正反应为吸热反应,升高温度,平衡正向移动,A%减小,正确;B项,该反应的正反应为吸热反应,升高温度,v(正)、v(逆)均增大,平衡正向移动,则v(正)>v(逆),错误;C项,升高温度,反应速率加快,达到平衡的时间缩短,错误;D项,平衡后,增大压强,v(正)、v(逆)均增大,平衡正向移动,则v(正)>v(逆),错误。 5. 某化学科研小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g)2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量),下列判断正确的是( ) A.若T2>T1,则正反应一定是放热反应 B.达到平衡时,A2的转化率大小为b>a>c C.若T2>T1,达到平衡时b、d点的反应速率为vd>vb D.在T2和n(A2)不变时达到平衡,AB3的物质的量大小为c>b>a 答案 D 解析 若T2>T1,由图像可知,温度升高,生成物的物质的量增大,说明升高温度平衡向正反应方向移动,则正反应为吸热反应,A错误;根据图像可知,a、b、c各点中B2的起始物质的量依次增大,对于可逆反应来说,其他条件不变,增大一种反应物的物质的量或浓度,有利于平衡向正反应方向移动,则另一种反应物的转化率增大,则达到平衡时A2的转化率大小为a<b<c,B错误;温度越高,反应速率越快,若温度T2>T1,达到平衡时b、d点的反应速率为vd<vb,C错误;对于可逆反应来说,增大一种反应物的物质的量,有利于平衡向正反应方向移动,生成物的物质的量增多,所以达到平衡时,AB3的物质的量大小为c>b>a,D正确。 6.臭氧是理想的烟气脱硝试剂,其脱硝反应为2NO2(g)+O3(g)N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( ) 答案 A 解析 A项,由图像可知,该可逆反应的正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小,正确;v(NO2)===0.2 mol·L-1·s-1,B项单位错误;使用催化剂可加快反应速率,但不能使平衡发生移动,C项错误;D项,若x为c(O2),则O2浓度增大,NO2的转化率减小,与图像不符,D项错误。 二、非选择题 7.(2018·郑州市质检一) 在密闭、固定容积的容器中,一定量NO发生分解的过程中,NO的转化率随时间的变化关系如图所示。 (1)反应2NO(g)N2(g)+O2(g) ΔH________(填“>”或“<”)0。 (2)一定温度下,能够说明反应2NO(g)N2(g)+O2(g)已达到化学平衡的是________(填序号)。 a.容器内的压强不发生变化 b.混合气体的密度不发生变化 c.NO、N2、O2的浓度保持不变 d.2v(NO)正=v(N2)逆 答案 (1)< (2)c 解析 (1)根据题图,T2时先达到平衡,则T2>T1。T2→T1,温度降低,NO的平衡转化率增大,说明平衡向正反应方向移动,而降温时平衡向放热反应方向移动,故正反应为放热反应,ΔH<0。 (2)该反应在反应前后气体分子数不变,容器内压强始终不变,故压强不变不能说明反应达到平衡,a错误;反应体系中全为气体,气体质量不变,容器容积固定,气体的密度始终不变,故密度不变不能说明反应达到平衡,b错误;NO、N2、O2的浓度不变可以说明反应达到平衡,c正确;v(NO)正=2v(N2)逆时反应达到平衡,d错误。 8.(2018·唐山市一模)氮的氧化物是大气的主要污染物,是当前环保工作的重要研究内容之一。 (1)氨气还原氮的氧化物 ①N2(g)+O2(g)===2NO(g) ΔH1 ②4NH3(g)+3O2(g)===2N2(g)+6H2O(l) ΔH2 则4NH3(g)+6NO(g)===5N2(g)+6H2O(l) ΔH=________。(用含ΔH1、ΔH2的式子表示) 依据反应② ,可将氨气直接用于燃料电池,用KOH溶液作电解质溶液,写出负极电极反应式:______________。 (2)在一密闭容器中投入一定量的氨气,发生反应2NH3N2+3H2 ΔH>0,反应过程中NH3的浓度随时间变化的情况如图所示。 请回答: ①曲线A中,反应在前2 min内氢气的平均反应速率为________。此条件下的平衡常数K=________。 ②在其他条件相同时,若改变某一条件,使该反应发生如图曲线B的反应情况,则此条件可能是改变________(填“浓度”“压强”“温度”或“催化剂”)。简述判断理由: _________________________________________________________。 (3)一定温度下,在恒压密闭容器中N2O5可发生下列反应: ①2N2O5(g)4NO2(g)+O2(g) ②2NO2(g)2NO(g)+O2(g) 若达到平衡时,c(NO2)=0.6 mol/L,c(O2)=1.2 mol/L,则反应②中NO2的转化率为________,N2O5(g)的起始浓度应大于________mol/L。 答案 (1)ΔH2-3ΔH1 2NH3-6e-+6OH-===N2+6H2O (2)①0.3 mol/(L·min) 0.12 ②温度 从图像变化趋势看,B比A反应速率加快,达到平衡时NH3浓度小,所以只可能是升高温度 (3)70% 1 解析 (1)根据盖斯定律,②-①×3得:4NH3(g)+6NO(g)===5N2(g)+6H2O(l)的ΔH=ΔH2-3ΔH1。负极氨气失去电子发生氧化反应,电解质溶液显碱性,则负极电极反应式为:2NH3-6e-+6OH-===N2+6H2O。 (2)①曲线A中,反应在前2 min内消耗氨气是0.4 mol/L,则根据反应方程式可知生成氢气是0.6 mol/L,氢气的平均反应速率为0.6 mol/L÷2 min=0.3 mol/(L·min)。2 min时反应达到平衡状态,平衡时氨气是0.6 mol/L,氮气是0.2 mol/L,氢气是0.6 mol/L,则此条件下的平衡常数K==0.12。②该反应是体积增大的吸热的可逆反应,从图像变化趋势可知,B比A反应速率加快,达到平衡时NH3浓度小,故改变的条件只可能是升高温度。 (3)设反应①中生成氧气是x mol/L,则生成NO2是4x mol/L,因此反应②中生成氧气是1.2 mol/L-x mol/L,消耗NO2是2.4 mol/L-2x mol/L,所以4x mol/L-(2.4 mol/L-2x mol/L)=0.6 mol/L,解得x=0.5,所以反应②中NO2的转化率为×100%=70%。由于是可逆反应,则N2O5(g)的起始浓度应大于2x mol/L=1 mol/L。 9.(2018·南昌市一模)新旧动能转换工程之一是新能源新材料的挖掘和应用。乙二醇是重要的化工原料,煤基合成气(CO、H2)间接制乙二醇具有转化率高、回收率高等优点,是我国一项拥有自主知识产权的世界首创技术,制备过程如下: 反应Ⅰ:4NO(g)+4CH3OH(g)+O2(g)4CH3ONO(g)+2H2O(g) ΔH1=a kJ·mol-1 反应Ⅱ:2CO(g)+2CH3ONO(g) CH3OOCCOOCH3(l)+2NO(g) ΔH2=b kJ·mol-1 反应Ⅲ:CH3OOCCOOCH3(l)+4H2(g) HOCH2CH2OH(l)+2CH3OH(g) ΔH3=c kJ·mol-1 (1)请写出煤基合成气[n(CO)∶n(H2)=1∶2]与氧气间接合成乙二醇的总热化学方程式:_____________________________________________________,已知该反应在较低温条件下能自发进行,则该反应的ΔH________0(填“>”“<”或“=”)。 (2)一定温度下,在2 L的密闭容器中投入物质的量均为0.4 mol的CO和CH3ONO发生反应Ⅱ,10 min达到平衡时CO的体积分数与NO的体积分数相等。 ①下列选项能判断反应已达到化学平衡状态的是________。 a.CO的质量不再变化 b.混合气体的密度不再变化 c.单位时间内生成CO和NO的物质的量相等 d.CO和CH3ONO的浓度比不再变化 ②10 min内该反应的速率v(NO)=________;该温度下化学平衡常数K=________。若此时向容器中再通入0.4 mol NO,一段时间后,达到新平衡时NO的体积分数与原平衡时相比________(填“增大”“相等”“减小”或“不能确定”)。 ③若该反应ΔH<0,在恒容的密闭容器中,反应达平衡后,改变某一条件,下列示意图正确的是________(填字母)。 答案 (1)4H2(g)+2CO(g)+O2(g) HOCH2CH2OH(l)+H2O(g) ΔH3= kJ·mol-1 < (2)①abc ②0.01 mol·L-1·min-1 100 增大 ③b 解析 (1)根据制备过程的三个反应和盖斯定律,Ⅰ×+Ⅱ+Ⅲ得反应:4H2(g)+2CO(g)+O2(g)HOCH2CH2OH(l)+H2O(g) ΔH= kJ·mol-1;该反应为熵减的反应ΔS<0,已知该反应在较低温条件下能自发进行,要使ΔH-TΔS<0,必须ΔH<0。 (2)①CO的质量不再变化,说明反应已达平衡状态,a项正确;该反应在恒容条件下进行且参与反应的物质不完全为气体,气体的密度为变量,当混合气体的密度不再变化,说明反应已达平衡状态,b项正确;单位时间内生成CO和NO的物质的量相等,说明正逆反应速率相等,反应达平衡状态,c项正确;CO和CH3ONO的投料相等且在反应中计量数相等,故两者的浓度比始终不变,不能作为平衡状态的判断依据,d项不正确。 ②设平衡转化率为x,则 2CO(g)+2CH3ONO(g)CH3OOCCOOCH3(l)+2NO(g) 0.2 0.2 0 0.2x 0.2x 0.2x 0.2-0.2x 0.2-0.2x 0.2x 10 min达到平衡时CO的体积分数与NO的体积分数相等,则0.2-0.2x=0.2x,解得x=0.5;10 min内该反应的速率v(NO)==0.01 mol·L-1·min-1;该温度下化学平衡常数 K===100;若此时向容器中再通入0.4 mol NO,达到新平衡时与原平衡相比,相当于增大压强,平衡向气体体积缩小的正方向移动,NO的体积分数增大;③该反应为放热反应,升高温度,平衡逆向移动,平衡常数减小,a项错误;平衡常数只与温度有关,与浓度无关,NO的物质的量增大,浓度增大,但K值保持不变,b项正确;该反应为放热反应,升高温度平衡逆向移动,NO的体积分数减小,c项错误;该反应为气体体积缩小的反应,增大压强,平衡正向移动,CO的转化率增大,d项错误。查看更多