湖北省鄂东南教改联盟学校2019-2020学年高二下学期期中联考试题 化学 Word版含答案
www.ks5u.com
2020年春季鄂东南省级示范高中教育教学改革联盟学校期中联考
高二化学试卷
考试时间:2020年06月07日上午10:00-11:30 试卷满分:100分
第I卷(共48分)
一、选择题(每小题只有一个选项符合要求,请选出。共16小题,每题3分。共48分)
1.金属的下列性质中,与自由电子无关的是
A.密度大小 B.易导电 C.延展性好 D.易导热
2.下列对焰色反应的光谱描述不正确的是
A.连续光谱 B.原子光谱 C.发射光谱 D.线状光谱
3.价电子排布式为4s1的基态原子,其基态简单离子核外电子占有的轨道数为
A.5 B.6 C.9 D.10
4.下列各组物质性质的比较,结论正确的是
A.分子的极性:BCl3
石墨>Na2CO3>Na>CO2
C.石墨晶体中,既有共价键,又有范德华力,但没有金属键
D.干冰晶体中,与1个CO2分子紧邻且等距的CO2分子有6个
9.下列说法正确的是
A.淀粉和纤维素互为同系物 B.水可以用来分离苯和苯酚的混合物
C.植物油氢化过程中发生了还原反应 D.环己烯与甲苯可用酸性KMnO4溶液鉴别
10.分子式为C11H16的有机物有多种,其中苯环上的二元取代物共有
A.16种 B.17种 C.18种 D.19种
11.已知:一类二烯烃与单烯烃或炔烃作用生成六元环状化合物的反应常用于有机合成,如,如果要一步合成,所用的有机物是
A.2,3-二甲基-1,3-丁二烯和乙炔 B.1,3-戊二烯和丙烯
C.1,3-丁二烯和2-丁烯 D.2-甲基-1,3-丁二烯和乙烯
12.下列关于有机化合物的说法正确的是
A.甲烷和氯气在光照条件下反应的产物有4种
B.键线式的系统命名为3-乙基-1,3-丁二烯
C.分子式为C5H10Br2主链碳原子数为5的结构有9种
D.为检验1-氯丙烷中的氯元素,可将1-氯丙烷与NaOH溶液共热几分钟后,冷却,滴加AgNO3溶液,观察是否有白色沉淀生成
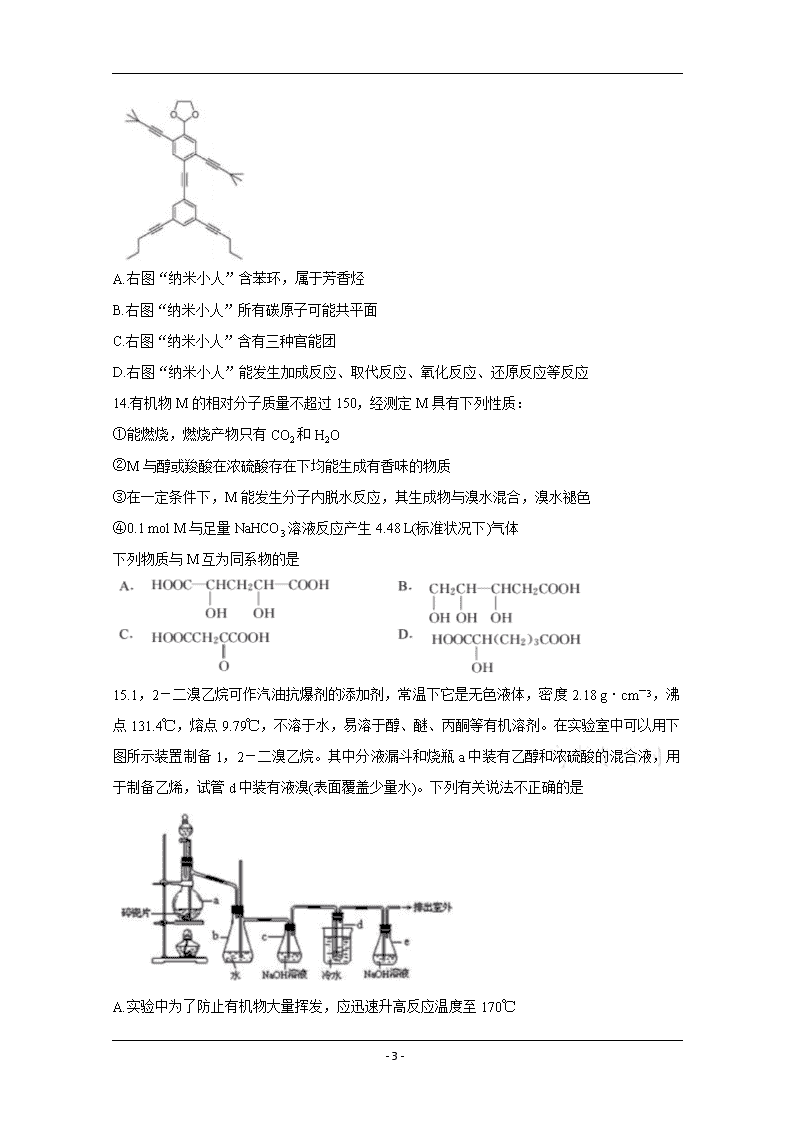
13.“纳米小人”(NanoPutians”)是莱斯大学的Stephanie H. Chanteau和James M. Tour创造出来的小家伙。他们不仅设计出了一系列2nm大小的迷你小人分子,而且还真的把它们合成了出来。右图是其中的一种,下列说法正确的是
- 14 -
A.右图“纳米小人”含苯环,属于芳香烃
B.右图“纳米小人”所有碳原子可能共平面
C.右图“纳米小人”含有三种官能团
D.右图“纳米小人”能发生加成反应、取代反应、氧化反应、还原反应等反应
14.有机物M的相对分子质量不超过150,经测定M具有下列性质:
①能燃烧,燃烧产物只有CO2和H2O
②M与醇或羧酸在浓硫酸存在下均能生成有香味的物质
③在一定条件下,M能发生分子内脱水反应,其生成物与溴水混合,溴水褪色
④0.1 mol M与足量NaHCO3溶液反应产生4.48 L(标准状况下)气体
下列物质与M互为同系物的是
15.1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18 g·cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可以用下图所示装置制备1,2-二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,用于制备乙烯,试管d中装有液溴(表面覆盖少量水)。下列有关说法不正确的是
A.实验中为了防止有机物大量挥发,应迅速升高反应温度至170℃
- 14 -
B.装置c和装置e中都盛有NaOH溶液,其吸收的杂质不相同
C.制备乙烯和生成1,2-二溴乙烷的反应类型分别是消去反应和加成反应
D.向d中产物加入饱和Na2CO3溶液震荡静置,可用分液的方法进行分离
16.已知某些饱和一元醛的常压时沸点(℃)如下表所示:
饱和一元醛R常压时的沸点为153℃。则R为
A.丙醛 B.戊醛 C.庚醛 D.壬醛
第II卷(共52分)
17.(14分)苯甲酸是一种消毒防腐剂,其钠盐可抑制牙膏中微生物的生长。甲苯氧化法是实验室制备苯甲酸的常用方法之一。
(一)反应原理
C6H5CH3+2KMnO4C6H5COOK+KOH+2MnO2↓+H2O
C6H5COOK+HCl→C6H5COOH+KCl
已知:苯甲酸相对分子质量122,熔点122.4℃;苯甲酸在水中的溶解度如下表。
(二)实验过程
①将一定量甲苯、水、几粒沸石加入三颈烧瓶中;
②装上冷凝管,加热至沸后分批加入适量高锰酸钾,搅拌回流反应4小时;
③将反应混合物趁热减压过滤,并用热水洗涤滤渣,将洗涤液并入滤液中;
④滤液加入盐酸酸化后,抽滤(装置如图1)、洗涤、干燥得苯甲酸粗产品。
- 14 -
(1)图1电动搅拌器的作用是 ,冷凝管中冷水应从 (填“a”或“b”)口进入;判断甲苯被氧化完全的实验现象是 。
(2)第③步抽滤操作时,要趁热进行,是因为: ,反应混合物趁热减压过滤后,若溶液呈红色,可用少量NaHSO3溶液处理,反应的离子方程式为 。
(三)纯度测定
(3)称取1.22 g产品溶解在甲醇中配成100 mL溶液,移取25.00 mL溶液,用KOH标准溶液进行滴定,消耗KOH的物质的量为2.30×10-3 mol,产品中苯甲酸质量百分数为 (保留两位有效数字)。
(四)实验反思
(4)得到的粗产品要进一步提纯苯甲酸,可采用 的方法。
18.(12分)1,4-环己二醇是重要的化工中间体。由环己烷可制得1,4-环己二醇,下列有7步反应(其中无机产物都已略去),试回答下列问题:
(1)上述反应中 (填编号,下同)属于加成反应, 属于消去反应, 属于取代反应。
(2)写出下列化学方程式:
反应② ;
反应⑥ 。
(3)与1,4-环己二醇互为同分异构体且含羧基的结构有 种。
- 14 -
19.(13分)短周期元素X、Y的价电子数相同,且原子序数之比等于1:2;元素Z是人体必需的微量元素,位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。
(1)与X同周期且第一电离能比X大的元素有 种。
(2)基态Y原子中,能量最高的核外电子占据的能级的电子云轮廓图形状为 。
(3)X与Y可形成多种微粒,其中微粒的立体构型为正四面体形的是 (写化学式),
写出两种与它互为等电子体的粒子的化学式 (写一种分子和一种离子)
(4)Y与Z形成的某种晶体的晶胞如图所示,该晶胞中Z微粒的配位数为 ,该化合物的化学式为 。
(5)已知ZY晶体的熔点约为1700℃,ZX与ZY结构相似,其熔点为1975℃,构成ZY晶体的作用力是 ,ZX熔点较高的原因是 。
20.(13分)Fe、Cu都是重要的材料元素,其单质及化合物在诸多领域中都有广泛的应用。
(1)Fe位于元素周期表的 区,Fe2+的价层电子排布图为 。
(2)向黄色的三氯化铁溶液中加入无色的KSCN溶液,溶液变成红色。该反应在有的教材中用方程式FeCl3+3KSCN=Fe(SCN)3+3KCl表示。经研究表明,Fe(SCN)3是配合物,Fe3+与SCN-不仅能以1:3的个数比配合,还可以其他个数比配合。请按要求填空:
①所得Fe3+与SCN-的配合物中,主要是Fe3+与SCN-以个数比1:1配合所得离子显红色。含该离子的配合物的化学式是 。
②铁的另一种配合物铁氰化钾K3[Fe(CN)6]俗称赤血盐,可用于检验Fe2+,两者反应生成带有特征蓝色的沉淀,请用离子方程式说明原理: 该赤血盐其配体的电子式为: 。
(3)Cu的某种化合物的结构如下图所示,该化合物中既含有配位键,又含有氢键,其中配位键和氢键均采用虚线表示。
- 14 -
0.5 mol该化合物中含有σ键的个数为 。Cu2+与NH3还可形成[Cu(NH3)4]2+配离子,该配离子的立体构型为 。
- 14 -
- 14 -
- 14 -
- 14 -
- 14 -
- 14 -
- 14 -
- 14 -