2020届一轮复习人教版化工流程(二)学案
第5讲 化工流程(二)
1.(2019江苏)实验室以工业废渣(主要含CaSO4·2H2O,还含少量SiO2、Al2O3、Fe2O3)为原料制取轻质CaCO3和(NH4)2SO4晶体,其实验流程如下:
(1)室温下,反应CaSO4(s)+(aq)CaCO3(s)+(aq)达到平衡,则溶液中=________[Ksp(CaSO4)=4.8×10−5,Ksp(CaCO3)=3×10−9]。
(2)将氨水和NH4HCO3溶液混合,可制得(NH4)2CO3溶液,其离子方程式为________;浸取废渣时,向(NH4)2CO3溶液中加入适量浓氨水的目的是________。
(3)废渣浸取在如图所示的装置中进行。控制反应温度在60~70 ℃,搅拌,反应3小时。温度过高将会导致CaSO4的转化率下降,其原因是________;保持温度、反应时间、反应物和溶剂的量不变,实验中提高CaSO4转化率的操作有________。
(4)滤渣水洗后,经多步处理得到制备轻质CaCO3所需的CaCl2溶液。设计以水洗后的滤渣为原料,制取CaCl2溶液的实验方案:______[已知pH=5时Fe(OH)3和Al(OH)3沉淀完全;pH=8.5时Al(OH)3开始溶解。实验中必须使用的试剂:盐酸和Ca(OH)2]。
【答案】 (1). 1.6×104 (2). +NH3·H2O++H2O(或+NH3·H2O++H2O) (3). 增加溶液中的浓度,促进CaSO4的转化 (4). 温度过高,(NH4)2CO3分解 (5). 加快搅拌速率 (6). 在搅拌下向足量稀盐酸中分批加入滤渣,待观察不到气泡产生后,过滤,向滤液中分批加入少量Ca(OH)2,用pH试纸测量溶液pH,当pH介于5~8.5时,过滤
【解析】
(1)反应CaSO4(s)+CO32-(aq)CaCO3(s)+SO42-(aq)达到平衡时,溶液中====1.6×104。答案:1.6×104
(2)NH4HCO3属于酸式盐,与氨水反应生成(NH4)2CO3,反应的化学方程式为NH4HCO3+NH3·H2O=(NH4)2CO3+H2O[或NH4HCO3+NH3·H2O(NH4)2CO3+H2O],离子方程式为HCO3-+NH3·H2O=NH4++CO32-+H2O(或HCO3-+NH3·H2ONH4++CO32-+H2O);浸取废渣时,加入的(NH4)2CO3
属于弱酸弱碱盐,溶液中存在水解平衡:CO32-+NH4++H2OHCO3-+NH3·H2O,加入适量浓氨水,水解平衡逆向移动,溶液中CO32-的浓度增大,反应CaSO4(s)+CO32-(aq)CaCO3(s)+SO42-(aq)正向移动,促进CaSO4的转化。答案:HCO3-+NH3·H2O=NH4++CO32-+H2O(或HCO3-+NH3·H2ONH4++CO32-+H2O) 增加溶液中CO32-的浓度,促进CaSO4的转化
(3)由于铵盐具有不稳定性,受热易分解,所以温度过高,(NH4)2CO3分解,从而使CaSO4转化率下降;由于浸取过程中的反应属于固体与溶液的反应(或发生沉淀的转化),保持温度、反应时间、反应物和溶剂的量不变,提高CaSO4转化率即提高反应速率,结合外界条件对化学反应速率的影响,实验过程中提高CaSO4转化率的操作为加快搅拌速率(即增大接触面积,加快反应速率,提高浸取率)。答案:温度过高,(NH4)2CO3分解 加快搅拌速率
(4)工业废渣主要含CaSO4·2H2O,还含有少量SiO2、Al2O3和Fe2O3,加入(NH4)2CO3溶液浸取,其中CaSO4与(NH4)2CO3反应生成CaCO3和(NH4)2SO4,SiO2、Al2O3和Fe2O3都不反应,过滤后所得滤渣中含CaCO3、SiO2、Al2O3和Fe2O3;若以水洗后的滤渣为原料制取CaCl2溶液,根据题给试剂,首先要加入足量盐酸将CaCO3完全转化为CaCl2,发生的反应为CaCO3+2HCl=CaCl2+H2O+CO2↑,与此同时发生反应Al2O3+6HCl=2AlCl3+3H2O、Fe2O3+6HCl=2FeCl3+3H2O,SiO2不反应,经过滤除去SiO2;得到的滤液中含CaCl2、AlCl3、FeCl3,根据“pH=5时Fe(OH)3和Al(OH)3沉淀完全,pH=8.5时Al(OH)3开始溶解”,为了将滤液中Al3+、Fe3+完全除去,应加入Ca(OH)2调节溶液的pH介于5~8.5[加入Ca(OH)2的过程中要边加边测定溶液的pH],然后过滤即可制得CaCl2溶液。答案:在搅拌下向足量稀盐酸中分批加入滤渣,待观察不到气泡产生后,过滤,向滤液中分批加入少量Ca(OH)2,用pH试纸测得溶液pH,当pH介于5~8.5时,过滤
2.(2019天津)多晶硅是制作光伏电池的关键材料。以下是由粗硅制备多晶硅的简易过程。
回答下列问题:
Ⅰ.硅粉与在300℃时反应生成气体和,放出热量,该反应的热化学方程式为________________________。的电子式为__________________。
Ⅱ.将氢化为有三种方法,对应的反应依次为:
①
②
③
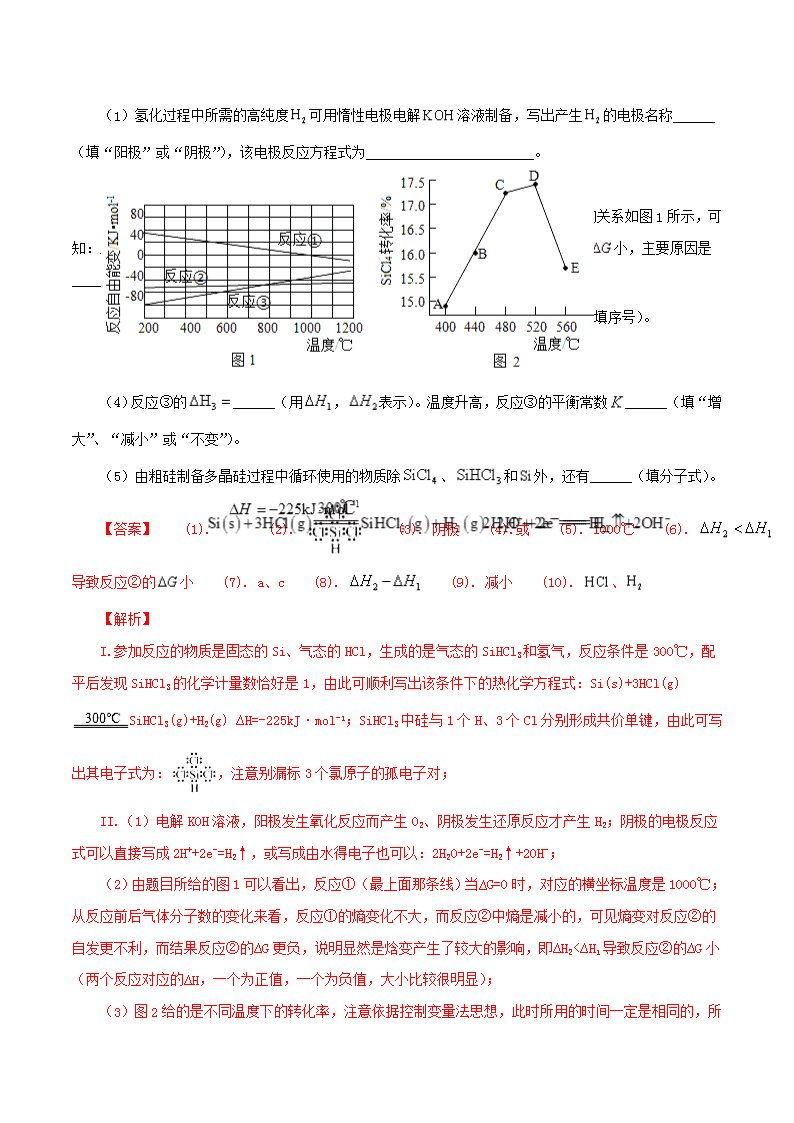
(1)氢化过程中所需的高纯度可用惰性电极电解溶液制备,写出产生的电极名称______(填“阳极”或“阴极”),该电极反应方程式为________________________。
(2)已知体系自由能变,时反应自发进行。三个氢化反应的与温度的关系如图1所示,可知:反应①能自发进行的最低温度是____________;相同温度下,反应②比反应①的小,主要原因是________________________。
(3)不同温度下反应②中转化率如图2所示。下列叙述正确的是______(填序号)。
a.B点: b.:A点点 c.反应适宜温度:℃
(4)反应③的______(用,表示)。温度升高,反应③的平衡常数______(填“增大”、“减小”或“不变”)。
(5)由粗硅制备多晶硅过程中循环使用的物质除、和外,还有______(填分子式)。
【答案】 (1). (2). (3). 阴极 (4).或 (5). 1000℃ (6). 导致反应②的小 (7). a、c (8). (9). 减小 (10). 、
【解析】
I.参加反应的物质是固态的Si、气态的HCl,生成的是气态的SiHCl3和氢气,反应条件是300℃,配平后发现SiHCl3的化学计量数恰好是1,由此可顺利写出该条件下的热化学方程式:Si(s)+3HCl(g) SiHCl3(g)+H2(g) ∆H=-225kJ·mol-1;SiHCl3中硅与1个H、3个Cl分别形成共价单键,由此可写出其电子式为:,注意别漏标3个氯原子的孤电子对;
II.(1)电解KOH溶液,阳极发生氧化反应而产生O2、阴极发生还原反应才产生H2;阴极的电极反应式可以直接写成2H++2e-=H2↑,或写成由水得电子也可以:2H2O+2e-=H2↑+2OH-;
(2)由题目所给的图1可以看出,反应①(最上面那条线)当∆G=0时,对应的横坐标温度是1000℃;从反应前后气体分子数的变化来看,反应①的熵变化不大,而反应②中熵是减小的,可见熵变对反应②的自发更不利,而结果反应②的∆G更负,说明显然是焓变产生了较大的影响,即∆H2<∆H1导致反应②的∆G小(两个反应对应的∆H,一个为正值,一个为负值,大小比较很明显);
(3)图2
给的是不同温度下的转化率,注意依据控制变量法思想,此时所用的时间一定是相同的,所以图示中A、B、C点反应均正向进行,D点刚好达到平衡,D点到E点才涉及平衡的移动。在到达平衡状态以前,正反应速率大于逆反应速率,a项正确,B点反应正向进行,正反应速率大于逆反应速率;b点错误,温度越高,反应速率越快,所以E点的正(或逆)反应速率均大于A点;c项正确,C到D点,SiHCl3的转化率较高,选择此温度范围比较合适,在实际工业生产中还要综合考虑催化剂的活性温度。
(4)将反应①反向,并与反应②直接相加可得反应③,所以∆H3=∆H2-∆H1,因∆H2<0、∆H1>0,所以∆H3必小于0,即反应③正反应为放热反应,而放热反应的化学平衡常数随着温度的升高而减小;
(5)反应①生成的HCl可用于流程中粗硅提纯的第1步,三个可逆反应中剩余的H2也可循环使用。
3.(2018课标Ⅱ)我国是世界上最早制得和使用金属锌的国家,一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:
相关金属离子[c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子
Fe3+
Fe2+
Zn2+
Cd2+
开始沉淀的pH
1.5
6.3
6.2
7.4
沉淀完全的pH
2.8
8.3
8.2
9.4
回答下列问题:
(1)焙烧过程中主要反应的化学方程式为_______________________。
(2)滤渣1的主要成分除SiO2外还有___________;氧化除杂工序中ZnO的作用是____________,若不通入氧气,其后果是________________。
(3)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为_________________。
(4)电解硫酸锌溶液制备单质锌时,阴极的电极反应式为______________;沉积锌后的电解液可返回_______工序继续使用。
【答案】 (1). ZnS+O2ZnO+SO2 (2). PbSO4 (3). 调节溶液的pH (4). 无法除去杂质Fe2+ (5). Zn+Cd2+Zn2++Cd (6). Zn2++2e-Zn (7). 溶浸
【解析】(1)由于闪锌矿的主要成分是ZnS,因此焙烧过程中主要反应的化学方程式为2ZnS+3O22ZnO+2SO2。
(2)由于硫酸铅不溶于水,因此滤渣1的主要成分除SiO2外还有PbSO4;要测定铁离子,需要调节溶液的pH,又因为不能引入新杂质,所以需要利用氧化锌调节pH,即氧化除杂工序中ZnO的作用是调节溶液的pH。根据表中数据可知沉淀亚铁离子的pH较大,所以若不通入氧气,其后果是无法除去杂质Fe2+。
(3)溶液中的Cd2+可用锌粉除去,反应的离子方程式为Zn+Cd2+=Zn2++Cd。
(4)电解硫酸锌溶液制备单质锌时,阴极发生得到电子的还原反应,因此阴极是锌离子放电,则阴极的电极反应式为Zn2++2e-=Zn;阳极是氢氧根放电,破坏水的电离平衡,产生氢离子,所以电解后还有硫酸产生,因此沉积锌后的电解液可返回溶浸工序继续使用。
4.(2018天津)下图中反应①是制备SiH4的一种方法,其副产物MgCl2·6NH3是优质的镁资源。回答下列问题:
(1)MgCl2·6NH3所含元素的简单离子半径由小到大的顺序(H-除外):_________________________,Mg在元素周期表中的位置:_____________________,Mg(OH)2的电子式:____________________。
(2)A2B的化学式为_______________。反应②的必备条件是_______________。上图中可以循环使用的物质有_______________。
(3)在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料_______________(写化学式)。
(4)为实现燃煤脱硫,向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为稳定的Mg化合物,写出该反应的化学方程式:_______________。
(5)用Mg制成的格氏试剂(RMgBr)常用于有机合成,例如制备醇类化合物的合成路线如下:
依据上述信息,写出制备所需醛的可能结构简式:_______________。
【答案】 r(H+)
”或“<”)。
②结合元素周期律解释①中结论:P和S电子层数相同,__________。
(3)酸浸时,磷精矿中Ca5(PO4)3F所含氟转化为HF,并进一步转化为SiF4除去。写出生成HF的化学方程式:__________。
(4)H2O2将粗磷酸中的有机碳氧化为CO2脱除,同时自身也会发生分解。相同投料比、相同反应时间,不同温度下的有机碳脱除率如图所示。80℃后脱除率变化的原因:____________________。
(5)脱硫时,CaCO3稍过量,充分反应后仍有SO42−残留,原因是__________;加入BaCO3可进一步提高硫的脱除率,其离子方程式是____________________。
(6)取a g所得精制磷酸,加适量水稀释,以百里香酚酞作指示剂,用b mol·L−1NaOH溶液滴定至终点时生成Na2HPO4,消耗NaOH溶液c mL,精制磷酸中H3PO4的质量分数是________。(已知:H3PO4摩尔质量为98 g·mol−1)
【答案】 研磨、加热 < 核电荷数P<S,原子半径P>S,得电子能力P<S,非金属性P<S 2Ca5(PO4)3F+10H2SO4+5H2O10CaSO4·0.5H2O+6H3PO4+2HF↑ 80 ℃后,H2O2分解速率大,浓度显著降低 CaSO4微溶 BaCO3++2H3PO4BaSO4+CO2↑+H2O+2
【解析】(1)研磨能增大反应物的接触面积,加快反应速率,加热,升高温度加快反应速率;流程中能加快反应速率的措施有:研磨、加热。
(2)①根据“强酸制弱酸”的复分解反应规律,酸性:H3PO4H2SO4。
②用元素周期律解释酸性:H3PO4H2SO4,P和S电子层数相同,核电荷数PS,原子半径PS,得电子能力PS,非金属性PS。
(3)根据“强酸制弱酸”的复分解反应规律,Ca5(PO4)3F与H2SO4反应生成HF、磷石膏和磷酸,生成HF的化学方程式为2Ca5(PO4)3F+10H2SO4+5H2O10CaSO4·0.5H2O+6H3PO4+2HF↑。
(4)图示是相同投料比、相同反应时间,不同温度下的有机碳脱除率,80℃前温度升高反应速率加快,相同时间内有机碳脱除率增大;80℃后温度升高,H2O2分解速率大,H2O2浓度显著降低,反应速率减慢,相同条件下有机碳脱除率减小。
(5)脱硫时,CaCO3稍过量,充分反应后仍有SO42-残留,原因是:CaSO4微溶于水。加入BaCO3可进一步提高硫的脱除率,因为BaSO4难溶于水,其中SO42-与BaCO3生成更难溶的BaSO4和CO32-,H3PO4的酸性强于H2CO3,在粗磷酸中CO32-转化成H2O和CO2
,反应的离子方程式为BaCO3+SO42-+2H3PO4=BaSO4+CO2↑+2H2PO4-+H2O。
(6)滴定终点生成Na2HPO4,则消耗的H3PO4与NaOH物质的量之比为1:2,n(H3PO4)=n(NaOH)=bmol/Lc10-3L=mol,m(H3PO4)=mol98g/mol=g=0.049bcg,精制磷酸中H3PO4的质量分数为。
典例2(2019·陇西县第一中学高三高考模拟)锰是重要的合金材料和催化剂,在工农业生产和科技领域有广泛的用途。请回答下列问题:
(1)溶液中的Mn2+可被酸性溶液氧化为MnO4-,该方法可用于检验Mn2+。
①检验时的实验现象为_________。
②该反应的离子方程式为___________。
③ 可看成两分子硫酸偶合所得,若硫酸的结构式为,则的结构式为_________。
(2)实验室用含锰废料(主要成分,含有少量)制备Mn的流程如下:
已知:Ⅰ.难溶物的溶度积常数如下表所示:
难溶物
溶度积常数()
4.0×10-38
1.0×10-33
1.8×10-11
1.8×10-13
Ⅱ.溶液中离子浓度≤10-5 mol·L-1时,认为该离子沉淀完全。
①“酸浸”时,将Fe氧化为Fe3+。该反应的离子方程式为________;该过程中时间和液固比对锰浸出率的影响分别如图1、图2所示:
则适宜的浸出时间和液固比分别为___________、___________。
②若“酸浸”后所得滤液中c(Mn2+)=0.18 mol·L-1,则“调pH”的范围为___________。
③“煅烧”反应中氧化剂和还原剂的物质的量之比为_______。“还原”时所发生的反应在化学上又叫做_________。
【答案】溶液由无色变为紫红色 5S2O82-+2Mn2++8H2O=2MnO4-+10SO42-+16H+ 3MnO2+2Fe+12H+=3Mn2++2Fe3++6H2O 60min 3:1 pH<8 1:2 铝热反应
【解析】(1)①溶液中的Mn2+转化为MnO4-的实验现象为溶液由无色变为紫红色,故答案为:溶液由无色变为紫红色。
②Mn2+被酸性(NH4)2S2O8溶液氧化物MnO4-,还原产物应为SO42-,反应的离子方程式为:5S2O82-+2Mn2++8H2O=2MnO4-+10SO42-+16H+,故答案为:5S2O82-+2Mn2++8H2O=2MnO4-+10SO42-+16H+。
③H2S2O8可视为由两分子的硫酸缩合所得,硫酸的结构简式为:,则H2S2O8的结构简式为:,故答案为:。
(2)①由题中信息可知,“酸浸”时,MnO2在酸性介质中将Fe氧化为Fe3+,本身被还原为Mn2+,该反应的离子方程式为:3MnO2+2Fe+12H+=3Mn2++2Fe3++6H2O,由图甲可知,适宜的浸出时间为60min,由图乙可知,适宜的液固比为3:1,故答案为:3MnO2+2Fe+12H+=3Mn2++2Fe3++6H2O,60min,3:1。
②由流程图中信息可知,“调pH”的目的是使Fe3+和Al3+沉淀完全,而Mn2+不沉淀,根据Ksp[Al(OH)3]=1.0×10-33,Ksp[Fe(OH)3]=4.0×10-38可知:Al3+沉淀完全时Fe3+已沉淀完全,Al(OH)3恰好完全沉淀时的pH=-lg=,Mn2+开始沉淀时的pH为-lg=8,则“调pH”的范围为pH<8,故答案为:pH<8。
③根据信息可知,“煅烧”时,空气中的O2将MnCO3氧化为MnO2,根据得失电子守恒可得关系式O2
~2MnCO3,即氧化剂和还原剂的物质的量之比为1:2,“还原”时发生铝粉与高熔点金属氧化物的反应在化学上又叫做铝热反应,故答案为:1:2,铝热反应。
精练:
1.(2019·福建高三高考模拟)利用氟磷灰石[主要成分Ca5(PO4)3F生产磷酸主要有热法和湿法两种方法。其流程如下:
热法:工业上将氟磷灰石、焦炭和石英砂(SiO2)混合后,在电炉中加热到1500℃生成白磷(P4)、SiF4、CO,白磷在空气中燃烧生成五氧化二磷,再经水化制成粗磷酸。
湿法:武汉化工研究院为技术攻关,实验室模拟生产磷酸的流程。
(1)配平步骤I反应的化学方程式:
____Ca5(PO4)3F+ ____C+ ____SiO2=____SiF4↑+ ___P4+____CO↑+____CaSiO3。其中氧化剂是______。
(2)湿法中粉碎氟磷灰石的目的是___________。
(3)浸取槽中发生反应的化学方程式________;浸取槽不能使用玻璃器皿的原因___________。
(4)探究中发现,65℃、一定流速下鼓气(鼓气可减少盐酸与氟磷灰石矿反应过程中液面的泡沫,利于HF逸出),并通过控制盐酸的用量减少后续除氟工艺。其他条件不变,盐酸实际用量/理论用量与所得的磷酸中氟含量及磷酸的浸取率如图所示。
①选择盐酸用量:盐酸实际用量/理论用量的范围为________(填字母代号)时磷酸浸取率较高且氟含量较低。
A.0.95~1.00 B.1.00~1.05
C.1.05~1.10 D.1.15~1.20
②盐酸稍过量,氟含量降低的原因是___________。
③盐酸过量较多,氟含量快速增加的可能原因是___________。
(5)通过双指示剂方法测定浸取液中盐酸和磷酸的浓度。实验如下:每次取10.0mL浸取液,用1.0 mol·L-1NaOH溶液滴定,分别用不同的指示剂,滴定结果见表。含磷微粒在不同pH下物质的量分数如图所示。(甲基橙的变色范围为3.1~4.4,百里酚酞的变色范围为9.4~10.6)
则浸取液中c(HCl)=___________mol·L-1。
【答案】4 30 21 1 3 30 20 Ca5(PO4)3F 增大接触面积,提高反应速率,提高浸取率 Ca5 (PO4)3 F +10HCl=3H3PO4+5CaCl2+HF 玻璃会被氢氟酸腐蚀 C 氢氟酸为弱酸,酸稍过量,抑制其电离,形成气体逸出 随着酸过量较多,反应速率加快,产生大量的泡沫,不利于HF的逸出 2.17
【解析】
(1)氟磷灰石与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,同时逸出SiF4和CO,该反应的化学方程式为4Ca5P3FO12+30C +21SiO2 SiF4↑+3P4+ 30CO↑+20CaSiO3,反应中C的化合价升高,C为还原剂,Ca5P3FO12中P元素的化合价降低,Ca5P3FO12为氧化剂,故答案为:4;30;21;1;3;30;20;Ca5P3FO12;
(2)流程中将氟磷灰石粉碎,可增大氟磷灰石与稀硫酸反应的接触面积,加快化学反应速率,提高浸取率,故答案为:增大氟磷灰石与稀硫酸反应的接触面积,加快化学反应速率,提高浸取率;
(3)根据湿法流程图,氟磷灰石、浓盐酸在浸取槽中复分解反应,反应的化学方程式为Ca5 (PO4)3 F +10HCl=3H3PO4+5CaCl2+HF,反应生成了氢氟酸,氢氟酸能够腐蚀玻璃,因此浸取槽不能使用玻璃器皿,故答案为:Ca5 (PO4)3 F +10HCl=3H3PO4+5CaCl2+HF;玻璃会被氢氟酸腐蚀;
(4)①根据图像,盐酸实际用量/理论用量为1.05~1.10时所得的磷酸中氟含量及磷酸的浸取率较高且氟含量较低,故选C;
②盐酸稍过量,即盐酸实际用量/理论用量稍大于1,由于氢氟酸为弱酸,酸稍过量,抑制其电离,形成气体逸出,导致氟含量降低,故答案为:氢氟酸为弱酸,酸稍过量,抑制其电离,形成气体逸出;
③根据题意,鼓气可减少盐酸与氟磷灰石矿反应过程中液面的泡沫,利于HF逸出,当盐酸过量较多时,反应速率加快,产生大量的泡沫,反而不利于HF的逸出,会造成氟含量快速增加,故答案为:随着酸过量较多,反应速率加快,产生大量的泡沫,不利于HF的逸出;
(5)根据含磷微粒在不同pH下物质的量分布图,在pH=4左右时,溶液中主要以H2PO4-存在,在pH=10左右时,溶液中主要以HPO42-存在,因此用10 mol·L-1NaOH溶液滴定浸取液中盐酸和磷酸的浓度过程中,用甲基橙作指示剂时,氢氧化钠与盐酸反应生成氯化钠,与磷酸反应生成磷酸二氢钠,用百里酚酞作指示剂时,氢氧化钠与磷酸二氢钠反应生成磷酸一氢钠。
设盐酸的浓度为x,磷酸的浓度为y,则有y×0.01L=(0.0329-0.0273)L×1.0 mol/L,0.0273L×1.0 mol/L= y×0.01L+x×0.01L,解得x=2.17 mol/L,y=0.56 mol/L,故答案为:2.17。
2.(2019·云南高三高考模拟)废旧电池的回收处理,既能减少对环境的污染,又能实现资源的再生利用。将废旧锌锰电池初步处理后,所得废料含MnO2、MnOOH、Zn(OH)2及少量Fe等,用该废料制备Zn和MnO2的一种工艺流程如下:
已知:
①Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化
②有关Ksp数据如下表所示
化合物
Mn(OH)2
Zn(OH)2
Fe(OH)3
Ksp近似值
10-13
10-17
10-38
回答下列问题:
(1)还原焙烧过程中,
MnOOH与炭黑反应,锰元素被还原为MnO,该反应的化学方程式为___________。传统的工艺是使用浓盐酸在加热条件下直接处理废料,缺点是___________。
(2)酸漫时一般会适当加热并不断搅拌,其作用是___________,滤渣1和滤渣2主要成分的化学式依次是___________。
(3)净化时,先通入O2再加入MnCO3,其目的是___________;已知净化时溶液中Mn2+、Zn2+的浓度约为0.1mol·L-1,调节pH的合理范围是___________。
(4)电解制取MnO2时,MnO2在___________极产生。
(5)中科院研究人员将MnO2和生物质置于一个由滤纸制成的折纸通道内形成电池,该电池可将软饮料中的葡萄糖作为燃料获得能量,装置如图所示。此装置中b极的电极反应式为______________________。
【答案】(1)2MnOOH+C 2MnO+CO↑+H2O↑ 反应过程中产生氯气,造成环境污染 加快酸浸时的反应速率 C、 Fe(OH)3 先将Fe2+氧化成Fe3+,再调节pH使Fe3+沉淀完全 3≤pH<5.5 阳 C6H12O6-2e-=C6H10O6+2H+
【解析】
(1)MnOOH与炭黑反应,锰元素被还原为MnO ,因为碳过量时生成一氧化碳,方程式为:2MnOOH+C 2MnO+CO↑+H2O↑,二氧化锰和浓盐酸反应生成氯气,造成环境污染。
(2)加热和搅拌都可以加快酸浸时的反应速率,碳不溶于水或酸,所以滤渣1为碳,溶液中通入氧气和加入碳酸锰,使铁元素变成Fe(OH)3沉淀而分离。
(3)实验过程中需要将亚铁离子氧化并沉淀,但不能将锰元素氧化和沉淀,因为二价锰在酸性条件下很稳定,所以先通入氧气,先将Fe2+氧化成Fe3+,再调节pH使Fe3+沉淀完全,当铁离子浓度小于或等于10-5mol/L时认为完全沉淀,假设此时溶液中的氢氧根离子浓度为xmol/L,则有10-5×x3=10-38,解x=10-11mol/L,则溶液的pH为3,溶液中Mn2+、Zn2+的浓度约为0.1mol·L-1,形成Mn(OH)2沉淀时的氢氧根离子浓度为ymol/L,则有0.1×y2=10-13,形成Zn (OH)2沉淀时的氢氧根离子浓度为zmol/L,0.1×z2=10-17,y=10-6 mol/L,z=10-8 mol/L,对应的pH分别为8和6,且Mn2+在pH高于5.5时易被O2氧化,所以应调节pH范围为3≤pH<5.5。
(4)电解过程中锰元素化合价升高,在阳极生成二氧化锰。
(5)二氧化锰做氧化剂,得到电子,在正极反应,则葡萄糖失去电子,电极反应为:C6H12O6-2e-=C6H10O6+2H+。
二.解题思路
明确整个流程及每一部分的目的 → 仔细分析每步发生的反应及得到的产物 → 结合基础理论与实际问题思考 → 注意答题的模式与要点
1. 在解这类题目时:
首先,要粗读试题,尽量弄懂流程图,但不必将每一种物质都推出。
其次,再精读试题,根据问题去精心研究某一步或某一种物质。
第三,要看清所问题,不能答非所问,并注意语言表达的科学性。
在答题时应注意:前一问回答不了,并不一定会影响回答后面的问题。
2. 分析流程图需要掌握的技巧是:
⑴ 浏览全题,确定该流程的目的——由何原料获得何产物(副产物),对比原料和产物;
⑵ 了解流程图以外的文字描述、表格信息、后续设问中的提示性信息,并在下一步分析和解题中随时
进行联系和调用;
⑶ 解析流程图并思考:从原料到产品依次进行了什么反应?利用了什么原理(氧化还原?溶解度?
溶液中的平衡?)。每一步操作进行到什么程度最佳?每一步除目标物质外还产生了什么杂质或副产物?杂质或副产物是怎样除去的?
3. 工业生产流程主线与核心的分析
⑴ 主线主产品。
⑵ 分支副产品。
⑶ 回头为循环。
典例1 (2019·安徽高三高考模拟)锰酸锂离子蓄电池是第二代锂离子动力电池。一种以软锰矿浆(主要成分为MnO2,含少量 Fe2O3、FeO、A12O3、SiO2等杂质)为原料制备锰酸锂的流程如下图所示。
(1)溶浸生产中为提高SO2回收率可采取的措施有_________(填序号)
a.不断搅拌,使SO2和软锰矿浆充分接触
b.增大通入SO2的流速
c.减少软锰矿浆的进入量
d.减小通入SO2的流速
(2)已知:室温下,Ksp[A1(OH)3]=1×10-33,Ksp[Fe(OH)3]=l×10-39, pH=7.1 时 Mn(OH)2开始沉淀。氧化除杂时(室温)除去MnSO4液中的Fe3+、Al3+(使其浓度小于1× l0-6mol /L),需调节溶液pH范围为_______。
(3)由硫酸锰与K2S2O8溶液常温下混合一周,慢慢得到球形二氧化锰(MnO2)。请写出发生反应的离子方程式___________。
(4)将MnO2和 Li2CO3按4:1的物质的量比配料,混合搅拌,然后升温至600℃〜750℃,制取产品LiMn2O4。写出该反应的化学方程式 _____________ 。
(5)锰酸锂可充电电池的总反应为:Li1-xMn2O4+LixCLiMn2O4+C(0<x<1)
①充电时,电池的阳极反应式为_________,若此时转移lmole-,则石墨电极将增重______g。
②废旧锰酸锂电池可能残留有单质锂,拆解不当易爆炸、着火,为了安全,对拆解环境的要求是________。
【答案】ad 5.06时,银的产率降低的原因为__________________________。
(7)常温下,取上述AgNO3溶液滴加到物质的量浓度均为0.2mol/L NaNO2和CaCl2的混合溶液中(忽略溶液体积变化),当AgNO2开始沉淀时,溶液中c(Cl-)=__________mol/L[已知:常温下,Ksp(AgNO2)=2×10-8 ,Ksp(AgCl)=1.8×10-10]
【答案】H6时,银的产率降低的原因为pH过大时,会发生反应:Ag++OH-=AgOH↓,会有AgOH生成,从而降低了产品的纯度;
(7)AgNO2开始沉淀所需c(Ag+)==1×10-7mol/L;由溶度积常数Ksp(AgCl)10,用NaClO溶液先将CN-不完全氧化为OCN-;第二步控制pH为7.5~8.5,用NaClO溶液完全氧化OCN-生成N2和两种盐。第一步控制强碱性的主要目的是_______,第二步反应的离子方程式为____________。
(5)已知蓝色染料普鲁士蓝的合成方法如下:
用硫酸亚铁碱性试纸可以检验食品中是否含有CN-,方案如下:
若试纸变蓝则证明食品中含有CN-,基于普鲁士蓝的合成原理,请解释检测时试纸变蓝的原因:___________。
【答案】3Ca(OH)2 +FeSO4 +6HCN=Ca2Fe(CN)6 +CaSO4+6H2O CaCl2(KCl可答,也可不答) K2CO3 HCN有剧毒,防止生成HCN污染环境 2CNO-+3ClO- +H2O=N2↑ +3Cl-+2HCO3- Fe2+和CN- 反应生成[Fe(CN)6]4-,同时Fe2+被空气中的氧气氧化生成Fe3+,Fe3+与[Fe(CN)6]4-反应生成蓝色沉淀
【解析】(1)步骤Ⅰ根据加入的反应物及生成物质,结合元素守恒,可得反应的化学方程式为3Ca(OH)2 +FeSO4 +6HCN=Ca2Fe(CN)6 +CaSO4+6H2O;
(2)步骤Ⅵ过滤所得的废液中含量较多的溶质为CaCl2(或答CaCl2、KCl);
(3)步骤Ⅴ所用的试剂X是K2CO3;
(4)①NaCN是离子化合物,Na+与CN-通过离子键结合,CN-内C、N原子间通过三对共用电子对结合,所以NaCN的电子式为;
②第一步控制强碱性的主要目的是防止生成HCN,污染环境,用NaClO溶液先不完全氧化OCN-生成N2和两种盐,根据电子、电荷守恒,可知发生反应的离子方程式为2OCN-+3ClO-+2H2O=3Cl-+N2+2HCO3-;
(5) [Fe(CN)6]4-和Fe3+反应生成Fe4[Fe(CN)6]3蓝色沉淀,反应的离子方程式为:3 [Fe(CN)6]4-+4Fe3+= Fe4[Fe(CN)6]3↓,基于普鲁士蓝合成原理可检测食品中CN-,碱性条件下,Fe2+与CN-结合生成[Fe(CN)6]4-,同时Fe2+被空气中的氧气氧化生成Fe3+,Fe3+与[Fe(CN)6]4-反应生成蓝色沉淀,而使试纸显蓝色。
精练:
1.(2018·福建高三高考模拟)元素铬(Cr)在自然界主要以+3价和+6价存在。
(1)+6价的Cr能引起细胞的突变而对人体不利,可用亚硫酸钠将其还原。离子反应方程式为:3SO32-+Cr2O72-+8H+===2Cr3++3SO42-+4H2O,该反应氧化剂和还原剂的物质的量之比为___________。
(2)工业上利用铬铁矿( FeO. Cr2O3)冶炼铬的工艺流程如图所示:
①为加快焙烧速率和提高原料的利用率,可采取的措施之一是___________。
②水浸Ⅰ要获得浸出液的操作是___________。
③浸出液的主要成分为Na2CrO4,加入Na2S反应后有Na2SO4生成,则操作Ⅱ发生反应的离子方程式为___________。
(3)常温下Cr(OH)3的溶度积Ksp=1×10-32,若要使Cr3+完全沉淀pH为___________[c(Cr3+)降至10-5mol·L-1可认为完全沉淀]。
(4)以铬酸钠(Na2CrO4)为原料,用电化学法可制备重铬酸钠(Na2Cr2O7),实验装置如图所示(已知:2CrO42-+2H+=Cr2O72-+H2O)。
①阳极的电极反应式为___________。
②电解一段时间后,测得阳极区溶液中Na+物质的量由amol变为bmol,则生成重铬酸钠的物质的量为___________mol。
【答案】1︰3 将铬铁矿粉碎(或其他合理措施) 过滤 8CrO42-+3S2-+20H2O===8Cr(OH)3↓+3SO42-+16OH- 5(或≥5) 2H2O﹣4e-===O2↑+4H+(或4OH-﹣4e-===O2↑+2H2O) (a-b)/2
【解析】(1)还原剂为SO32-,氧化剂为Cr2O72-,由离子反应方程式为:3SO32-+Cr2O72-+8H+===2Cr3++3SO42-+4H2O,该反应氧化剂和还原剂的物质的量之比为1︰3;
(2)①影响化学反应速率的因素有:固体物质的表面积、加热焙烧等,则可采取的措施是:将铬铁矿粉碎(或其他合理措施) 。
②可用过滤分离固体和液体,水浸Ⅰ要获得浸出液的操作是过滤;
③Na2CrO4将Na2S氧化成Na2SO4,由电子守恒和质量守恒得操作Ⅱ发生反应的离子方程式为:8CrO42-+3S2-+20H2O===8Cr(OH)3↓+3SO42-+16OH-
(3)KspCr(OH)3=c(Cr3+)×c3(OH-),若c(Cr3+)=10-5mol·L-1时,c(OH-)= mol·L-1=10-9mol·L-1,常温时c(H+)=10-5mol·L-1,pH=5(或≥5);
(4)①电解池中阳极发生氧化反应,电极反应式为4OH--4e-=2H2O+O2↑,故答案为:2H2O﹣4e-===O2↑+4H+(或4OH-﹣4e-===O2↑+2H2O);
②电解一段时间后,测得阳极区溶液中Na+物质的量由a mol变为b mol,则溶液中移动的电荷为(a-b)mol,所以外电路中转移的电子为(a-b)mol,阳极的电极反应为:2H2O-4e-=O2+4H+,则阳极生成的氢离子为(a-b)mol,已知:2CrO42-+2H+=Cr2O72-+H2O,所以阳极消耗的CrO42-为(a-b)mol,则生成重铬酸钠的物质的量为(a-b)/2mol。
2.(2019·湖北高三高考模拟)氧化锌是一种常用添加剂,广泛应用于塑料、合成橡胶、电池等产品的制造。一种利用氧化锌烟灰制备活性氧化锌的工艺流程如下:
已知:I.氧化锌烟灰的主要化学组成如下:
元素组成
Zn
Pb
Cu
Cl
F
质量分数%
59.78
9.07
0.30
2.24
1.80
Ⅱ.浸出”时,大部分锌元素以Zn(NH3)42+形式进入溶液,同时部分Pb、Cu、F元素也进入溶液中。
(1)氨的电子式______________________。
(2)“浸出”时,氧化锌发生反应的离子方程式为_________________________________;“浸出”时温度不宜过高,其原因为____________________________________________。
(3)若“浸出”后,所得溶液中c(F-)=0.02mol/L,向其中加入等体积的氯化钙溶液(忽略溶液体积变化),使F-沉淀完全即溶液中c(F-)<10-5
mol/L,则所加氯化钙溶液的浓度度最小为___________。已知:Ksp(CaF2)=3.45×10-11
(4)“置换”时,所得置换渣中除了含Zn外,还含有___________;“净化”时,利用活性炭___________性,除去溶液中残留的有机物。
(5)“沉淀”时,可得到滤渣Zn(NH3)2Cl2。所加盐酸过量时,会导致沉淀部分溶解甚至消失,其化学方程式为____________________________________________。
(6)“一次水解”时,产物为Zn(OH)xCly。取10.64g该水解产物,经二次水解、煅烧后,可得活性氧化锌8.1g(假设各步均转化完全)。则一次水解产物的化学式为___________。
【答案】 ZnO+2NH3+2NH4+=Zn(NH3)42++H2O 或 ZnO+2NH3·H2 O +2NH4+=Zn(NH3)42++3H2O 避免氨水的分解与挥发 0.70mol·L-1 Pb、Cu 吸附 Zn(NH3)2Cl2+2HCl=ZnCl2+2NH4Cl Zn(OH)1.6Cl0.4
【解析】(1)氨的分子式为NH3,其电子式为;
(2)根据信息,浸出时,大部分锌元素以Zn(NH3)42+形式存在溶液中,根据流程图,反应的离子方程式为ZnO+2NH3+2NH4+=Zn(NH3)42++H2O或ZnO++2NH3·H2O+2NH4+=Zn(NH3)42++3H2O;氨水易挥发,受热易分解,因此浸出时温度不宜过高原因是防止氨水的分解与挥发;
(3)取1Lc(F-)=0.02mol·L-1浸出液,加1L氯化钙溶液,令c(Ca2+)为xmol·L-1,混合后溶液体积为2L,溶液中留下的n(F-)=2L×10-5 mol·L-1=2×10-5 mol,沉淀的n(F-)=0.02mol·L-1×1L-2×10-5 mol≈0.02mol,沉淀的n(Ca2+)=0.01mol,Ksp((CaF2)=c(Ca2+).c2(F-)=3.45×10-11,余下的溶液中c(Ca2+)=3.45×10-11/(10-5)2=0.345mol·L-1,余下的溶液中n(Ca2+)=0.345mol/L×2L=0.69mol,故加入的c(Ca2+)=(0.69mol+0.01mol)/1L=0.70mol·L-1,使F- 沉淀完全即溶液中c(F-)<10-5mol·L-1,则所加氯化钙溶液的浓度度最小为0.70mol·L-1;
(4)根据氧化锌烟灰的成分,Zn的活泼性强于Pb、Cu,"置换"时,所得置换渣中除了含Zn外,还含有Pb、Cu;净化时,利用活性炭的吸附性,除去溶液中残留的有机物;
(5)“沉淀”时,可得到滤渣Zn(NH3)Cl2,所加盐酸过量时,会导致沉淀部分溶解甚至消失,其化学方程式为Zn(NH3)2Cl2+2HCl=ZnCl2+2NH4Cl;
(6)n(ZnO)=8.1g/81g·mol-1=0.1mol,根据原子守恒,Zn(OH)xCly的物质的量为0.1mol,则M(Zn(OH)xCly)=10.64g/0.1mol=106.4g·mol-1
,x+y=2,65+17x+35.5y=106.4,解得:x=1.6,y=0.4,则一次水解产物的化学式为Zn(OH)1.6Cl0.4。
2. 分段分析
典例1(2019·四川高三高考模拟)(华大新高考联盟2019届高三1月教学质量测评理科综合)镍钴锰酸锂电池是一种高功率动力电池。采用废旧锂离子电池回收工艺制备镍钴锰酸锂三元正极材料(LiNi1-x-y) Cox MnyO2)的工艺流程如下:
回答下列问题:
(1)能够提高碱浸效率的方法有________(至少写两种)。
(2)废旧锂离子电池拆解前进行“放电处理”有利于锂在正极的回收,其原因是________。
(3)LiCoO2中Co元素化合价为____,其参与“还原”反应的离子方程式为__________。
(4)溶液温度和浸渍时间对钻的浸出率影响如图所示:
则浸出过程的最佳条件是______。
(5)已知溶液中Co2+的浓度为1.0mol·L-1,缓慢通入氨气,使其产生Co(OH)2沉淀,列式计算Co2+沉淀完全时溶液的pH______(已知离子沉淀完全时c(Co2+)≤1.0×10-5mol·L-1,Ksp[Co(OH)2]=2.0×10-15,1g2=0.3,溶液体积变化忽略不计)
(6)写出“高温烧结固相合成”过程的化学方程式________。
【答案】减小原料粒径(或粉碎)、适当增加NaOH溶液浓度、适当升高温度、搅拌、多次浸取等 Li+
从负极中脱出,经由电解质向正极移动并进入正极材料中 +3价 2LiCoO2+6H++H2O2=2Li++2Co2++4H2O+O2↑ 75℃、30min Ksp[Co(OH)2]=c(Co2+)c2(OH-),c(OH-)===×10-5
c(H+)=Kw/ c(OH-)==10-9,pH=-lgc(H+)=-lg(10-9)=9.15 (4-4x-4y)Ni(OH)2+4xCo(OH)2+4yMn(OH)2+2Li2CO3+O24LiNi(1-x-y)CoxMnyO2+2CO2+4H2O
【解析】(1)提高浸出率的方法有减小原料粒径(或粉碎)、适当增加溶液浓度、适当升高温度、搅拌、多次浸取等方法。
故答案为:减小原料粒径(或粉碎)、适当增加NaOH溶液浓度、适当升高温度、搅拌、多次浸取等。
(2)废旧锂离子电池拆解前进行“放电处理”有利于锂在正极的回收,其原因是Li+从负极中脱出,经由电解质向正极移动并进入正极材料中。
故答案为:Li+从负极中脱出,经由电解质向正极移动并进入正极材料中。
(3)LiCoO2中Li元素为+1价,O元素为-2价,故Co元素化合价为+3价,LiCoO2为难溶物,H2SO4为强电解质,H2O2还原LiCoO2中+3价Co元素,反应的离子方程式为2LiCoO2+6H++H2O2=2Li++2Co2++4H2O+O2↑。
故答案为:+3价;2LiCoO2+6H++H2O2=2Li++2Co2++4H2O+O2↑。
(4)由图可知,在75℃、30min条件下钴的浸出率最高。
故答案为:75℃、30min。
(5)Ksp[Co(OH)2]=2.0×10-15,沉淀完全时c(OH-)===10-5mol/L,c(H+)=Kw/ c(OH-)==10-9,pH=-lgc(H+)=-lg(10-9)=9.15
故答案为:9.15。
(6)Ni2+、Co2+、Mn2+与NH3H2O反应分别生成Ni(OH)2、Co(OH)2、Mn(OH)2与Li2CO3,高温烧结固相合成LiNi(1-x-y)CoxMnyO2,根据原子守恒可得到化学方程式为(4-4x-4y)Ni(OH)2+4xCo(OH)2+4yMn(OH)2+2Li2CO3+O24LiNi(1-x-y)CoxMnyO2+2CO2+4H2O。
故答案为:(4-4x-4y)Ni(OH)2+4xCo(OH)2+4yMn(OH)2+2Li2CO3+O24LiNi(1-x-y)CoxMnyO2+2CO2+4H2O。
典例2 (2018·河南高三高考模拟)氧化材料具有高硬度、高强度、高韧性、极高的耐磨性及耐化学腐蚀性等优良的物化性能。以锆英石(主要成分为 ZrSiO4,含有少量Al2O3、SiO2、Fe2O3
等杂质)为原料通过碱熔法制备氧化锆(ZrO2)的流程如下:
25℃时,有关离子在水溶液中沉淀时的pH数据:
Fe(OH)3
Zr(OH)4
Al(OH)3
开始沉淀时pH
1.9
2.2
3.4
沉淀完全时pH
3.2
3.2
4.7
请回答下列问题:
(1)流程中旨在提高化学反应速率的措施有___________。
(2)操作I的名称是___________滤渣2的成分为___________。
(3)锆英石经“高温熔融”转化为Na2ZrO3,写出该反应的化学方程式:___________。
(4)“调节pH”时,合适的pH范围是___________。为了得到纯的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是___________。
(5)写出“高温煅烧”过程的化学方程式___________。根据ZrO2的性质,推测其两种用途___________。
【答案】粉碎、高温 过滤 硅酸(H2SiO3或H4SiO4) ZrSiO4+4NaOHNa2ZrO3+Na2SiO3+2H2O 3.2
查看更多