- 2021-07-06 发布 |
- 37.5 KB |
- 6页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届二轮复习陌生化学方程式的书写专题学案
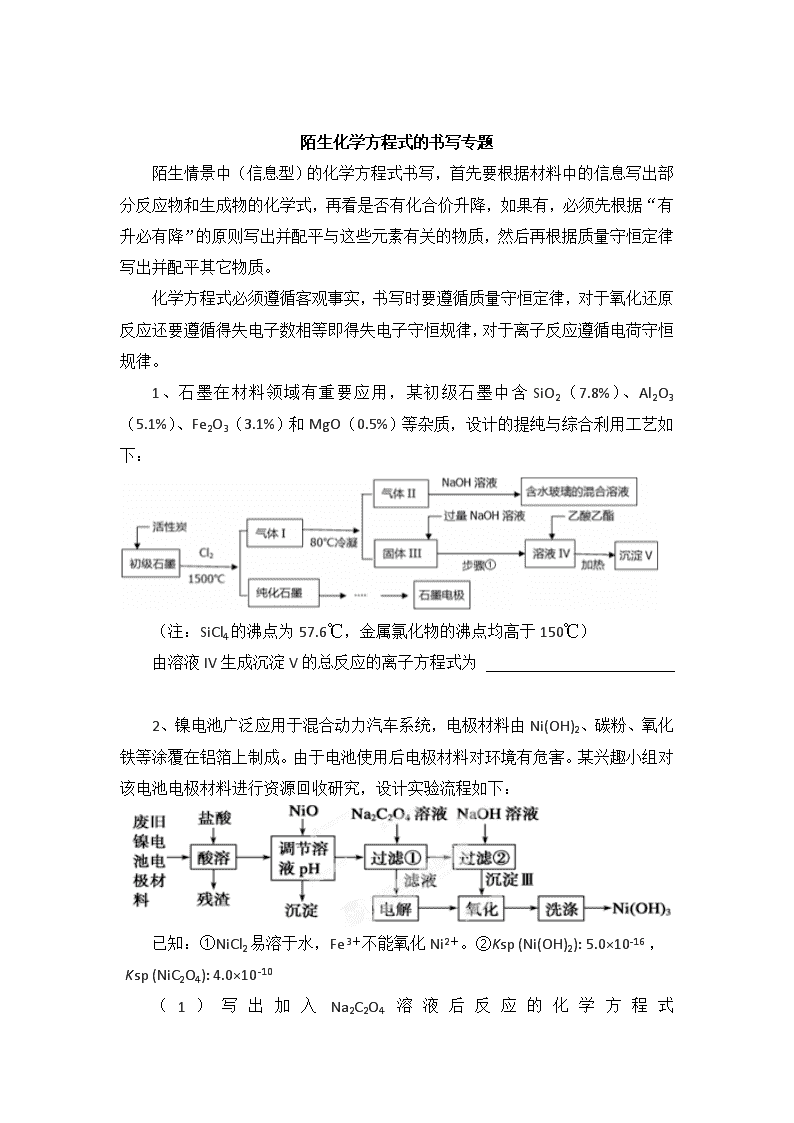
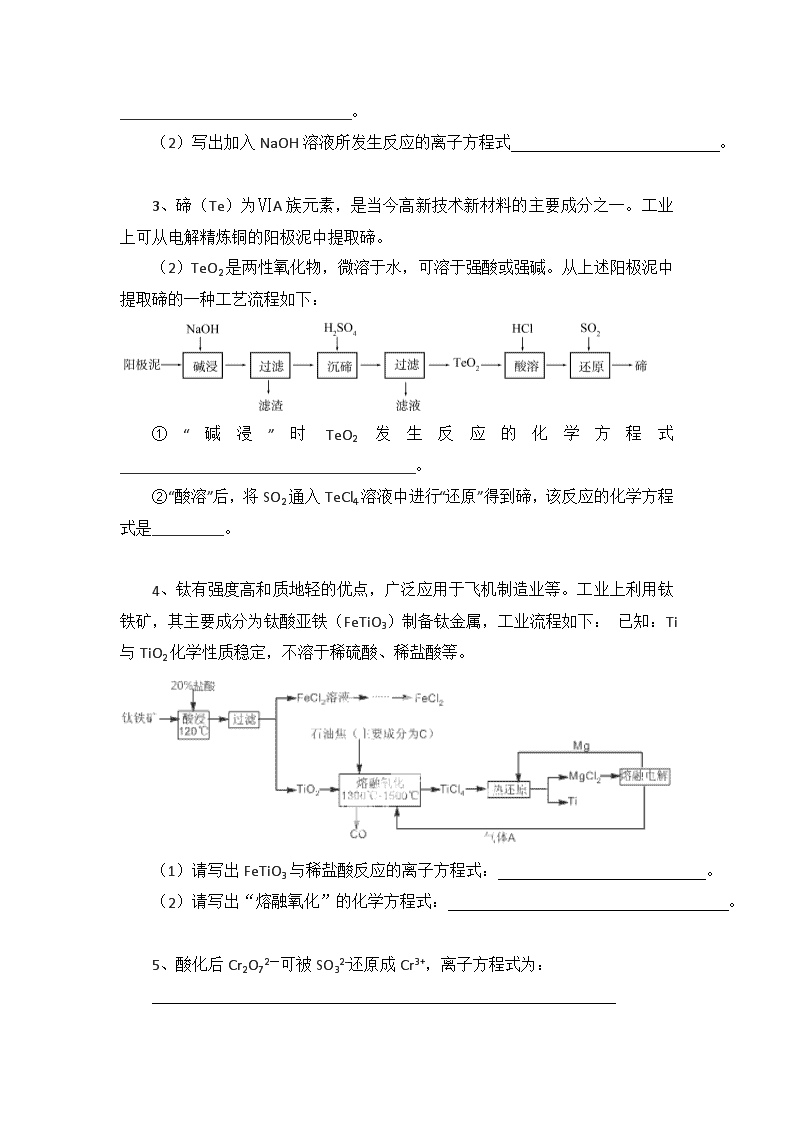
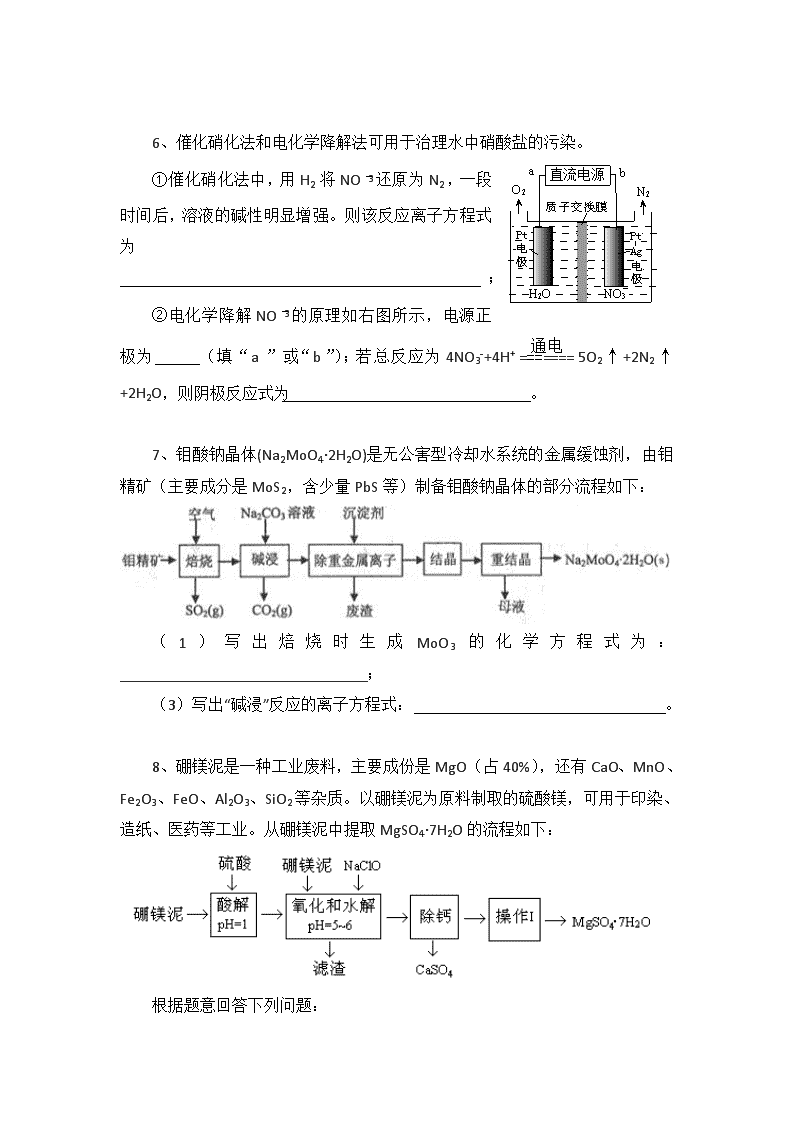
陌生化学方程式的书写专题 陌生情景中(信息型)的化学方程式书写,首先要根据材料中的信息写出部分反应物和生成物的化学式,再看是否有化合价升降,如果有,必须先根据“有升必有降”的原则写出并配平与这些元素有关的物质,然后再根据质量守恒定律写出并配平其它物质。 化学方程式必须遵循客观事实,书写时要遵循质量守恒定律,对于氧化还原反应还要遵循得失电子数相等即得失电子守恒规律,对于离子反应遵循电荷守恒规律。 1、石墨在材料领域有重要应用,某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质,设计的提纯与综合利用工艺如下: (注:SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃) 由溶液IV生成沉淀V的总反应的离子方程式为 2、镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下: 已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。②Ksp (Ni(OH)2): 5.0×10-16 , Ksp (NiC2O4): 4.0×10-10 (1)写出加入Na2C2O4 溶液后反应的化学方程式_____________________________。 (2)写出加入NaOH溶液所发生反应的离子方程式 。 3、碲(Te)为ⅥA族元素,是当今高新技术新材料的主要成分之一。工业上可从电解精炼铜的阳极泥中提取碲。 (2)TeO2是两性氧化物,微溶于水,可溶于强酸或强碱。从上述阳极泥中提取碲的一种工艺流程如下: ①“碱浸”时TeO2发生反应的化学方程式_____________________________________。 ②“酸溶”后,将SO2通入TeCl4溶液中进行“还原”得到碲,该反应的化学方程式是_________。 4、钛有强度高和质地轻的优点,广泛应用于飞机制造业等。工业上利用钛铁矿,其主要成分为钛酸亚铁(FeTiO3)制备钛金属,工业流程如下: 已知:Ti与TiO2化学性质稳定,不溶于稀硫酸、稀盐酸等。 (1)请写出FeTiO3与稀盐酸反应的离子方程式: 。 (2)请写出“熔融氧化”的化学方程式: 。 5、酸化后Cr2O72-可被SO32-还原成Cr3+,离子方程式为: 6、催化硝化法和电化学降解法可用于治理水中硝酸盐的污染。 ①催化硝化法中,用H2将NO还原为N2,一段时间后,溶液的碱性明显增强。则该反应离子方程式为 ; ②电化学降解NO的原理如右图所示,电源正极为 (填“a”或“b”);若总反应为4NO3-+4H+5O2↑+2N2↑+2H2O,则阴极反应式为 。 7、钼酸钠晶体(Na2MoO4·2H2O)是无公害型冷却水系统的金属缓蚀剂,由钼精矿(主要成分是MoS2,含少量PbS等)制备钼酸钠晶体的部分流程如下: (1)写出焙烧时生成MoO3的化学方程式为:_______________________________; (3)写出“碱浸”反应的离子方程式: 。 8、硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质。以硼镁泥为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下: 根据题意回答下列问题: 加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式是 。 在调节pH、发生水解之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为 。 9、高铁酸钾(K2FeO4)是一种绿色净水剂,具有净水和消毒双重功能。高铁酸钾中铁元素的化合价为____价,干法制备K2FeO4的方法是将Fe2O3、KNO3、4KOH三者混合共热制得,同时生成了KNO2,请写出化学方程式: ; 湿法是在强碱溶液中将NaClO、、Fe2(SO4)3混合,写出该反应的离子方程式 。 10、辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下: 写出浸取过程中Cu2S溶解的离子方程式 。 陌生化学方程式的书写专题参考答案 1、AlO2- +CH3COOCH2CH3+2H2O CH3COO- + Al(OH)3↓+CH3CH2OH 2、(1) NiCl2+Na2C2O4==NiC2O4↓+2NaCl (2) NiC2O4 +2OH- ≒ Ni(OH)2+C2O42- 3、TeO2+2NaOH==Na2TeO3+H2O TeCl4+2SO2+4H2O==Te+4HCl+2H2SO4 (2)TiO2+2C+2Cl2 ========= TiCl4+2CO 1300℃~1500℃ 4、(1)FeTiO3+2H+=====Fe2++TiO2+H2O 120℃ 催化剂 5、3SO32-+Cr2O72-+8H+===2Cr3++3SO42-+4H2O 高温 6、①2NO3 -+5H2======N2+2OH-+4H2O ②a 2NO3-+12H++10e-===N2↑+6H2O 7、(1)2MoS2+7O2=====2MoO3+4SO2 (2)MoO3+CO32-===MoO42-+CO2↑ 8、Mn2++ClO-+H2O===MnO2↓+2H++Cl- 2Fe2++ClO-+2H+===2Fe3++Cl-+H2O 9、Fe2O3 + 3KNO3 + 4KOH △ 2K2FeO4 + 3KNO3 + 2H2O ; 3ClO– + 10OH– + 2Fe3+=2FeO42– + 3Cl– + 5H2O 10、Cu2S+4Fe3+=2Cu2++4Fe2++S 查看更多