- 2021-07-06 发布 |
- 37.5 KB |
- 35页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019高考化学高分突破二轮复习专题十二氯、溴、碘及其化合物课件(35张PPT)
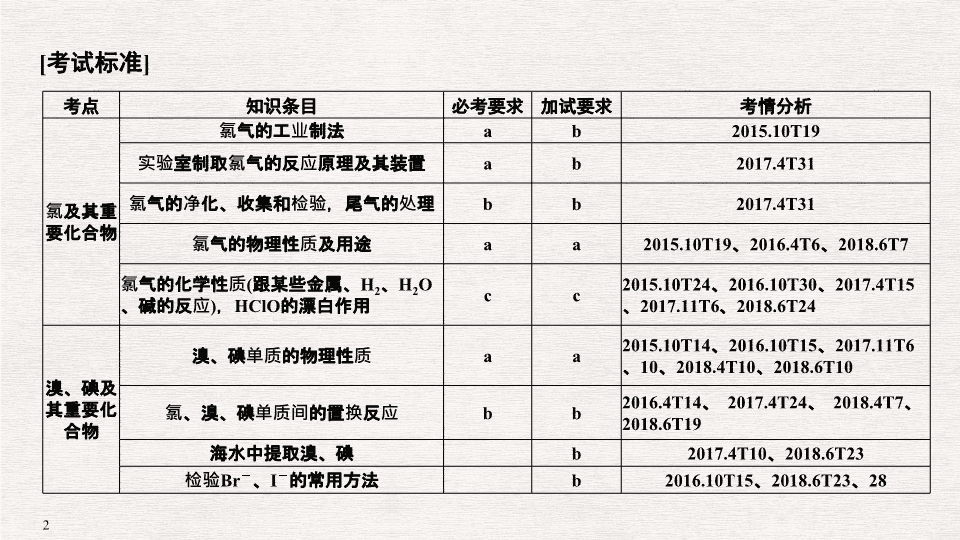
专题十二 氯、溴、碘及其化合物 [ 考试标准 ] 考点 知识条目 必考要求 加试要求 考情分析 氯及其重要化合物 氯气的工业制法 a b 2015.10T19 实验室制取氯气的反应原理及其装置 a b 2017.4T31 氯气的净化、收集和检验,尾气的处理 b b 2017.4T31 氯气的物理性质及用途 a a 2015.10T19 、 2016.4T6 、 2018.6T7 氯气的化学性质 ( 跟某些金属、 H 2 、 H 2 O 、碱的反应 ) , HClO 的漂白作用 c c 2015.10T24 、 2016.10T30 、 2017.4T15 、 2017.11T6 、 2018.6T24 溴、碘及其重要化合物 溴、碘单质的物理性质 a a 2015.10T14 、 2016.10T15 、 2017.11T6 、 10 、 2018.4T10 、 2018.6T10 氯、溴、碘单质间的置换反应 b b 2016.4T14 、 2017.4T24 、 2018.4T7 、 2018.6T19 海水中提取溴、碘 b 2017.4T10 、 2018.6T23 检验 Br - 、 I - 的常用方法 b 2016.10T15 、 2018.6T23 、 28 考点一:氯气的性质 1. (2018· 嘉兴一中 ) 铁屑和氯气在 500 ~ 600 ℃ 下可制取无水 FeCl 3 ,实验装置如下图。下列说法正确的是 ( ) A. 分液漏斗中盛放的试剂是稀盐酸 B. 实验时应先点燃 I 处的酒精灯,再点燃 Ⅲ 处的酒精灯 C. 装置 Ⅱ 中盛放的试剂是饱和食盐水 D. 烧杯中盛放的试剂是石灰水,目的是吸收尾气 解析 A . 装置 Ⅰ 是制备氯气,分液漏斗中应该盛放的试剂是浓盐酸,选项 A 错误; B. 实验时应先点燃 I 中酒精灯先制备氯气,用氯气排尽装置 Ⅲ 中的空气后,再点燃 Ⅲ 中酒精灯,选项 B 正确; C. 洗气瓶中盛放的试剂是浓硫酸,干燥氯气,选项 C 错误; D. 澄清石灰水对氯气的吸收效果差,烧杯中盛放的试剂是浓氢氧化钠溶液,目的是吸收尾气,避免污染空气,选项 D 错误。答案选 B 。 答案 B 考点二:氯水的成分和性质 2. (2018· 浙江省桐乡一中高一 ) 常温下,将 Cl 2 缓慢通入 100 mL 水中至饱和,然后向所得饱和氯水中逐滴加入 0.1 mol/L NaOH 溶液,整个过程中 pH 的变化如图所示。下列有关叙述正确的是 ( ) A. 曲线 ③④ 段有离子反应: HClO + OH - ===ClO - + H 2 O B. 可依据 ② 处数据计算所溶解的 n (Cl 2 ) C. ③ 处表示氯气与氢氧化钠溶液恰好反应完全 D. ① 处 c (H + ) 约为 ② 处 c (H + ) 的 2 倍 解析 由题图看出 ③ 处 pH = 7 ,此时溶液中的溶质为 NaCl 、 NaClO 、 HClO ,所以 ③④ 段有化学反应: HClO + NaOH===NaClO + H 2 O ,其离子方程式为 HClO + OH - ===H 2 O + ClO - , A 正确;由 ② 处数据无法计算所溶解的 n (Cl 2 ) , B 错; Cl 2 与 NaOH 恰好完全反应时产物为 NaCl 、 NaClO ,溶液显碱性, pH 不等于 7 , C 错; ② 处 pH 小于 ① 处,所以 ② 处 c (H + ) 大于 ① 处, D 错。 答案 A 考点三:氯气制备的综合考查 3. (2018· 浙江省桐乡一中 ) 某化学兴趣小组为探究 Cl 2 、 Br 2 、 Fe 3 + 的氧化性强弱,设计如下实验: (1) ① 检查气体发生装置 A 的气密性的操作是 ___________________ __________ ___ __________________________________________________________ __________ _ 。 ② 整套实验装置存在一处明显的不足,请指出: _______________ __________ __ _______________________________________ __________ ____________________ 。 (2) 用改正后的装置进行实验,实验过程如下: 实验操作 实验现象 结论 打开活塞 a ,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞 a ,点燃酒精灯 D 装置中:溶液变红 E 装置中:水层溶液变黄,振荡后, CCl 4 层无明显变化 Cl 2 、 Br 2 、 Fe 3 + 的氧化性由强到弱的顺序为 __________________ (3) 因忙于观察和记录,没有及时停止反应, D 、 E 中均发生了新的变化。 D 装置中:红色慢慢褪去。 E 装置中: CCl 4 层先由无色变为橙色,后颜色逐渐加深,直至变成红色。为探究上述实验现象的本质,小组同学查得资料如下: Ⅰ .(SCN) 2 性质与卤素单质类似。氧化性: Cl 2 >(SCN) 2 。 Ⅱ .Cl 2 和 Br 2 反应生成 BrCl ,它呈红色 ( 略带黄色 ) ,沸点约 5 ℃ ,与水发生水解反应。 Ⅲ .AgClO 、 AgBrO 均可溶于水。 ① 请用平衡移动原理 ( 结合化学用语 ) 解释 Cl 2 过量时 D 中溶液红色褪去的原因 ___________________________________________________________ ___________________________________________________________ , 请设计简单实验证明上述解释: ___________________________________ 。 ② 欲探究 E 中颜色变化的原因,设计实验如下:用分液漏斗分离出 E 的下层溶液,蒸馏、收集红色物质,取少量,加入 AgNO 3 溶液,结果观察到仅有白色沉淀产生。请结合化学用语解释仅产生白色沉淀的原因: ______________________________ 。 ③ 将少量 BrCl 通入到碘化钾溶液中,该反应的化学方程式为 ___________________________________________________________ 。 解析 (1) ① 检查装置 A 的气密性一般采用热膨胀法:关闭活塞 a ,打开止水夹 b ,将长导管末端浸入水中,并用酒精灯对圆底烧瓶微热 ( 或用手捂热 ) ,如果导管口有气泡冒出,撤去酒精灯 ( 或松开手 ) 后导管中上升一段水柱,则装置气密性良好。 ② 氯气有毒,必须有尾气处理装置。 (2)E 装置中的现象说明溶液中 Fe 2 + 被氧化而 Br - 未被氧化,所以 Fe 2 + 的还原性强于 Br - ,即 Br 2 的氧化性强于 Fe 3 + 。 考点四:卤素单质之间的相互转化 4. (2017· 浙江省温州中学 ) A 、 B 、 C 三支试管中分别盛有 Cl - 、 Br - 、 I - 的溶液 . 向试管 A 中加入淀粉溶液和新制氯水,溶液变成橙色;再将此溶液倒入试管 C 中,无明显现象。 A 、 B 、 C 三支试管中所含有的离子依次是 ( ) A.I - 、 Br - 、 Cl - B.Br - 、 Cl - 、 I - C.Cl - 、 I - 、 Br - D.Br - 、 I - 、 Cl - 解析 已知氧化性 Cl 2 > Br 2 > I 2 ,向 A 中加淀粉溶液和新制的 Cl 2 水变为橙色,发生的反应为: 2Br - + Cl 2 ===Br 2 + 2Cl - ,说明 A 中含有 Br - ,再将此溶液 ( 含有溴单质 ) 倒入 C 试管中,无变化,证明 C 中一定不含 I - ,则 C 中含有 Cl - ,所以 B 中含有 I - ,则 A 、 B 、 C 三支试管中所盛有的离子依次是 Br - 、 I - 、 Cl - 。 答案 D 考点五:卤素离子的检验 5. (2016· 浙江省嘉兴一中高一上期末 ) 下列能够检验出 KI 中是否含有 Br - 的实验是 ( ) A. 加入足量的新制氯水,溶液变色则有 Br - B. 加入酸性 KMnO 4 溶液,观察溶液颜色是否褪去 C. 加入少量的碘水,再加入 CCl 4 振荡,有机层有色,则有 Br - D. 加入足量 FeCl 3 溶液,用 CCl 4 萃取后,取无色的水层并加入 AgNO 3 溶液,有淡黄色沉淀生成,则含有 Br - 解析 A 项,在 KI 中加入足量新制氯水,也会置换出单质碘而使溶液变色,故不能根据溶液变色确定是否含有溴离子; B 项,溴离子和碘离子均能使酸性高锰酸钾溶液褪色; C 项,加入少量的碘水,再加入 CCl 4 振荡,有机层可能是萃取单质碘而显色,并没有溴单质产生。 答案 D 考点六:海水中提取溴、碘 ( 加试 ) 6. (2018· 浙江绍兴高三适应性测试 ) 实验室从含碘废液 ( 除 H 2 O 外,含有 CCl 4 、 I 2 、 I - 等 ) 中回收碘,其操作流程如下: 答案 C 考点七:海水资源的开发和利用 7. (2017· 宁波北仑中学 ) Ⅰ . 我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务。 (1) 被称作海洋元素的是 ________( 写元素符号 ) 。 (2) 工业上常以食盐为原料制备氯气,再用氯气制备漂白粉,请写出漂白粉长期露置在空气中变质失效的化学反应方程式 ___________________________ ___________________________________________________________ 。 (3) 从海水中提取食盐和溴的过程如下: ① 步骤 Ⅰ 中已获得 Br 2 ,步骤 Ⅱ 中又将 Br 2 还原为 Br - ,其目的为富集溴元素,请写出步骤 Ⅱ 的化学方程式 _____________________________________ ___________________________________________________________ 。 ② 在 3 mL 溴水中,加入 1 mL 四氯化碳,振荡、静置后,观察到试管里的分层现象为图中 ________ 。 Ⅱ . 某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料, Br 2 的沸点为 59 ℃ ,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,设计了如下装置简图: 请你回答下列问题: (1) 仪器 B 的名称为 ________ 。 (2) 实验装置气密性良好,要在 C 中获得纯净的液溴即达到提纯溴的目的,操作中控制的关键条件是: __________________________________________ ___________________________________________________________ 。 (3) 为除去该产物中仍残留的少量 Cl 2 ,可向其中加入 ________ 溶液,充分反应后,再进行的分离操作是 _________________________________________ ___________________________________________________________ 。 易错点一 对氯气、氯水和液氯认识的常见误区 1. 误认为 Cl 2 具有漂白性。其实不然,只有 Cl 2 遇到水生成的 HClO 具有漂白性,干燥的 Cl 2 没有漂白性。 2. 液氯密封在钢瓶中,而氯水、次氯酸应保存在棕色试剂瓶中。 3.1 mol Cl 2 参加反应,转移电子数可能为 2 N A 、 1 N A 或小于 1 N A (Cl 2 和 H 2 O 的反应为可逆反应 ) 。 4. 氯水和液氯是不同的。氯气的水溶液称为氯水,其中会存在 H 2 O 、 Cl 2 、 HClO 、 H + 、 Cl - 、 ClO - 、 OH - ;液氯是纯净物,只含有 Cl 2 。 [ 易错训练 1] (2017· 浙江宁波北仑中学 ) 如图所示是一种研究某气体化学性质的实验装置,图中 B 为开关。如先打开 B ,在 A 处通入干燥氯气, C 中红色布条颜色无变化;当关闭 B 时, C 处红色布条颜色褪去。则 D 瓶中盛有的溶液是 ( ) A. 浓 H 2 SO 4 B. 石灰乳 C. 浓 NaOH 溶液 D. 饱和 NaCl 溶液 解析 打开开关 B ,气体直接进入 C 试管中,布条并不褪色,这是因为干燥的氯气没有漂白作用。关闭开关 B ,氯气经过洗气瓶的溶液后再进入试管 C 中。氯气经过 D 中的溶液时存在两种情况: ① 气体可能会与溶液中的物质反应,如选项 C 中 NaOH 溶液和选项 B 中石灰乳,这种情况下,氯气被消耗,试管 C 中的红色布条因接触不到湿润的氯气而保持颜色不变; ② 气体会把溶液中的水分带出,如选项 D 中的饱和 NaCl 溶液,此时干燥的氯气变为湿润的,可以使红色布条颜色褪去,故 D 瓶中盛有的溶液是饱和 NaCl 溶液。 答案 D [ 易错训练 2] (2017· 浙江义乌群星外国语学校 ) 用 1 mol MnO 2 和含 HCl 为 4 mol 的浓盐酸充分反应 ( 共热 ) ,在不考虑 HCl 挥发的情况下,得到的氯气的物质的量 ( ) A. 等于 2 mol B. 等于 1 mol C. 小于 1 mol D. 大于 2 mol 答案 C [ 易错训练 3] (2018· 浙江舟山中学 ) 实验室用图示装置制备 KClO 溶液,再与 KOH 、 Fe(NO 3 ) 3 溶液反应制备高效净水剂 K 2 FeO 4 。 查阅资料 Cl 2 与 KOH 溶液在 20 ℃ 以下反应生成 KClO ,在较高温度下则生成 KClO 3 ; K 2 FeO 4 易溶于水,微溶于浓 KOH 溶液,在 0 ℃ ~ 5 ℃ 的强碱性溶液中较稳定。 (1) 装置 C 中三颈瓶置于冰水浴中的目的是 _______________________ 。 (2) 装置 B 吸收的气体是 ________ ,装置 D 的作用是 ___________________ 。 (3)C 中得到足量 KClO 后,将三颈烧瓶上的导管取下,依次加入 KOH 溶液、 Fe(NO 3 ) 3 溶液,水浴控制反应温度为 25 ℃ ,搅拌 1.5 h ,溶液变为紫红色 ( 含 K 2 FeO 4 ) ,该反应的离子方程式为 _______________________________________ 。 再加入饱和 KOH 溶液,析出紫黑色晶体,过滤,得到 K 2 FeO 4 粗产品。 (4)K 2 FeO 4 粗产品含有 Fe(OH) 3 、 KCl 等杂质,其提纯步骤为: ① 将一定量的 K 2 FeO 4 粗产品溶于冷的 3 mol/LKOH 溶液中。 ② 过滤。 ③ ___________________________________________________________ 。 ④ 搅拌、静置、过滤,用乙醇洗涤 2 ~ 3 次。 ⑤ 在真空干燥箱中干燥。 (4)K 2 FeO 4 易溶于水、微溶于浓 KOH 溶液,所以提纯 K 2 FeO 4 粗产品时可以 ① 将一定量的 K 2 FeO 4 粗产品溶于冷的 3 mol/LKOH 溶液中, ② 过滤, ③ 将滤液置于冰水浴中,向滤液中加入饱和 KOH 溶液, ④ 搅拌、静置、过滤,用乙醇洗涤 2 ~ 3 次, ⑤ 在真空干燥箱中干燥,故答案为:将滤液置于冰水浴中,向滤液中加入饱和 KOH 溶液。查看更多