- 2021-07-06 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020_2021学年高中化学专题1化学家眼中的物质世界2_1过滤和蒸发课时作业含解析苏教版必修1
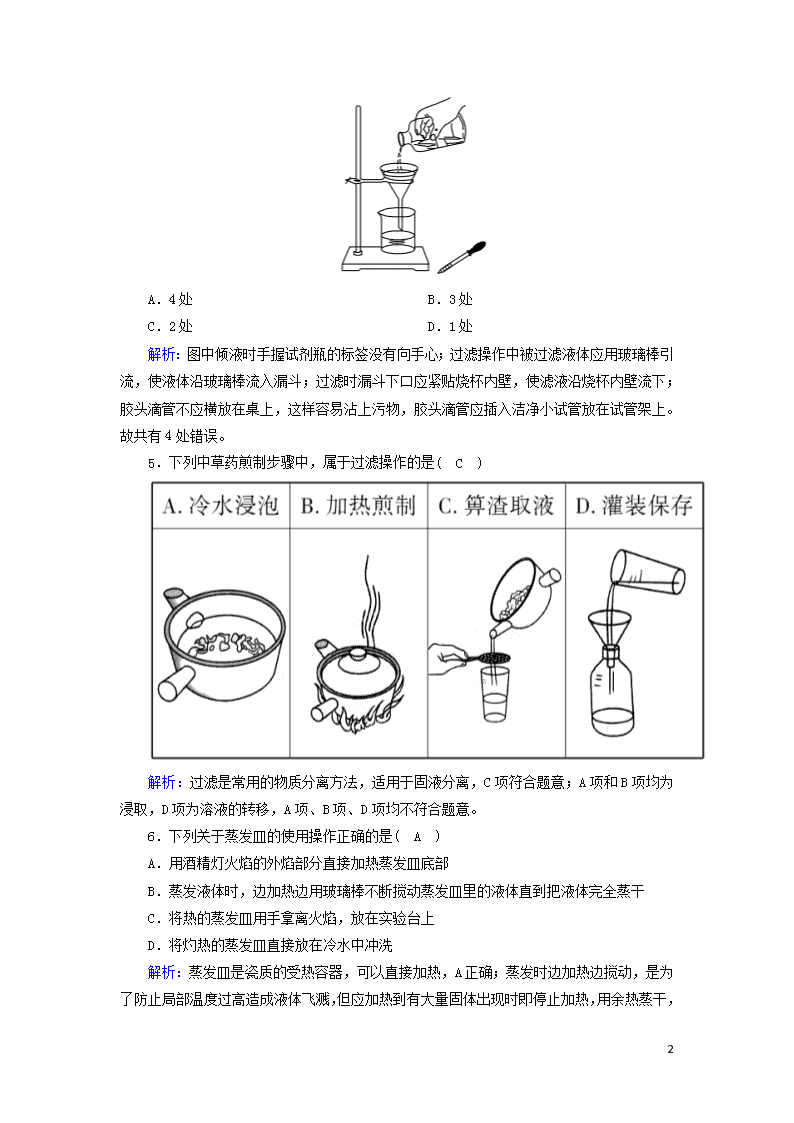
课时作业5 过滤和蒸发 时间:45分钟 满分:100分 一、选择题(每小题4分,共48分) 1.能用溶解、过滤、结晶的方法来分离的一组物质是( B ) A.NaCl和Na2SO4 B.CuO和KCl C.BaSO4和CaCO3 D.NaNO3和NaOH 解析:A、D两项中两种物质均溶于水,无法用过滤法分离;B项中CuO不溶于水,KCl易溶于水,可通过溶解、过滤的方法分离,再蒸发滤液结晶可得KCl;C项中两种物质均不溶于水,无法用过滤法分离。 2.欲除去下列物质中的杂质(括号内物质为杂质),所用试剂不正确的是( B ) A.KNO3溶液(K2SO4):适量Ba(NO3)2溶液 B.CaCO3粉末(CaCl2):过量盐酸 C.Cu粉(Zn粉):过量盐酸 D.CO2(O2):灼热的铜网 解析:K2SO4+Ba(NO3)2===BaSO4↓+2KNO3,A正确;盐酸能够将CaCO3完全溶解,B错误;Zn+2HCl===ZnCl2+H2↑,Cu与盐酸不反应,故C正确;2Cu+O2△,2CuO,D正确。 3.某固体NaOH因吸收了空气中的CO2而含有杂质,现在要将该固体NaOH配制成较纯的溶液,则其主要的实验操作过程应是( C ) A.溶解、加适量BaCl2溶液、过滤 B.溶解、加适量CaCl2溶液、过滤 C.溶解、加适量Ca(OH)2溶液、过滤 D.溶解、加适量盐酸、加热 解析:NaOH固体因吸收了空气中的CO2而含有杂质Na2CO3,除去杂质Na2CO3但又不能引进新的杂质,故选加适量Ca(OH)2溶液,然后过滤,C项正确。 4.某学生发现滴瓶中的溶液有悬浮物,拟用如右图所示操作进行过滤,操作上错误的地方有( A ) 8 A.4处 B.3处 C.2处 D.1处 解析:图中倾液时手握试剂瓶的标签没有向手心;过滤操作中被过滤液体应用玻璃棒引流,使液体沿玻璃棒流入漏斗;过滤时漏斗下口应紧贴烧杯内壁,使滤液沿烧杯内壁流下;胶头滴管不应横放在桌上,这样容易沾上污物,胶头滴管应插入洁净小试管放在试管架上。故共有4处错误。 5.下列中草药煎制步骤中,属于过滤操作的是( C ) 解析:过滤是常用的物质分离方法,适用于固液分离,C项符合题意;A项和B项均为浸取,D项为溶液的转移,A项、B项、D项均不符合题意。 6.下列关于蒸发皿的使用操作正确的是( A ) A.用酒精灯火焰的外焰部分直接加热蒸发皿底部 B.蒸发液体时,边加热边用玻璃棒不断搅动蒸发皿里的液体直到把液体完全蒸干 C.将热的蒸发皿用手拿离火焰,放在实验台上 D.将灼热的蒸发皿直接放在冷水中冲洗 解析: 8 蒸发皿是瓷质的受热容器,可以直接加热,A正确;蒸发时边加热边搅动,是为了防止局部温度过高造成液体飞溅,但应加热到有大量固体出现时即停止加热,用余热蒸干,B错;热的蒸发皿不能用手拿,应用坩埚钳夹持,且热的蒸发皿直接放在实验台上,容易烫坏实验台,C错误;灼热的蒸发皿骤冷易炸裂,D错误。 7.NaCl和KNO3的溶解度与温度的关系如图所示。实验室提纯KNO3(含少量NaCl)的过程如图所示。下列叙述正确的是( C ) A.操作Ⅰ是过滤,将杂质分离除去 B.操作Ⅱ是蒸发浓缩、趁热过滤,除去NaCl杂质 C.操作Ⅲ是过滤、洗涤,将KNO3晶体从溶液中分离出来 D.操作Ⅰ~Ⅲ共需要两次过滤 解析:因为KNO3的溶解度随温度变化较大,NaCl的溶解度随温度变化较小,可经过加蒸馏水溶解、蒸发浓缩、冷却结晶、过滤、洗涤、干燥等一系列操作得到KNO3晶体。操作Ⅰ是溶解,错误;操作Ⅱ是蒸发浓缩、冷却结晶,目的是析出KNO3晶体,错误;操作Ⅲ是过滤、洗涤,目的是将KNO3晶体从溶液中分离出来,正确;操作Ⅰ~Ⅲ中只有Ⅲ需要过滤,错误。 8.对下列未知盐的稀溶液所含离子的检验中,作出的判断一定正确的是( A ) A.当加入氯化钡溶液时不产生沉淀,重新加入硝酸银溶液时,有不溶于稀硝酸的白色沉淀生成,可判定含有Cl- B.加入硝酸钡溶液有白色沉淀生成,再加稀盐酸酸化沉淀不消失,可判定含有SO C.加入NaOH溶液,有白色沉淀产生,可判定含有Mg2+ D.加入盐酸后有无色气体逸出,此气体能使澄清石灰水变浑浊,可判定含有CO 解析:A项中加氯化钡不产生沉淀,说明溶液中没有SO、SO、CO、PO、Ag+等,加入硝酸银产生白色沉淀,一定含有氯离子,A判断正确;B项中加硝酸钡产生白色沉淀,可能有SO、SO、CO、PO离子,加稀盐酸酸化沉淀不消失,排除了CO、PO离子,硫酸钡不溶于盐酸和硝酸,亚硫酸钡能溶于盐酸,也溶于硝酸,但该溶液中先加入了硝酸钡后加盐酸,溶液中就有了硝酸,可把亚硫酸钡氧化为不溶于硝酸的硫酸钡,因此该待测液中可能只含有SO 8 ,也可能只含有SO,还可能既含有SO又含有SO,所以B项判断不正确;C项中加入NaOH溶液能产生白色沉淀的离子并非只有Mg2+,Al(OH)3、Zn(OH)2等也是白色难溶的物质,所以C项不正确;D项中也可能是含碳酸氢根离子所致,故判断含有CO是片面的,D项不正确。 9.提纯含有少量Ba(NO3)2杂质的KNO3溶液,可以使用的方法为( D ) A.加入过量的Na2CO3溶液,过滤,向滤液中滴加适量的稀硝酸 B.加入过量的K2SO4溶液,过滤,向滤液中滴加适量的稀硝酸 C.加入过量的Na2SO4溶液,过滤,向滤液中滴加适量的稀硝酸 D.加入过量的K2CO3溶液,过滤,向滤液中滴加适量的稀硝酸 解析:杂质离子为Ba2+,可加CO或SO,使之形成沉淀除去,但为了不引入新的杂质,需用钾盐,可选用K2CO3溶液,过量的K2CO3滴加适量稀硝酸可除去,若使用K2SO4,则在后续步骤中无法除去过量的K2SO4。 10.欲除去某溶液里混有的少量杂质,下列做法中不正确的是(括号内的物质为杂质)( B ) A.NaCl溶液(BaCl2):加过量Na2CO3溶液,过滤,加适量盐酸,加热 B.KNO3溶液(AgNO3):加入过量KCl溶液,过滤 C.NaCl溶液(Br2):加CCl4,萃取、分液 D.碘单质(NaCl):加热升华后,再凝华 解析:BaCl2和Na2CO3反应生成BaCO3沉淀,过滤后,过量的Na2CO3可与盐酸反应被除去,加热可除去剩余的HCl,A项正确;KCl过量,引入新杂质,应加入适量的KCl溶液,B项错误;Br2易溶于CCl4,可用萃取、分液的方法分离,C项正确;I2易升华,NaCl难分解,D项正确。 11.下列实验操作中,正确的是( D ) 8 解析:A项,移开加热的蒸发皿要用坩埚钳夹持,否则会把手烫伤;B项,给试管加热,不能把试管口堵上,易发生危险;C项,向试管中滴加液体时,胶头滴管应竖直放在试管口的正上方,而不能插入到试管中;D项正确。 12.要除去下列四种物质中的少量杂质(括号内物质为杂质)。 甲:CaCO3(Na2CO3) 乙:NaOH(Na2CO3) 丙:KCl(KHCO3) 丁:炭粉(氧化铜) 可选用的试剂及操作方法有: ①加适量盐酸,搅拌,过滤 ②加适量水,搅拌,过滤 ③加适量盐酸,蒸发 ④溶解,加适量石灰水,过滤,蒸发 下列组合正确的是( A ) A.甲—②,乙—④ B.乙—③,丙—③ C.丙—①,丁—② D.丙—③,丁—④ 二、非选择题(共52分) 13.(10分)除去下列物质中混有的少量杂质(杂质不要求回收),把适当的试剂、操作方法的序号写在相应的括号内。 a.加适量盐酸、过滤 b.加适量水、过滤、蒸发 c.加适量水、过滤 d.加热(高温或灼烧) e.加适量盐酸、蒸发 f.冷却热的饱和溶液、过滤 (1)碳酸钙中混有少量的碳酸钠 ( c ) (2)氯化钾粉末中混有碳酸钾 ( e ) 8 (3)氧化钙中混有少量的碳酸钙 ( d ) (4)二氧化锰中混有少量的炭粉 ( d ) (5)硝酸钾中混有少量的食盐 ( f ) 解析:(1)中利用CaCO3不溶于水,Na2CO3易溶于水,加水,过滤干燥即可除杂。 (2)中KCl和K2CO3均易溶于水,故不能用过滤法分离;可用盐酸反应后,再将溶液蒸发即得到氯化钾晶体。 (3)中利用高温分解法,使CaCO3分解除去并生成CaO。 (4)中二者均不溶于水,可利用炭粉易燃方法,选用d。 (5)中利用二者溶解度随温度变化的差异,采用结晶法分离除杂。 14.(16分)为除去食盐固体中混有的少量CaCl2,得到纯净的食盐晶体,进行下面的实验。 (1)请把实验操作步骤或所需仪器填写在横线上。 (2)简要回答下列问题: Ⅰ.实验步骤②的化学方程式为: CaCl2+Na2CO3===CaCO3↓+2NaCl。 Ⅱ.实验步骤④中滴加某溶液至中性的目的是什么? 除去溶液中的CO。 8 Ⅲ.玻璃棒是一种常用仪器。在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的作用。 溶解时:搅拌,加速溶解; 过滤时:引流,使待滤液体沿玻璃棒流入漏斗,防止外洒; 蒸发时:搅拌,防止因局部过热,液滴或晶体飞溅。 Ⅳ.实验步骤⑤的操作方法是将所得溶液加热蒸发,当剩有少量水时停止加热,同时用玻璃棒不断搅拌,这样操作的理由是充分利用余热,防止温度过高使晶体飞溅。 解析:除去食盐固体中的CaCl2应选择Na2CO3溶液(除Ca2+),实验操作中不能使用K2CO3(引入了K+)等。实验操作流程为: 15.(14分)为了将混有K2SO4、MgSO4的KNO3固体提纯,并制得纯净的KNO3溶液,某同学设计如下实验方案: (1)操作①为(加水)溶解。 (2)操作②~④加入的试剂可以为Ba(NO3)2、K2CO3、KOH[或KOH、Ba(NO3)2、K2CO3或Ba(NO3)2、KOH、K2CO3]。 (3)如何判断SO已除尽,简述实验操作:取少许滤液,向其中加入少量Ba(NO3)2溶液,若不变浑浊,表明SO已除尽。 (4)实验过程中产生的多次沉淀不需要(填“需要”或“不需要”)多次过滤,理由是生成的沉淀可一次性过滤,如果分步过滤会使操作复杂化。 (5)该同学设计的实验方案不严密(填“严密”或“不严密”),理由是调节溶液的pH不能用盐酸,应用硝酸,否则会引入Cl-。 解析:(1)实验要在溶液中进行,故首先要将试剂溶解。(2)SO可用Ba2+除去,Mg2+可用OH-除去。为了不引入新杂质,可分别选用Ba(NO3)2、KOH。过量的Ba(NO3)2可用K2CO3除去。Ba(NO3)2必须在加入K2CO3之前加入,而KOH可在加入Ba(NO3)2之前或在加入K2CO3之后或在Ba(NO3)2和K2CO3中间加入。(3)如果SO已除尽,则滤液中不含SO 8 ,向滤液中加入可溶性钡盐,没有白色沉淀生成。(4)生成的沉淀可一次性过滤,如果分步过滤会使操作复杂化。(5)调节溶液的pH不能用盐酸,而应该用硝酸,否则会引入Cl-。 16.(12分)过滤与蒸发是常用的物质分离与提纯的方法,试用你掌握的有关知识完成下列问题: (1)关于过滤操作的说法中,错误的是C。 A.玻璃棒下端要靠在三层滤纸处 B.滤纸边缘低于漏斗边缘,多余部分要剪去,并用水润湿贴紧,不留气泡 C.过滤时将液体沿玻璃棒注入漏斗,并使液面高于滤纸边缘 D.漏斗下端紧靠烧杯内壁 (2)实验室进行NaCl溶液蒸发时,一般有以下操作过程,其正确的操作顺序为B。 ①放置酒精灯 ②固定铁圈位置 ③放上蒸发皿 ④加热搅拌 ⑤停止加热,用余热蒸干 A.②③④⑤① B.①②③④⑤ C.②③①④⑤ D.②①③④⑤ 熄灭酒精灯停止加热的根据是C。 A.蒸发皿中恰好无水 B.蒸发皿中刚刚产生白色固体 C.蒸发皿中产生了较多的固体 (3)对黄海海水每次取20 g,严格按照过滤、蒸发、冷却、称量、计算的实验步骤规范操作,连续实验三次,算得平均值得固态盐a g。该海水中含氯化钠的质量分数为<(填“>”“<”或“=”)5a%。 解析:(1)玻璃棒下端要靠在三层滤纸处,目的是防止玻璃棒捅破滤纸,故A项正确;滤纸边缘低于漏斗边缘,并用水湿润,且不留气泡的原因是保证液体不从漏斗与滤纸之间流下,故B项正确,C项错误;漏斗下端紧靠烧杯内壁,其目的是防止液体溅出,故D项正确。 (2)在进行NaCl溶液蒸发时,根据题意应先放置酒精灯,然后根据酒精灯的高度来调整铁圈的位置,接下来放上蒸发皿,加入NaCl溶液进行加热,不断搅拌,当剩余少量液体时,停止加热,用余热蒸干。 因氯化钠的溶解度受温度影响不大,通过蒸发使氯化钠从溶液中析出,要待出现较多固体(实际上是大部分的水已蒸发)时停止加热,利用蒸发皿的余热使溶液蒸干。 (3)海水中还含有少量的CaCl2、MgCl2等易溶性的物质,在蒸发时,它们也与NaCl一同结晶析出,成为NaCl中的杂质。 8查看更多