- 2021-07-02 发布 |
- 37.5 KB |
- 5页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020高考化学二轮复习选择题标准练13含解析
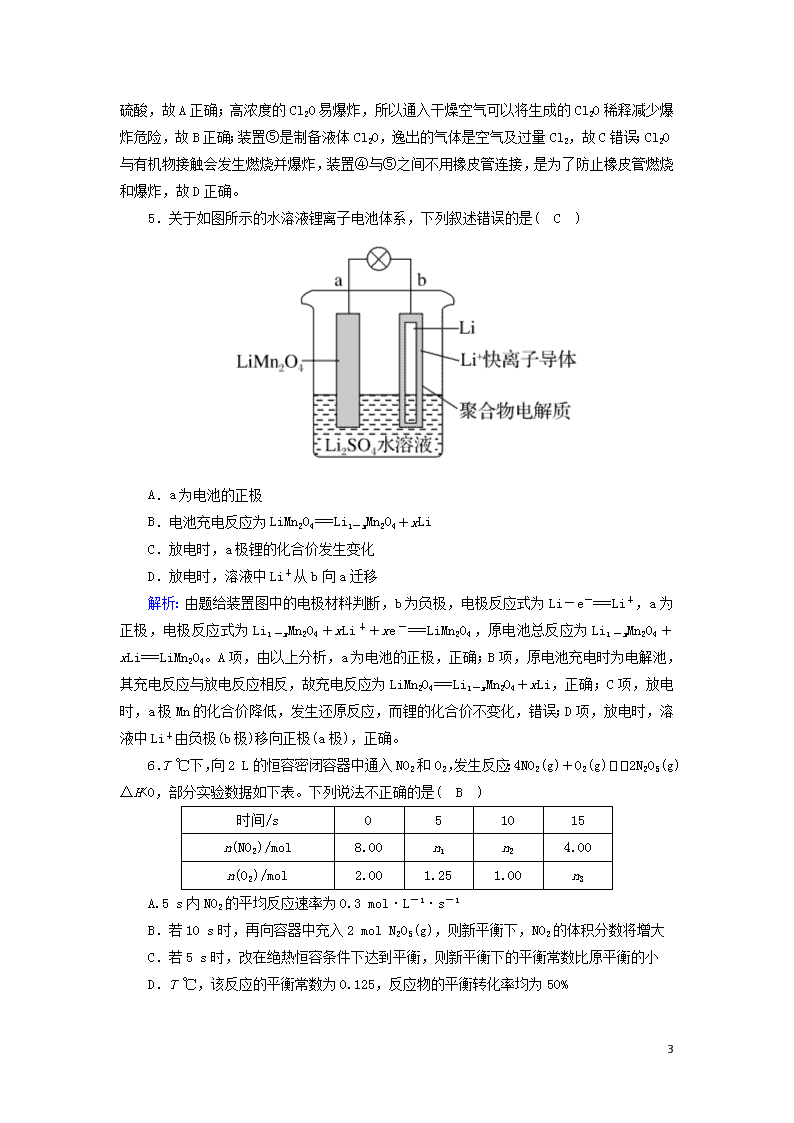
选择题标准练(十三) 满分:42分 每小题6分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。 1.(2018·山东滨州高三期末)化学与技术、生活密切相关。下列说法正确的是( A ) A.氯气与烧碱溶液或石灰乳反应,都能得到含氯消毒剂 B.煤粉碎后更易燃烧,是因为粉碎增强了煤的还原性 C.鸡蛋煮熟后,蛋白质水解成了氨基酸 D.双氧水具有强氧化性,可用于蔗糖脱色 解析:氯气与烧碱溶液或石灰乳反应,都能得到含氯消毒剂,分别是次氯酸钠和次氯酸钙,A正确;B.煤粉碎后更易燃烧,是因为粉碎增大了反应物的接触面积,还原性不变,B错误;C.鸡蛋煮熟后,蛋白质发生了变性,C错误;D.双氧水具有强氧化性,不能用于蔗糖脱色,D错误。 2.下列物质在给定条件下的同分异构体数目正确的是( D ) A.C4H10属于烷烃的同分异构体有3种 B.分子组成是C5H10O2属于羧酸的同分异构体有5种 C.分子组成是C4H8O属于醛的同分异构体有3种 D.结构简式为的一溴代物有5种 解析:C4H10属于烷烃的同分异构体有2种:正丁烷和异丁烷,A项错误;分子组成为C5H10O2属于羧酸的同分异构体可写成C4H9—COOH,丁基有4种,故属于羧酸的同分异构体有4种,B项错误;分子组成为C4H8O属于醛的有机物可写成C3H7—CHO,丙基有2种,故属于醛的同分异构体有2种,C项错误;甲基环己烷的一溴代物有5种,其取代位置如图。 3.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中A、B同主族,B、C、D、E同周期,B的核外电子总数为C的,D的最外层电子数为C、E之和的一半。下列说法正确的是( B ) 5 A.A、B能形成离子化合物,且A离子半径小于B离子半径 B.A、D能形成离子化合物DA5,与水反应可产生两种气体 C.C、D的简单氢化物中只有D溶于水,其水溶液呈酸性 D.E形成的两种氢化物中所有化学键种类完全相同 解析:A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中A、B同主族,B、C、D、E同周期,B的核外电子数为C的,C的原子序数一定为偶数,可知B为第二周期元素,B为Li时,A为H,C为C,D的最外层电子数为C、E之和的一半,即5=(4+6)×,则D为N元素,E为O元素。由上述分析可知,A为H,B为Li,C为C,D为N,E为O。A与B形成的离子化合物为LiH,具有相同电子层结构的离子中,原子序数大的离子半径小,则A离子半径大于B离子半径,故A错误;A、D能形成离子化合物DA5,为NH4H,与水反应可产生两种气体为氨气与氢气,故B正确;C、D的简单氢化物中只有D溶于水,D的氢化物为氨气,其水溶液呈碱性,故C错误;E形成的两种氢化物分别为水、过氧化氢,水中只含极性键,过氧化氢含非极性键和极性键,故D错误。 4.(2019·山东济宁高三期末)Cl2O是黄棕色具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与有机物、还原剂接触或加热时会发生燃烧并爆炸。制取Cl2O的装置如图所示。 已知:Cl2O的熔点为-116 ℃,沸点为3.8 ℃,Cl2的沸点为-34.6 ℃;HgO+2Cl2===HgCl2+Cl2O 下列说法不正确的是( C ) A.装置②、③中盛装的试剂依次是饱和食盐水和浓硫酸 B.通入干燥空气的目的是将生成的Cl2O稀释减少爆炸危险 C.从装置⑤中逸出气体的主要成分是Cl2O D.装置④与⑤之间不用橡皮管连接,是为了防止橡皮管燃烧和爆炸 解析:制取Cl2 5 O需要干燥纯净的氯气,所以②③中盛装的试剂依次是饱和食盐水和浓硫酸,故A正确;高浓度的Cl2O易爆炸,所以通入干燥空气可以将生成的Cl2O稀释减少爆炸危险,故B正确;装置⑤是制备液体Cl2O,逸出的气体是空气及过量Cl2,故C错误;Cl2O与有机物接触会发生燃烧并爆炸,装置④与⑤之间不用橡皮管连接,是为了防止橡皮管燃烧和爆炸,故D正确。 5.关于如图所示的水溶液锂离子电池体系,下列叙述错误的是( C ) A.a为电池的正极 B.电池充电反应为LiMn2O4===Li1-xMn2O4+xLi C.放电时,a极锂的化合价发生变化 D.放电时,溶液中Li+从b向a迁移 解析:由题给装置图中的电极材料判断,b为负极,电极反应式为Li-e-===Li+,a为正极,电极反应式为Li1-xMn2O4+xLi++xe-===LiMn2O4,原电池总反应为Li1-xMn2O4+xLi===LiMn2O4。A项,由以上分析,a为电池的正极,正确;B项,原电池充电时为电解池,其充电反应与放电反应相反,故充电反应为LiMn2O4===Li1-xMn2O4+xLi,正确;C项,放电时,a极Mn的化合价降低,发生还原反应,而锂的化合价不变化,错误;D项,放电时,溶液中Li+由负极(b极)移向正极(a极),正确。 6.T ℃下,向2 L的恒容密闭容器中通入NO2和O2,发生反应:4NO2(g)+O2(g)2N2O5(g) ΔH<0,部分实验数据如下表。下列说法不正确的是( B ) 时间/s 0 5 10 15 n(NO2)/mol 8.00 n1 n2 4.00 n(O2)/mol 2.00 1.25 1.00 n3 A.5 s内NO2的平均反应速率为0.3 mol·L-1·s-1 B.若10 s时,再向容器中充入2 mol N2O5(g),则新平衡下,NO2的体积分数将增大 C.若5 s时,改在绝热恒容条件下达到平衡,则新平衡下的平衡常数比原平衡的小 D.T ℃,该反应的平衡常数为0.125,反应物的平衡转化率均为50% 5 解析:5 s内v(O2)==0.075 mol·L-1·s-1,v(NO2)=4v(O2)=0.075 mol·L-1·s-1×4=0.3 mol·L-1·s-1,A项正确;根据表中提供数据,可以计算出n2=4.00,n3=1.00,显然10 s时反应处于平衡状态,若10 s时,再向容器中充入2 mol N2O5(g),等效于将容器体积压缩为原来的一半,体系压强增大,平衡正向移动,故新平衡下,NO2的体积分数减小,B项错误;若5 s时,改在绝热恒容条件下达到平衡,由于反应正向进行放热,反应体系温度升高,而升温时平衡向逆反应方向移动,故新平衡下平衡常数比原平衡的小,C项正确;NO2、O2的起始浓度之比等于化学计量数之比,故二者的平衡转化率相等,由题表知,反应达到平衡时,反应物的平衡转化率均为50%,此时c(NO2)=2 mol·L-1,c(O2)=0.5 mol·L-1,c(N2O5)=1 mol·L-1,平衡常数K==0.125,D项正确。 7.常温下,将0.1 mol·L-1的NaOH溶液逐滴滴入20 mL 0.1 mol·L-1的CH3COOH溶液中,所得溶液pH变化如图所示,下列有关说法正确的是( C ) A.a点:c(CH3COOH)>c(CH3COO-) B.b点为滴定终点 C.若V1=20,则c点处水的电离程度最大 D.d点:c(CH3COO-)+2c(CH3COOH)=2c(OH-)-2c(H+) 解析:a点为等物质的量浓度的CH3COOH和CH3COONa的混合溶液,CH3COOH的电离大于CH3COO-的水解,所以c(CH3COOH)查看更多
相关文章
- 当前文档收益归属上传用户