【化学】贵州省毕节市梁才学校2020届高三上学期一诊模拟理综(解析版)
贵州省毕节市梁才学校2020届高三上学期一诊模拟理综
相对原子质量:H-1、O-16、C- 12、S-32 、Mg-24、Fe-56、Cl-35.5、Sn-119、Ba-137
第Ⅰ卷
一、选择题:在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学与人类生产、生活密切相关,下列叙述中正确的是( )
A. 泰国银饰和土耳其彩瓷是“一带一路”沿线国家的特色产品,其主要成分均为金属材料
B. 从石墨中剥离出的石墨烯薄片能导电,因此是电解质
C. 中国天眼FAST用到的碳化硅是一种新型的无机非金属材料
D. 食品工业以植物油和氢气为原料生产氢化植物油,利用了植物油的取代反应
【答案】C
【详解】A. 泰国银饰属于金属材料,土耳其彩瓷主要成分是硅酸盐,故A错误;B. 从石墨中剥离出石墨烯薄片能导电,石墨烯是单质不属于电解质,故B错误;C. 中国天眼FAST用到的碳化硅是一种新型的无机非金属材料,故C正确;D. 食品工业以植物油和氢气为原料生产氢化植物油,利用了植物油的加成反应,故D错误;答案:C。
2.通常检测 SO2 含量是否达到排放标准的反应原理是 SO2 +H2O2 + BaCl2 =BaSO4↓+ 2HCl,NA 表示阿伏伽德罗常数,下列说法正确的是( )
A. 上述反应生成 2.33 g BaSO4 沉淀时,转移电子数目为 0.01NA
B. 17 g H2O2 中含有非极性键数目为 0.5NA
C. 0.1 mol BaCl2 晶体中所含微粒总数为 0.3NA
D. 25 ℃时,pH =1 的 HCl 溶液中含有 H+的数目为0.1 NA
【答案】BC
【详解】A. 2.33 g BaSO4沉淀的物质的量为0.01mol,而此反应转移2mol电子,生成1mol硫酸钡沉淀;故当生成0.01mol硫酸钡沉淀时,反应转移0.02mol电子即0.02NA,故A错误;
B. 17 g H2O2中,n===0.5mol,而双氧水中含1条非极性键,故0.5mol双氧水中含非极性键数目为0.5NA,故B正确;
C. 1 mol BaCl2中所含离子总数约为3mol,所以0.1 mol BaCl2中所含离子总数约为0.3 NA,故C正确;
D. 溶液的体积不知,所以无法求物质的量,故D错误;
故选:BC。
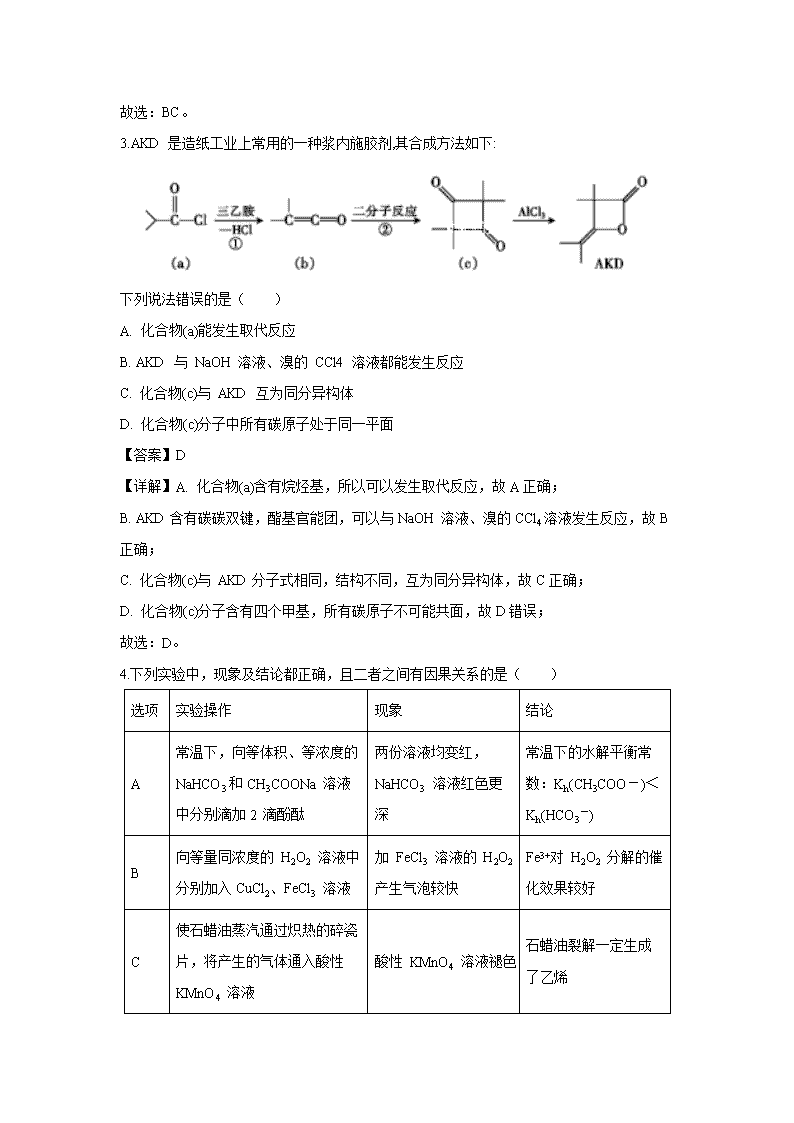
3.AKD 是造纸工业上常用的一种浆内施胶剂,其合成方法如下:
下列说法错误的是( )
A. 化合物(a)能发生取代反应
B. AKD 与 NaOH 溶液、溴的 CCl4 溶液都能发生反应
C. 化合物(c)与 AKD 互为同分异构体
D. 化合物(c)分子中所有碳原子处于同一平面
【答案】D
【详解】A. 化合物(a)含有烷烃基,所以可以发生取代反应,故A正确;
B. AKD含有碳碳双键,酯基官能团,可以与NaOH 溶液、溴的CCl4溶液发生反应,故B正确;
C. 化合物(c)与 AKD分子式相同,结构不同,互为同分异构体,故C正确;
D. 化合物(c)分子含有四个甲基,所有碳原子不可能共面,故D错误;
故选:D。
4.下列实验中,现象及结论都正确,且二者之间有因果关系的是( )
选项
实验操作
现象
结论
A
常温下,向等体积、等浓度的 NaHCO3和CH3COONa 溶液中分别滴加2 滴酚酞
两份溶液均变红,NaHCO3 溶液红色更深
常温下的水解平衡常数:Kh(CH3COO-)<Kh(HCO3-)
B
向等量同浓度的 H2O2 溶液中分别加入CuCl2、FeCl3 溶液
加 FeCl3 溶液的 H2O2 产生气泡较快
Fe3+对 H2O2 分解的催化效果较好
C
使石蜡油蒸汽通过炽热的碎瓷片,将产生的气体通入酸性 KMnO4 溶液
酸性 KMnO4 溶液褪色
石蜡油裂解一定生成了乙烯
D
用两支试管各取 5 mL 0.1 mol/L 酸性KMnO4 溶液,分别加入 2 mL 0.1 mol/L和 0.2 mol/L H2C2O4 溶液
两试管溶液均褪色,且加 0.2 mol/L H2C2O4 试管中褪色更快
其它条件不变,H2C2O4 浓度越大,化学反应速率越大
【答案】A
【详解】A. 常温下,向等体积、等浓度的NaHCO3和CH3COONa溶液中分别滴加2滴酚酞,两份溶液均变红,NaHCO3溶液红色更深,说明HCO3−水解程度大,所以常温下的水解平衡常数:Kh(CH3COO−)
X2W
B. 离子半径由大到小的顺序为Y2-< Z2+ < N-< W2-
C. ZX2和NY2中化学键一致,且微粒个数之比均为1∶2
D. 盐酸加入硫化钠中生成有臭鸡蛋气味的气体,可证明非金属性:N > W
【答案】A
【解析】短周期主族元素X、Y、Z、W、N的原子序数依次增大,X的原子在元素周期表中原子半径最小则为氢元素,Y的次外层电子数是其电子总数的1/4,则为氧元素,离子化合物ZX2是一种储氢材料,根据化合价可知Z为镁,W与Y属于同一主族则W为硫元素,NY2是医学上常用的水消毒剂、漂白剂则为ClO2,N为氯元素。A.
Y和W与X形成的简单化合物H2O、H2S的热稳定性:X2Y>X2W,选项A正确;B. 具有相同电子层结构的离子核电荷数越大半径越小,故离子半径由大到小的顺序为Z2+ < Y2-7,则c(OH−)>c(H+),醋酸根离子的水解程度较小,则c(CH3COO−)>c(Na+),铵根离子部分水解,则c(Na+)>c(NH4+),溶液中离子浓度的大小关系为:c(CH3COO-)>c(Na+)> c(NH4+)> c(OH-)> c(H+),故C正确;
D.C点通入0.1molHCl,与0.1mol醋酸钠反应得到0.1molCH3COOH与0.1molNaCl,c(Cl−)=c(Na+)=0.1mol/L,则c(CH3COO−)+c(Cl−)+c(OH−)>0.1mol/L,故D正确;
故选:B。
【点睛】本题考查图象分析、溶液中离子浓度关系,题目难度中等,明确图象曲线变化的意义为解答关键,转移掌握电荷守恒及盐的水解原理,试题培养了学生的综合应用能力。
三、非选择题:
8..Ba(NO3)2可用于生产烟花。某主要生产 BaCl2、BaCO3、BaSO4 的化工厂利用某种钡泥[主要含有 BaCO3、Ba(FeO2)2、极少量 CuCO3 等]制取 Ba(NO3)2 晶体,其部分工艺流程如下:
已知:Fe3+和Fe2+以氢氧化物形式沉淀完全时,溶液的 pH 分别为 3.2 和 9.7。
(1)酸溶时通常不使用浓硝酸的原因是______________________________。
(2)酸溶后溶液中pH=1,Ba(FeO2)2 与HNO3 的反应化学方程式为____________________________________________________。
(3)该厂结合本厂实际,中和选用的 X 为__________(填化学式);中和使溶液中______________(填离子符号)的浓度减少(中和引起的溶液体积变化可忽略)。
(4)滤液得到 Ba(NO3)2 晶体的操作依次为_________、过滤。
(5)该厂生产的 Ba(NO3)2 晶体含有少量 Cu2+ ,可通过洗涤的方法除去。证明晶体已经洗涤干净的操作方法是__________________________________________________________。
(6)Ba2+致死量为355mg/kg。误食Ba2+可以服用MgSO4 溶液解毒,涉及到的离子反应方程式为___________________________________; 为了减少环境污染,请对上述流程中不合理的设计进行改进,改进措施是_______________________________________。
【答案】(1). 浓HNO3易挥发、分解 (2). Ba(FeO2)2+8HNO3=Ba(NO3)2+2Fe(NO3)3+4H2O (3). BaCO3 (4). Fe3+、H+ (5). 蒸发浓缩、冷却结晶 (6). 取最后一次洗涤液 少许于试管中,滴加NaOH溶液无蓝色沉淀产出 (7). Ba2+ + SO42-=BaSO4 ↓ (8). 洗涤废渣并回收洗涤液
【分析】BaCO3含少量CuCO3 ,Ba(FeO2)2、Ba(NO3)2等杂质,其中Ba(FeO2)2
中钡元素为+2价,铁元素为+3价,加入硝酸,在容器中充分溶解得到溶液,此溶液中含有钡离子,铜离子,三价铁离子,可加入X是碳酸钡,调节溶液pH=4-5,使铁离子,铜离子水解生成氢氧化铁沉淀,氢氧化铜沉淀,过滤后废渣是氢氧化铁,氢氧化铜,滤液中主要含有硝酸,硝酸钡,经蒸发浓缩,冷却结晶,过滤可得硝酸钡晶体。
【详解】(1)酸溶时不使用的原因是浓硝酸易挥发,分解;
(2)酸溶后溶液中中pH=1,Ba(FeO2)2 与HNO3 的反应生成硝酸钡,硝酸铁和水,反应的化学方程式为Ba(FeO2)2+8HNO3=Ba(NO3)2+2Fe(NO3)3+4H2O;
(3)该厂结合本厂实际,中和选用的 X必须能消耗过量硝酸并使铁离子沉淀而除去,且不引人新的杂质,可为BaCO3;中和使溶液中Fe3+、H+浓度减少;
(4)滤液得到硝酸钡晶体的操作依次为蒸发浓缩、冷却结晶;
(5)晶体表面可能有Cu2+ ,如果洗涤干净,说明没有Cu2+ ,所以操作是取最后一次洗涤液 少许于试管中,滴加NaOH溶液无蓝色沉淀产出;
(6)误食Ba2+可以服用MgSO4 溶液解毒,涉及到的离子反应方程式为Ba2+ + SO42-=BaSO4 ↓;避免引起污染,改进措施是洗涤废渣并回收洗涤液;
9.草酸亚铁晶体(FeC2O4•2H2O,M=180g/mol)呈淡黄色,可用作晒制蓝图。某实验小组对其进行了一系列探究。
I.纯净草酸亚铁晶体热分解产物的探究
(1)气体产物成分的探究。小组成员采用如下装置(可重复选用)进行实验:
①按照气流从左到右的方向,上述装置的接口顺序为 a→g→f→_______________→尾气处理装置(仪器可重复使用)。
②实验前先通入一段时间 N2,其目的为__________________________________________。
③实验证明了气体产物中含有 CO,依据的实验现象为______________________________。
(2)小组成员设计实验证明了 A 中分解后的固体成分为 FeO,则草酸亚铁晶体分解的化学方程式为______________________________________。
(3)晒制蓝图时,以 K3[Fe(CN)6]溶液为显色剂,该反应的化学方程式为__________________________________________________。
Ⅱ.草酸亚铁晶体样品纯度的测定:工业制得的草酸亚铁晶体中常含有 FeSO4 杂质,测定其纯度的步骤如下:
步骤 1:称取 mg 草酸亚铁晶体样品并溶于稀 HSO4 中,配成 250mL 溶液;
步骤 2:取上述溶液 25.00mL,用 cmol/L KMnO4 标准液滴定至终点,消耗标准液 V1mL;
步骤 3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀 H2SO4,再用 cmol/L KMnO4 标准溶液滴定至终点,消耗标准液 V2mL。
(4)步骤 2 中滴定终点的现象为________________________________________________;步骤 3 中加入锌粉的目的为__________________________________________________。
(5)草酸亚铁晶体样品的纯度为______________________;若步骤 1配制溶液时部分Fe2+被氧化变质,则测定结果将__________(填“偏高”、“偏低”或“不变”)。
【答案】(1). b→c→h→i(或i→h)→d→e→b→c (2). 排尽装置中的空气,防上加热时发生爆炸 (3). C中固体由黑色变为红色,后B装置中出现浑浊 (4). FeC2O4·2H2O FeO+CO↑+CO2↑+2H2O (5). 3FeC2O4+2K3[FeCN)6]=Fe3[Fe(CN)6]2+3K2C2O4 (6). 锥形瓶中溶液颜色变为浅紫色,且30s内不褪色 (7). 将Fe3+还原为Fe2+ (8). ×100% (9). 偏低
【分析】Ⅰ.(1)①气体产物成分的探究,草酸亚铁晶体在装置A中加热分解,生成的气体通过装置D中硫酸铜检验水蒸气的存在,通过装置B中澄清石灰水检验二氧化碳的生成,通过装置E中碱石灰干燥气体后,通入装置C中玻璃管中和氧化铜反应生成铜和二氧化碳,再通过B装置检验生成的二氧化碳气体,最后尾气处理;
②验前先通入一段时间N2,把装置内空气赶净,防止加热爆炸;
③实验证明了气体产物中含有CO,是利用一氧化碳的还原性还原氧化铜生成红色铜和二氧化碳设计实验验证;
(2)依据结论,可知A处反应管中发生反应是草酸亚铁晶体分解生成氧化亚铁、一氧化碳、二氧化碳和水;
(3)FeC2O4与反应K3[Fe(CN)6]生成蓝色的Fe3[Fe(CN)6]2沉淀,同时生成K2C2O4;
Ⅱ.(4)用 cmol•L-1 KMnO4标准液滴定至终点,滴入最后一滴溶液无色变化为紫红色且半分钟不变,说明反应进行到终点,向反应后溶液中加入适量锌粉是将Fe3+还原为Fe2+;
(5)草酸亚铁溶液中滴入高锰酸钾溶液,发生氧化还原反应,亚铁离子和草酸根离子都被氧化,向反应后溶液中加入适量锌粉,充分反应后,加入适量稀H2SO4,再用cmol•L-1KMnO4标准溶液滴定至终点,消耗标准液V2mL,此时滴定的是亚铁离子,第一次消耗高锰酸钾减去第二次高锰酸钾为滴定亚铁离子的量,利用化学反应定量关系计算,若步骤1配制溶液时部分Fe2+被氧化,消耗高锰酸钾减少,计算得到亚铁离子物质的量减小。
【详解】Ⅰ.(1)①草酸亚铁晶体在装置A中加热分解,生成的气体通过装置D中硫酸铜检验水蒸气的存在,通过装置B中澄清石灰水检验二氧化碳的生成,通过装置E中碱石灰干燥气体后通入装置C中玻璃管中,和氧化铜反应生成铜和二氧化碳,再通过B装置检验生成的二氧化碳气体,按照气流从左到右的方向,上述装置的连接顺序为:agfbchi(或ih)de(或ed)bc,最后连接尾气处理装置,正确的顺序为:agfbchi(或ih)de(或ed)bc;
故答案为:bchi(或ih)de(或ed)bc;
②实验前先通入一段时间N2,其目的为:排尽装置中的空气,防止加热时发生爆炸;
故答案为:排尽装置中的空气,防止加热时发生爆炸;
③实验证明了气体产物中含有CO,依据的实验现象为:C处反应管中固体由黑变红,其后的B装置中澄清石灰水变浑浊;
故答案为:C处反应管中固体由黑变红,其后的B装置中澄清石灰水变浑浊;
(2)A处反应管中发生反应是草酸亚铁晶体分解生成氧化亚铁、一氧化碳、二氧化碳和水,反应的化学方程式为:FeC2O4·2H2O FeO+CO↑+CO2↑+2H2O,
故答案为:FeC2O4·2H2O FeO+CO↑+CO2↑+2H2O;
(3)FeC2O4与反应K3[Fe(CN)6]生成蓝色的Fe3[Fe(CN)6]2沉淀,同时生成K2 C2O4,该反应的化学方程式为:3FeC2O4+2K3[FeCN)6]=Fe3[Fe(CN)6]2+3K2C2O4;
故答案为:3FeC2O4+2K3[FeCN)6]=Fe3[Fe(CN)6]2+3K2C2O4 ;
Ⅱ.(4)用 cmol⋅L−1 KMnO4标准液滴定至终点,滴入最后一滴溶液,无色变化为紫红色且半分钟不变,说明反应进行到终点,步骤3中加入锌粉的目的为:将Fe3+还原为Fe2+;
故答案为:滴入最后一滴溶液无色变化为紫红色且半分钟不变,说明反应进行到终点;将Fe3+还原为Fe2+;
(5)取上述溶液25.00mL,用cmol∙L −1KMnO4标准液滴定至终点,消耗标准液V1mL,向反应后溶液中加入适量锌粉,充分反应后,加入适量稀H2SO4,再用cmol⋅L−1KMnO4标准溶液滴定至终点,消耗标准液V2
mL,第一次消耗高锰酸钾减去第二次高锰酸钾为滴定亚铁离子的量,为亚铁离子消耗高锰酸钾物质的量,反应的离子方程式:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;草酸亚铁晶体样品的纯度= ×100% ;若步骤1配制溶液时部分Fe2+被氧化,消耗高锰酸钾减少,计算得到亚铁离子物质的量减小,测定结果偏低;
故答案为: ×100% ; 偏低。
10.研究 CO2的利用对促进低碳社会的构建具有重要意义。
(1)一定条件下,在 CO2 与足量碳反应所得平衡体系中加入 H2 和适当催化剂,有下列反应发生:CO(g)+3H2(g) CH4(g)+H2O(g) ∆H1=-206.2kJ/mol ;CO(g)+H2O(g) CO2(g)+H2(g)∆H2若 CO2 和 H2 反应生成 0.1mol CH4(g)和一定量的 H2O(g), 整个过程中放出的热量为 16.5kJ, 则△H2=__________。
(2)为研究 CO2 与 CO 之间的转化。让一定量的 CO2 与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)2CO(g) ∆H。 测得压强、温度对 CO 的体积分数(φ(CO)%)的影响如图所示:
回答下列问题:
①p1、p2、p3 的大小关系是______________,图中 a、b、c 三点对应的平衡常数大小关系是______________(用 Ka、Kb、Kc 表示)。
② 900 ℃、1.013 MPa 时,1 mol CO2 与足量碳反应达平衡后容器的体积为VL,CO2 的转化率为__________,(保留一位小数)该反应的平衡常数 K=__________。
③将②中平衡体系温度降至 640 ℃,压强降至 0.1013 MPa,重新达到平衡后 CO2 的体积分数为 50%。条件改变时,正反应和逆反应速率如何变化?__________________________,二者之间有何关系?______________________。
(3)CO2 可用于工业制备草酸锌,其原理如下图所示(电解液不参加反应),Zn 电极是__________极。已知在 Pb 电极区得到 ZnC2O4,则 Pb 电极上的电极反应式为__________。
【答案】 (1). -41.2 kJ/mol (2). p1<p2<p3 (3). Ka=Kb<Kc (4). 66.7% (5). mol/L (6). 正反应和逆反应速率均减小 (7). v(正)<v(逆) (8). 阳 (9). 2CO2+2e-=C2O42-
【分析】(1)一定条件下,在CO2与足量碳反应所得平衡体系中加入H2和适当催化剂,有下列反应发生:① CO(g)+3H2(g)⇌CH4(g)+H2O(g)△H1=-206.2 kJ/mol;②CO(g)+H2O(g)⇌CO2(g)+H2(g)△H2;若H2还原CO2生成0.1molCH4(g)和一定量的H2O(g),整个过程中放出的热量为16.5kJ,则H2还原CO2生成1molCH4(g)和一定量的H2O(g),放出热量为165kJ,该反应的热化学方程式为:③CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H3=-165kJ/mol,根据盖斯定律,①-③可得②,据此计算△H2;
(2)①反应C(s)+CO2(g)⇌2CO(g)是气体分子数增多的反应,随着反应进行,体系压强增大;化学平衡常数只随温度的改变而改变;
②900℃、1.013MPa时,平衡时CO体积分数为80%,计算CO2转化的量,转化率就是转化的量与起始量比值的百分数,将各组分的平衡浓度代入平衡常数表达式计算化学平衡常数;
③根据改变条件前后CO2的体积分数的变化判断,根据反应商判断化学反应的方向;
(3)Zn在阳极上失电子生成锌离子,Pb电极上CO2得电子生成C2O42-。
【详解】(1)一定条件下,在CO2与足量碳反应所得平衡体系中加入H2和适当催化剂,有下列反应发生:①CO(g)+3H2(g)⇌CH4(g)+H2O(g)△H1=-206.2 kJ/mol;②CO(g)+H2O(g)⇌CO2(g)+H2(g)△H2;若H2还原CO2生成0.1molCH4(g)和一定量的H2O(g),整个过程中放出的热量为16.5kJ,则H2还原CO2生成1molCH4(g)和一定量的H2O(g),放出热量为165kJ,该反应的热化学方程式为:③CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H3=-165kJ/mol,根据盖斯定律,①-③可得②:②
CO(g)+H2O(g)⇌CO2(g)+H2(g)△H2=(−206.2 kJ/mol)−(−165kJ/mol)=−41.2kJ/mol;
故答案为:−41.2kJ/mol;
(2)①反应C(s)+CO2(g)⇌2CO(g)是气体分子数增多的反应,随着反应进行,体系压强增大,减小压强有助于化学平衡正向移动,表明低压强对应着高的CO体积分数,则p1、p2、p3的大小关系是:p1v(正);
故答案为:正逆反应速率均减小;>;
(3)利用电化学还原CO2制取ZnC2O4,则Zn失电子,所以Zn在阳极上失电子生成锌离子,即锌与正极相连为阳极;Pb电极上CO2得电子生成C2O42−,则其电极反应为:2CO2+2e−=C2O42-;
故答案为:阳;;2CO2+2e-=C2O42-。
(二)选考题:
11.翡翠是玉石中的一种,其主要成分为硅酸铝钠-NaAl(Si2O6),常含微量 Cr、Ni、Mn、Mg、Fe 等元素。回答下列问题:
(1)基态 Cr 原子的电子排布式为__________,Fe 位于元素周期表的__________区。
(2)NaAl(Si2O6)中四种元素的第一电离能由小到大的顺序是__________________。
(3)钙和铁都是第四周期元素,且原子的最外层电子数相同,但为什么铁的熔沸点远高于钙?说明理由__________________________________________________________________。
(4)已知:3K4Fe(CN)6 12KCN+Fe3C+3C+(CN)2↑+2N2↑,(CN)2 分子中σ键与π键的数目比n(σ)∶n(π)=___________。
(5)在硅酸盐中存在 SiO44-结构单元,其中 Si 原子的杂化轨道类型为__________。
(6)铁触媒是合成氨反应的催化剂,其表面存在氮原子。氮原子在铁表面上的单层附着的局部示意图如图 1 所示,则铁表面上氮原子与铁原子的数目比为__________。
(7)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图 2 所示。若该晶体储氢时,H2 分子在晶胞的体心和棱的中心位置,距离最近的两个H2 分子之间距离为 anm,则铁镁合金的密度为__________(列出计算表达式,NA 为阿伏加德罗常数的数值)g·cm-3。
【答案】(1). [Ar]3d54s1 (2). d (3). Na
查看更多