2020届高考化学一轮复习元素周期表 元素周期律学案
第15讲 元素周期表 元素周期律
考纲要求
名师点拨
1.掌握元素周期律的实质。了解元素周期表(长式)的结构(周期、族)及其应用。
2.以第3周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系。
3.以ⅠA和ⅦA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。
4.了解金属、非金属元素在周期表中的位置及其性质递变规律。
元素周期表与元素周期律是高考的必考内容之一。这一部分需要记忆的东西很多,提供以下几点经验供参考:(1)不要专注于记住递变规律本身,应努力记住规律产生的原因(如随着核电荷数的增加,原子核对核外电子吸引力增强导致原子半径减小)和构成酸碱性、稳定性、金属性等性质递变的结构性因素,做到这一点可以很好地降低记忆量并能加深印象,有利于知识系统的巩固和分析问题能力的提升。(2)高考中考查的多是有关元素周期表的推断,因此要对元素周期表的前四个周期非常熟悉。(3)元素周期表的考查中多伴有对于元素及其化合物性质的考查,要善于根据元素及其化合物的性质去理解元素周期律,利用元素周期律去记忆、巩固元素及其化合物的性质,如果能够深刻理解二者之间的关系,将对相应知识的巩固产生较大的帮助。该部分知识内容丰富、规律性强,因此命题的空间极为广阔。预计今后的题型会稳中有变,仍以元素及其化合物知识为载体,用物质结构理论,将解释现象、定性推断、归纳总结、定量计算相结合,向多方位、多角度、多层次方向发展。
考点一 元素周期表及其应用
1.原子序数
按照元素在周期表中的顺序给元素所编的序号,称为原子序数。
原子序数=__质子数__=__核电荷数__=__核外电子数__=质量数-中子数。
2.元素周期表的编排原则
同一周期元素
同一主族元素
3.元素周期表的结构
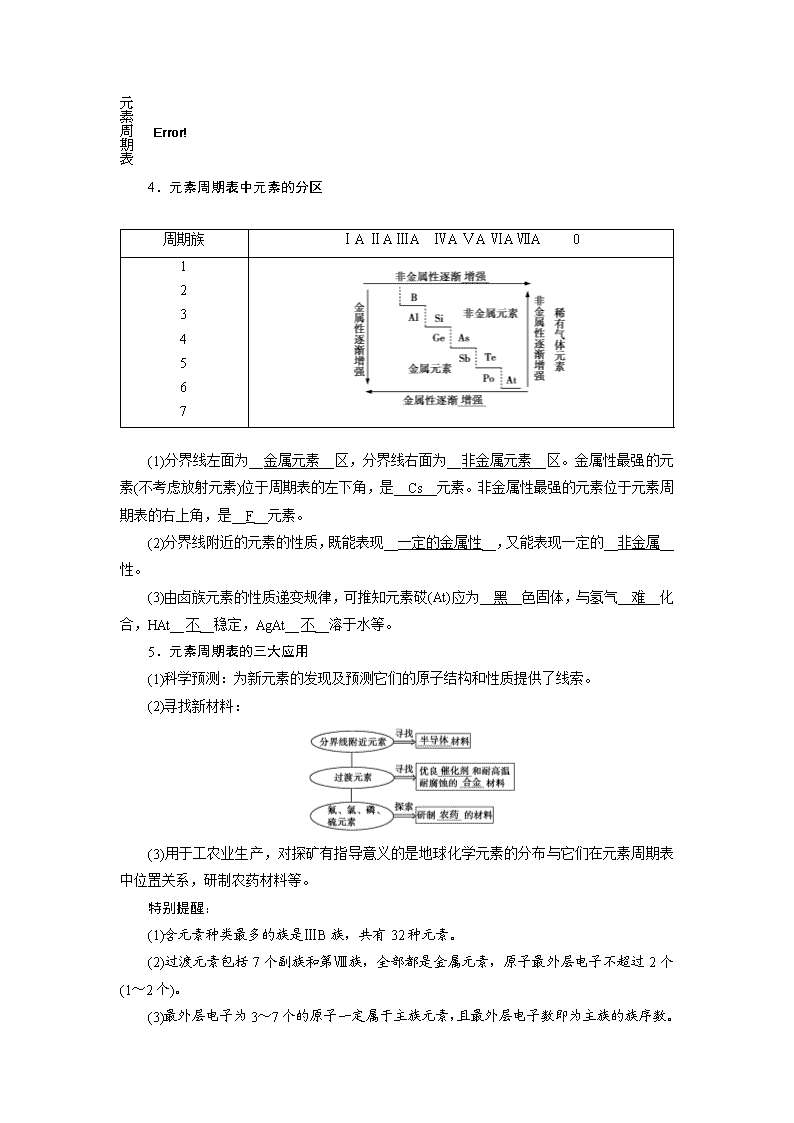
4.元素周期表中元素的分区
周期族
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
1
2
3
4
5
6
7
(1)分界线左面为__金属元素__区,分界线右面为__非金属元素__区。金属性最强的元素(不考虑放射元素)位于周期表的左下角,是__Cs__元素。非金属性最强的元素位于元素周期表的右上角,是__F__元素。
(2)分界线附近的元素的性质,既能表现__一定的金属性__,又能表现一定的__非金属__性。
(3)由卤族元素的性质递变规律,可推知元素砹(At)应为__黑__色固体,与氢气__难__化合,HAt__不__稳定,AgAt__不__溶于水等。
5.元素周期表的三大应用
(1)科学预测:为新元素的发现及预测它们的原子结构和性质提供了线索。
(2)寻找新材料:
(3)用于工农业生产,对探矿有指导意义的是地球化学元素的分布与它们在元素周期表中位置关系,研制农药材料等。
特别提醒:
(1)含元素种类最多的族是ⅢB族,共有32种元素。
(2)过渡元素包括7个副族和第Ⅷ族,全部都是金属元素,原子最外层电子不超过2个(1~2个)。
(3)最外层电子为3~7个的原子一定属于主族元素,且最外层电子数即为主族的族序数。
(4)同一周期ⅡA族与ⅢA族元素的原子序数可能相差1(2、3周期)或11(4、5周期)或25(6、7周期)。
(5)过渡元素:元素周期表中部从ⅢB族到ⅡB族10列共六十多种元素,这些元素都是金属元素。
(6)镧系:元素周期表第六周期中,57号元素镧到71号元素镥,共15种元素。
(7)锕系:元素周期表第七周期中,89号元素锕到103号元素铹,共15种元素。
(8)元素周期表结构巧记口诀
横行叫周期,现有一至七,四长三个短,第七已排满。
纵列称为族,共有十六族,一八依次现,一零再一遍。
一纵一个族,Ⅷ族搞特殊,三纵算一族,占去8、9、10。
镧系与锕系,蜗居不如意,十五挤着住,都属ⅢB族。
1.判断正误,正确的画“√”,错误的画“×”。
(1)原子的最外层电子数是2的元素,一定是ⅡA族元素( × )
提示:不一定。可以是O族元素He和过渡元素等。
(2)根据最高正化合价与族序数的关系可知,氧元素的最高正价为+6价( × )
(3)元素周期表中镧系、锕系都占据同一格,它们都是同位素( × )
(4)除短周期外,其他周期均有18种元素( × )
(5)铁位于元素周期表的第4周期ⅧB族( × )
(6)每个周期都是从碱金属元素开始到稀有气体元素结束( × )
(7)最外层电子数相同的元素不一定在同一主族( √ )
(8)元素所在的主族序数与最外层电子数相等的元素都是金属元素( × )
(9)两短周期元素原子序数相差8,则周期数一定相差1( √ )
(10)原子及离子的核外电子层数等于该元素所在的周期数( × )
(11)元素周期表中位于金属与非金属分界线附近的元素属于过渡元素( × )
(12)同周期的第ⅡA族和第ⅢA族元素的原子序数一定相差1( × )
(13)短周期元素中,若两种元素的原子序数相差8,则它们一定是同主族元素( × )
(14)短周期元素中,若两种元素的原子序数相差2,则它们一定不是同主族元素( × )
(15)位于同一周期的甲、乙两种元素,甲位于ⅠA族,原子序数为x,乙位于ⅢA族,则乙原子序数可能为x+19( × )
2.问题探究。
(1)甲、乙是元素周期表中同一主族相邻周期的两种元素(其中甲在上一周期),若甲的原子序数为x,则乙的原子序数可能是__x+2、x+8、x+18、x+32__。
(2)若甲、乙分别是同一周期的第ⅡA族和第ⅦA族元素,原子序数分别为m和n,则m和n的关系为__n=m+5,n=m+15,n=m+29__。
(3)若A、B是相邻周期同主族元素(A在B的上一周期),A、B所在周期分别为m种和n种元素,A的原子序数为x,B的原子序数为y,则x、y的关系式为__y=x+m或y=x+n__。
1.(2019·河北衡水模拟)根据中学化学教材中所附元素周期表判断,下列叙述不正确的是( C )
①两短周期元素原子序数相差8,则周期数一定相差1
②L层电子数为奇数的所有元素所在族的序数与该元素原子的L层电子数相等
③某元素原子的核电荷数为53,则该元素位于第五周期ⅦA族
④除0族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数
⑤副族元素没有非金属元素
⑥碱金属元素是指第ⅠA族的所有的元素
⑦元素周期表中的各主族元素都含有金属元素和非金属元素
A.①③④ B.④⑤⑦
C.④⑥⑦ D.②④⑦
[解析] ①在短周期里,除第一周期含两种元素外,其余两个周期所含元素都是8种。若两元素原子序数相差8,则不可能在同一周期也不可能相差两个周期,正确;②L层电子数为奇数,则一定是核外最外层电子,其所在族的序数与该元素原子的L层电子数相等,正确;③稀有气体元素Xe是54号元素,故核电荷数为53的元素位于第五周期第ⅦA族,正确;④氧一般不显正价、氟没有正价,错误;⑥第ⅠA族中的氢元素不是碱金属元素,错误;⑦第ⅦA族中没有金属元素,第ⅡA族中没有非金属元素,错误。综上分析,C项符合题意。
2.(2019·新题预选)国际理论与应用化学联合会已正式确定了第114号和第116号元素的名称缩写为Fl、Lv。下列有关这两种元素的说法错误的是( C )
A.两种元素位于同一周期
B.116号元素位于第ⅥA族
C.两种元素都是活泼的非金属元素
D.114号元素的原子半径比116号元素的原子半径大
[解析] 第114号元素和116号元素分别处于第7周期ⅣA族和ⅥA族,均为金属元素,A、B正确、C错误;依据同周期原子半径递变规律判断114号元素的原子半径比116号元素的原子半径大,D正确。
3.(2019·河北衡水月考)如图所示各为元素周期表的一部分,表中数字是原子序数,其中X为35的是( C )
[解析] X的原子序数为35,为Br元素,位于周期表中第四周期第ⅦA族。14号、50号元素分别为Si、Sn,处于第ⅣA族,则X的原子序数不可能为35,不符合;74号、76号元素分别为W、Os,处于第六周期,则X为第五周期的Tc元素,不符合;18号、54号元素分别为Ar、Xe,则X位于周期表中第四周期第ⅦA族,符合;26号、28号元素分别为Fe、Ni,处于四周期,则X在第五周期,不符合。
4.(2019·甘肃天水模拟)如图所示,A、B、C、D、E是元素周期表中的5种主族元素,下列说法不正确的是( A )
A.A、E原子序数之差可能为2
B.D、E原子序数之差可能为18或32
C.B、C原子序数之差一定是2
D.B、D原子序数之差不可能是7
[解析] A不可能处于第一周期,故A、E原子序数之差不可能是2,A项错误;若A处于第二周期,那么E处于第三周期,D处于第四周期,那么E、D原子序数相差18,若E为第五周期,那么E、D原子序数相差32,B项正确;B、C处于同一周期,那么E、D原子序数相差32,B项正确;B、C处于同一周期,那么B、C原子序数之差一定是2,C项正确;由以上分析可知B、D可能相差9,可能相差19或33,故不可能相差7,D项正确。
5.(2019·河北衡水模拟)已知X、Y、Z三种主族元素在元素周期表中的位置如图所示,设X的原子序数为a。则下列说法不正确的是( D )
Y
X
Z
A.Y与Z的原子序数之和可能为2a B.Y的原子序数可能为a-17
C.Z的原子序数可能为a+31 D.X、Y、Z一定为短周期元素
[解析] 由题给信息可知,X、Y、Z只能位于第ⅢA族~第ⅦA族,则:若X为第四周期元素,Y、Z分别为第三、第五周期元素,由X的原子序数为a可知,Y的原子序数为a-18+1=a-17,Z的原子序数为a+18-1=a+17,Y与Z的原子序数之和为2a,A、B
正确;若Z为第六或第七周期元素,因存在镧系和锕系元素,则Z的原子序数可能为a+32-1=a+31,C正确。
萃取精华:
元素周期表结构中隐含的两条规律
(1)同主族、邻周期元素的原子序数差
①元素周期表中左侧元素(ⅠA、ⅡA族)
同主族相邻两元素中,Z(下)=Z(上)+上一周期元素所在周期的元素种类数目。
②元素周期表中右侧元素(ⅢA~ⅦA族)
同主族相邻两元素中,Z(下)=Z(上)+下一周期元素所在周期的元素种类数目。
(2)同周期ⅡA族和ⅢA族元素原子序数差
周期序数
1
2
3
4
5
6
7
原子序数差
无
1
1
11
11
25
25
原因
增加了过渡元素
增加了过渡元素和镧系或锕系元素
6.(2019·四川成都检测)下列说法中正确的是( B )
A.原子序数之差为2的两种元素不可能位于同一主族
B.D-核外有36个电子,则元素D位于第四周期第ⅦA族
C.位于同一主族的甲、乙两种元素,甲的原子序数为x,则乙的原子序数可能为x+4
D.位于同一周期的甲、乙两种元素,甲位于第ⅠA族,原子序数为x,乙位于第ⅢA族,则乙原子序数可能为x+19
[解析] 氢和锂两种元素的原子序数之差为2,位于同一主族,故A错误;D-核外有36个电子,则D原子核外有35个电子,为Br元素,Br位于第四周期第ⅦA族,故B正确;同主族相邻两周期元素原子序数差值可能为2、8、18、32等,所以同一主族的甲、乙两种元素,甲的原子序数为x,则乙的原子序数不可能为x+4,故C错误;第二、三周期,乙的原子序数为x+2,第四、五周期,乙的原子序数为x+12,第六、七周期,乙的原子序数为x+26,故D错误。
7.(2019·试题调研)若甲、乙分别是同一周期的ⅡA族和ⅢA族元素,原子序数分别为m和n,则下列关于m和n的关系不正确的是( B )
A.n=m+1 B.n=m+18
C.n=m+25 D.n=m+11
[解析] 对于第一、二、三周期,同一周期的ⅡA族和ⅢA族元素的原子序数只相差1
,而对于第四、五周期来说,由于存在过渡元素,同一周期的ⅡA族和ⅢA族元素的原子序数则相差11;而对于第六、七周期来说,由于存在镧系和锕系元素,同一周期的ⅡA族和ⅢA族元素的原子序数则相差25。
8.试推算原子序数为6、13、34、53、88、115的元素在周期表中的位置。
原子序数
6
13
34
53
88
115
周期
__二__
__三__
__四__
__五__
__七__
__七__
族
__ⅣA__
__ⅢA__
__ⅥA__
__ⅦA__
__ⅡA__
__ⅤA__
[解析] 6号元素原子核外有2个电子层,最外层电子数为4,位于第二周期第ⅣA族;13号元素原子核外有3个电子层,最外层电子数为3,位于第三周期第ⅢA族;34号元素原子核外有4个电子层,最外层电子数为6,位于第四周期第ⅥA族;53号元素原子比Xe(54号元素)原子少1个电子,共有5个电子层,最外层电子数为7,位于第五周期第ⅦA族;88号元素原子比Rn(86号元素)原子多2个电子,共有7个电子层,最外层电子数为2,位于第七周期第ⅡA族;115号元素比118号元素少3个电子,共有7个电子层,最外层电子数为5,位于第七周期第ⅤA族。
萃取精华:
确定元素在元素周期表中位置的3种方法
(1)核外电子排布法:本方法常用于确定原子序数小于18或已知某微粒核外电子排布的元素。确定步骤:原子序数→原子核外电子排布→“电子层数=周期数”和“最外层电子数=主族序数”。
(2)区间定位法:对于原子序数较大的元素,若用核外电子排布法确定,步骤复杂且易出错,则可采用区间定位法。元素周期表中各族序数的排列顺序从左到右依次为ⅠA、ⅡA、ⅢB、
ⅣB、ⅤB、ⅥB、ⅦB、Ⅷ、ⅠB、ⅡB、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA、0,牢记各周期对应的0族元素的原子序数,可以快速确定周期数。
周期
1
2
3
4
5
6
7
起止元素
原子序数
1~2
3~10
11~18
19~36
37~54
55~86
87~118
(3)相同电子层结构法:主族元素的阳离子与上一周期0族元素原子的电子层结构相同;主族元素的阴离子与同周期0族元素原子的电子层结构相同。
考点二 元素周期律及其应用
1.元素周期律的内容及实质
2.主族元素的周期性变化规律
内容
同周期(从左到右)
同主族(从上到下)
原子结构
电子层数
电子层数__相同__
电子层数逐渐__增多__
最外层
电子数
最外层电子
数逐渐__增多__
最外层电子数__相同__
原子半径
逐渐__减小__
逐渐__增大__
离子半径
阳离子半径逐渐__减小__,阴离子半径逐渐__减小__,r(阴离子)>r(阳离子)
逐渐增大
元素性质
得电子能力
逐渐__增强__
逐渐__减弱__
失电子能力
逐渐__减弱__
逐渐__增强__
金属性
逐渐减弱
逐渐__增强__
非金属性
逐渐__增强__
逐渐__减弱__
离子的氧化性、还原性
阳离子氧化性逐渐增强,阴离子还原性逐渐减弱
阳离子氧化性逐渐减弱,阴离子还原性逐渐增强
主要化合价
最高正价:由+1→+7(O、F除外)
最低负价:主族序数-8
最高正价数=主族序数(O、F除外)
化合物的性质
最高价氧化物对应
水化物的酸碱性
酸性逐渐__增强__
碱性逐渐__减弱__
酸性逐渐减弱
碱性逐渐增强
非金属元素气态氢化物
的形成难易及稳定性
气态氢化物的形成越来越__容易__,其稳定性逐渐__增强__
气态氢化物形成越来越__困难__,其稳定性逐渐__减弱__
气态氢化物的还原性
依次__减弱__
依次__增强__
3.元素周期表和元素周期律应用的重要意义
(1)预测元素的性质:根据原子结构、元素在周期表中的位置预测元素的性质。
(2)比较同主族元素的金属性、非金属性、最高价氧化物对应水化物的酸(或碱)性、气态氢化物的稳定性等。如碱性:Ra(OH)2__>__Ba(OH)2;气态氢化物稳定性:CH4__>__SiH4。
(3)比较同周期元素及其化合物的性质。如酸性:HClO4__>__H2SO4;稳定性:HCl__>__H2S。
(4)推断一些未学过的元素的化合物的某些性质。如根据Ca(OH)2微溶,Mg(OH)2难溶,可以推知Be(OH)2更难溶。
(5)启发人们在一定范围内寻找某些物质。
4.“三看”法快速判断简单粒子半径大小。
一看电子层数:最外层电子数相同时,电子层数越多,半径越大。
二看核电荷数:当电子层结构相同时,核电荷数越大,半径越小。
三看核外电子数:当电子层数和核电荷数均相同时,核外电子数越多,半径越大。
1.判断正误,正确的画“√”,错误的画“×”。
(1)酸性:H2SO3>H2CO3,所以非金属性:S>C( × )
提示:利用酸的酸性判断元素非金属性强弱时,一定要用最高价氧化物对应水化物即最高价含氧酸的酸性强弱判断,H2SO3不是S的最高价含氧酸。
(2)酸性:HCl>H2S,所以非金属性:Cl>S( × )
提示:HCl、H2S均属于气态氢化物,只能用气态氢化物的稳定性来判断元素非金属性强弱,一定不能用其酸性来判断。
(3)同周期元素,从左到右,原子半径逐渐减小,离子半径也逐渐减小( × )
(4)元素的原子得电子越多,非金属性越强;失电子越多,金属性越强( × )
(5)金属M、N分别与氯气反应生成MCl、NCl2,可知M的金属性小于N的金属性( × )
提示:金属性强弱与失电子的多少无关,与失电子的难易程度有关。
(6)同主族元素含氧酸的酸性随核电荷数的增加而减弱( × )
提示:没有注明最高价,错误。
(7)Cl-、S2-、Ca2+、K+半径依次减小( × )
提示:核外电子排布相同的粒子,核电荷数越大半径越小,所以Ca2+半径最小,错误。
(8)第二周期元素从左到右,最高正价从+1递增到+7( × )
提示:第二周期元素中F元素无正价,O元素一般不显正价,错误。
(9)同主族元素的简单阴离子还原性越强,水解程度越大( × )
提示:第ⅦA族中Cl-、Br-、I-的还原性依次增强,但因三种阴离子对应的酸均为强酸,所以三种阴离子均不水解,错误。
(10)科学家发现一种新细菌的DNA链中有砷(As)元素,该As元素最有可能取代了普通DNA链中的P元素( √ )
提示:As与P在同一主族,性质相似,正确。
(11)第二周期非金属元素的气态氢化物溶于水后,水溶液均呈酸性( × )
(12)N和As属于第ⅤA族元素,N原子得电子能力比As原子强( √ )
(13)族序数等于其周期序数的元素一定是金属元素( × )
(14)元素周期表中,位于金属元素和非金属元素分界线附近的元素属于过渡元素( × )
(15)Si、S、Cl的最高价氧化物都能与水反应生成相应的酸,且酸性依次增强( × )
(16)原子的电子层数越多,半径越大( × )
2.问题思考:
(1)同主族从上到下,酸性:HF>HCl>HBr,这种比较方法正确吗?
__不正确。同主族从上到下,非金属性减弱,其最高价氧化物对应水化物的酸性减弱。酸性:HClO4>HBrO4,而氢化物的酸性:HF
H2CO3>HClO,能否说明非金属性:S>C>Cl?
__不能。因为硫的最高价氧化物对应的水化物是H2SO4不是H2SO3,氯的最高价氧化物对应的水化物是HClO4不是HClO。应根据元素的最高价氧化物对应的水化物的酸性强弱比较其非金属性强弱。__
(3)若A、B、C三种元素位于元素周期表中如下图所示位置,则有关的各种性质均可排出顺序(但D不能参与排列)。
①原子半径由大到小:__C>A>B__。
②金属性由强到弱:__C>A>B__。
③非金属性由强到弱:__B>A>C__。
1.(2019·齐鲁名校模拟)钾长石的主要成分为硅酸盐,由前20号元素中的四种组成,化学式为XYZ3W8。其中,只有W显负价。X、Y的最外层电子数之和与Z的最高正价数相等。Y3+与W的阴离子具有相同的电子层结构。X、W的质子数之和等于Y、Z的质子数之和。下列说法错误的是( D )
A.W的离子半径>Y的离子半径
B.Z的氢化物稳定性Si,元素的非金属性越强,对应的氢化物越稳定,故B项正确;Al2O3为两性氧化物,既能与盐酸反应,又能与NaOH溶液反应,故C项正确;K2O2、Al2O3两种化合物都为离子化合物,K2O2含有离子键和共价键,而Al2O3只含有离子键,故D项错误。
2.(2017·课标Ⅰ,12)
短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的。由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。下列说法不正确的是( C )
A.X的简单氢化物的热稳定性比W的强
B.Y的简单离子与X的具有相同的电子层结构
C.Y与Z形成化合物的水溶液可使蓝色石蕊试纸变红
D.Z与X属于同一主族,与Y属于同一周期
[解析] 本题考查元素推断和元素周期律。由题知,W为氮,X为氧,Y为钠,Z为硫。同周期元素从左至右,简单氢化物的热稳定性逐渐增强,H2O的热稳定性比NH3的强,A项正确;氧离子(O2-)和钠离子(Na+)核外都有10个电子,B项正确;钠和硫形成的化合物为硫化钠,它是强碱弱酸盐,其水溶液呈碱性,能使红色石蕊试纸变蓝色,不能使蓝色石蕊试纸变色,C项错误;氧、硫位于同主族,钠与硫位于第三周期,D项正确。
3.(2017·课标Ⅱ,9)
a,b,c,d为原子序数依次增大的短周期主族元素,a原子核外电子总数与b原子次外层的电子数相同;c所在周期数与族数相同;d与a同族,下列叙述正确的是( B )
A.原子半径:d>c>b>a
B.4种元素中b的金属性最强
C.c的氧化物的水化物是强碱
D.d单质的氧化性比a单质的氧化性强
[解析] 本题考查元素周期表和元素周期律。同周期主族元素从左到右,金属性逐渐减弱,即金属性:Na(或Mg)>Al,B项正确。原子半径:Na(或Mg)>Al>S>O,A项错误;Al2O3对应的水化物为Al(OH)3,Al(OH)3是两性氢氧化物,C项错误;同主族元素自上而下,非金属性逐渐减弱,则对应单质的氧化性逐渐减弱,即氧化性:O2>S,D项错误。
4.(2018·课标Ⅲ,13)
W、X、Y、Z均为短周期元素且原子序数依次增大,元素X和Z同族。盐YZW与浓盐酸反应,有黄绿色气体产生,此气体同冷烧碱溶液作用,可得到含YZW的溶液。下列说法正确的是( D )
A.原子半径大小为WMg,故错误。
萃取精华:
元素金属性和非金属性强弱的判断方法
6.(2019·山东滨州高三检测)X、Y、Z均为短周期元素,其中两种为金属元素,一种为非金属元素,其原子半径分别为
X
Y
Z
原子半径/nm
0.154
0.130
0.071
X、Y处于同一周期,三种元素形成的简单离子具有相同的电子层结构。下列说法正确的是( C )
A.原子最外层电子数:Z>X>Y B.三种元素可能为同周期元素
C.原子序数:Y>X>Z D.离子半径:X>Y>Z
[解析] X、Y、Z均为短周期元素,其中两种为金属元素,一种为非金属元素,结合原子半径及X、Y处于同一周期,三种元素形成的简单离子具有相同的电子层结构,则三种元素在周期表中相对位置为,最外层电子数Z>Y>X,故A、B错误;由位置可知,原子序数Y>X>Z,故C正确;具有相同电子层结构的离子,原子序数大的离子半径小,则离子半径Z>X>Y,故D错误。
7.(2019·天津静海一中等六校检测)已知X+、Y2+、Z-、W2-四种离子具有相同的电子层结构。下列关于X、Y、Z、W四种元素的描述,不正确的是( A )
A.金属性:X>Y,还原性:Z->W2-
B.原子半径:X>Y>W>Z
C.离子半径:Y2+X>Z>W
[解析] X+、Y2+、Z-、W2-四种离子均具有相同的电子层结构,则X、Y
处于同一周期,原子序数:Y>X;Z、W处于同一周期,且处于X、Y所在周期的上一周期,原子序数:Z>W,所以原子序数:Y>X>Z>W,由离子所带电荷可知,X、Y为金属元素,而Z、W为非金属元素。X、Y处于同一周期,原子序数:Y>X,所以金属性:X>Y;Z、W处于同一周期,原子序数:Z>W,所以非金属性:Z>W,元素非金属性越强,对应阴离子还原性越弱,所以还原性:W2->Z-,故A错误;Z、W处于同一周期,且处于X、Y所在周期的上一周期,原子序数:Y>X>Z>W,同周期元素原子序数越大,半径越小,所以原子半径:X>Y,W>Z,原子核外电子层数越多,半径越大,所以原子半径:X>Y>W>Z,故B、D正确;电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:Y2+r(Mg)>r(Al)>r(Si)>r(P)>r(S)>r(Cl);
②同主族元素从上到下,原子半径、离子半径逐渐增大,如第ⅦA族原子r(F)A>C>D__
原子半径:__A>B>D>C__
离子半径:__D2->C->A+>B2+__
(2)同周期元素的简单阳离子与阴离子相比,阴离子原子序数大。
7.熟记“序、价”规律。
在短周期元素中,元素的原子序数与其主要化合价的数值在奇偶性上一般一致,“价奇序奇,价偶序偶”。
特别提醒:常见元素及其化合物的特性
(1)形成化合物种类最多的元素或单质是自然界中硬度最大的物质的元素或简单气态氢化物中氢的质量分数最大的元素:C。
(2)空气中含量最多的元素或气态氢化物的水溶液呈碱性的元素:N。
(3)地壳中含量最多的元素或气态氢化物的沸点最高的元素或氢化物在通常情况下呈液态的元素:O。
(4)具有漂白性的物质:氯水、二氧化硫、过氧化钠、双氧水(H2O2水溶液)。
(5)最活泼的非金属元素或无正价的元素或无含氧酸的非金属元素或无氧酸(气态氢化物)可腐蚀玻璃的元素或气态氢化物最稳定的元素或阴离子的还原性最弱的元素:F。
(6)最活泼的金属元素或最高价氧化物对应水化物碱性最强的元素或阳离子的氧化性最弱的元素:Cs。
(7)单质密度最小的元素:H;密度最小的金属元素:Li。
(8)常温下单质呈液态的非金属元素:Br;单质呈液态的金属元素:Hg。
(9)最高价氧化物及其水化物既能与强酸反应,又能与强碱反应的元素:Al。
(10)元素的气态氢化物和它的最高价氧化物对应水化物起化合反应的元素:N;元素气态氢化物和它的最高价氧化物对应水化物发生氧化还原反应的元素:S。
(11)元素的单质在常温下能与水反应放出气体的短周期元素:Li、Na、F。
1.判断正误,正确的画“√”,错误的画“×”。
(1)Cl-、S2-、Ca2+、K+半径逐渐减小( × )
(2)电子层结构相同的粒子化学性质一定相同( × )
(3)第ⅥA族元素的原子,其半径越大,气态氢化物越稳定( × )
(4)同一周期元素的原子,半径越小越容易失电子( × )
(5)同主族元素,从上到下,单质的熔点逐渐降低( × )
(6)元素所在的主族序数与最外层电子数之比为1∶1的元素都是金属元素( × )
(7)原子序数为29的元素位于元素周期表的第四周期第ⅠB族( √ )
(8)俄罗斯专家首次合成了一个X原子,116号元素位于元素周期表中第七周期第ⅥA族( √ )
(9)最外层电子数等于或大于3(小于8)的一定是主族元素( √ )
(10)最外层有1个或2个电子,则可能是ⅠA、ⅡA族元素,也可能是副族元素或0族元素氦( √ )
(11)最外层电子数比次外层电子数多的元素一定位于第三周期( × )
(12)某元素阴离子最外层电子数与次外层电子数相同,该元素位于第三周期;若为阳离子,则位于第四周期( √ )
(13)位于第四周期第ⅡB族( √ )
(14)原子最外层电子数大于3(小于8)的元素一定是非金属元素( × )
(15)某元素的离子的最外层与次外层电子数相同,该元素一定位于第三周期( × )
2.下图为几种粒子的结构示意图,完成以下填空。
(1)写出上述各种粒子的符号:__F-、Ne、Mg2+、Na、Al3+、S2-、Si、Fe2+__。
(2)上述粒子能与盐酸反应的是__F-、Na、S2-__(填微粒符号,下同)。
(3)上述粒子能与NaOH溶液反应的是__Mg2+、Na、Al3+、Si、Fe2+__。
(4)上述粒子对应元素位于第三周期第ⅣA族的是__Si__。
3.已知aAn+、bB(n+1)+、cCn-、dD(n+1)-是具有相同的电子层结构的离子,关于A、B、C、D四种元素的叙述正确的是( B )
A.离子半径:A>B>C>D
B.原子序数:b>a>c>d
C.原子半径:D>C>B>A
D.四种元素一定属于短周期元素
[解析] 由于四种离子具有相同的电子层结构,可以推知四种元素在周期表中的位置关系如图:
……
D
C
A
B
……
原子序数b>a>c>d;具有相同电子层结构的离子,核电荷数越大,离子半径越小;原子半径A>B>D>C;A和B可以为第四周期元素。
1.(2018·课标Ⅰ,12)
主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。W、X、Z最外层电子数之和为10;W与Y同族;W与Z形成的化合物可与浓硫酸反应,其生成物可腐蚀玻璃。下列说法正确的是( B )
A.常温常压下X的单质为气态
B.Z的氢化物为离子化合物
C.Y和Z形成的化合物的水溶液呈碱性
D.W与Y具有相同的最高化合价
[解析] 可腐蚀玻璃的物质是HF。以此为切入点,根据题意进行元素推断,可知W是氟、X是钠、Y是氯、Z是钙。B对:钙是活泼金属元素,氢是非金属元素,CaH2是由Ca2+和H-构成的离子化合物。A错:常温常压下,钠的单质是固体。C错:CaCl2
是强酸强碱盐,水溶液呈中性。D错:氯有最高化合价+7,氟没有正价。
2.(2016·课标全国Ⅰ,13)短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物。n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01 mol·L-1r溶液的pH为2,s通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法正确的是( C )
A.原子半径的大小WX>Y
C.Y的氢化物常温常压下为液态
D.X的最高价氧化物的水化物为强酸
[解析] 短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,则n是氯气,Z是氯元素;0.01 mol·L-1 r溶液的pH为2,说明r是强酸,因此W是H;q的水溶液具有漂白性,s通常是难溶于水的混合物,根据转化关系图可知m是水,r是氯化氢,q是次氯酸,p是烷烃(如甲烷),因此X是碳元素,Y是氧元素。同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,则原子半径的大小:WX,B错误; Y的氢化物是水或双氧水,常温常压下为液态,C正确;X的最高价氧化物的水化物碳酸为弱酸,D错误。
3.(2019·山东滨州高三检测) X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素。其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图。下列说法正确的是( B )
A.五种元素中,原子半径最大的是W
B.Y与Z形成的化合物都可以和盐酸反应
C.简单阴离子的还原性:Y>W
D.Z与Q形成的化合物水溶液一定显酸性
[解析] 短周期主族元素,其中只有Z是金属,W的单质是黄色固体,则W为S,由X、Y、W在周期表中的相对位置可知,Y为O,X为C,X、Y、Z、W、Q原子序数依次增大,所以Q为Cl,而Z可能为Na、Mg、Al中的一种。五种元素中,原子半径最大的是
Z,故A错误;Y与Z形成的化合物为金属氧化物,都可以和盐酸反应,故B正确;单质的氧化性越弱,则对应离子的还原性越强,所以Y的简单阴离子比W的简单阴离子还原性弱,故C错误;若Z为Na,则Z与Q形成的化合物NaCl的水溶液为中性,故D错误。
4.(2017·课标Ⅲ,12)
短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。下列关系正确的是( D )
W
X
Y
Z
A.氢化物沸点:WW
C.化合物熔点:Y2X3N>C>Si,故气态氢化物的稳定性:H2O>NH3>SiH4,A项正确;H与C、N、O、F等非金属元素形成共价化合物,与Na、Mg等金属元素形成离子化合物,B项正确;图中所示实验可证明酸性:HCl>H2CO3>H2SiO3
,但元素非金属性的强弱与元素的最高价氧化物对应的水化物的酸性强弱有关,HCl不是氯元素的最高价氧化物对应的水化物,故不能根据其酸性强弱判断Cl的非金属性强弱,C项错误;118号元素在元素周期表中位于第七周期0族,D项正确。
[点拨] 由每一周期含有元素种类可推知元素的周期数,第一至七周期最多包含的元素种类分别是2、8、8、18、18、32、32,将元素种类依次相加可得该周期最后一列元素的原子序数,即该周期稀有气体元素的原子序数,再根据族的位置关系确定对应元素的位置。
6.(2016·天津,7)
下表为元素周期表的一部分。
碳
氮
Y
X
硫
Z
回答下列问题:
(1)Z元素在周期表中的位置为__第三周期,ⅦA族__。
(2)表中元素原子半径最大的是(写元素符号)__Si__。
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是__ac__
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1 mol Y单质比1 mol S得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成1 mol X的最高价化合物,恢复至室温,放热687 kJ,已知该化合物的熔、沸点分别为-69℃和58℃。写出该反应的热化学方程式:
Si(s)+2Cl2(g)===SiCl4(l) ΔH=-687 kJ·mol-1 。
(5)碳与镁形成的1 mol化合物Q与水反应,生成2 mol Mg(OH)2和1 mol烃,该烃分子中碳氢质量比为9∶1,烃的电子式为 。Q与水反应的化学方程式为 Mg2C3+4H2O===2Mg(OH)2+C3H4↑ 。
(6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由上表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1 L 2.2 mol·L-1NaOH溶液和1 mol O2,则两种气体的分子式及物质的量分别为__NO:0.9mol;NO2:1.3_mol__,生成硫酸铜物质的量为__2_mol__。
[解析] (1)观察周期表的结构可知,X、Y、Z分别是Si、O、Cl。氯元素位于元素周期表的第三周期、ⅦA族。(2)同周期主族元素从左到右,原子半径逐渐减小;同主族元素从上到下,原子半径逐渐增大。故表中元素原子半径最大的是Si。(3)O2能与H2S溶液反应生成单质硫:2H2S+O2===2S↓+2H2O,该反应中O2是氧化剂,S是氧化产物,说明O2的氧化性强于S,因此氧元素的非金属性强于硫元素,a项正确;非金属性强弱与得电子数目的多少无关,只与得电子能力的强弱有关,b项错误;H2O比H2S难分解,说明H2O
更稳定,气态氢化物越稳定的元素的非金属性越强,故c项正确。(4)生成物是四氯化硅,书写热化学方程式的关键是判断常温下四氯化硅的状态。根据其熔点和沸点数据,可推断出四氯化硅在常温下呈液态。据此可写出反应的热化学方程式。(5)碳氢质量比为9∶1,则C、H原子个数比为∶=3∶4,该烃的分子式为C3H4,是丙炔,结构简式为H—C≡C—CH3,据此可写出其电子式。根据“1 mol化合物Q与水反应,生成2 mol Mg(OH)2和1 mol烃”,可推断出Q的化学式为Mg2C3。(6)根据题意可知,生成的两种气体是NO和NO2。根据Na元素守恒可知,生成的NaNO3为2.2 mol。设生成NO和NO2的物质的量分别是x mol、y mol,由氮原子守恒得:z+y=2.2;由得失电子守恒得:3x+y=4。联立解得x=0.9、y=1.3。再由得失电子守恒得:n(Cu)×2=0.9 mol×3+1.3 mol×1,解得n(Cu)=2 mol,所以生成的硫酸铜为2 mol。
7.(2019·新题预测)X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大,元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数之比为3∶8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y的一种氧化物是红棕色气体。请回答:
(1)Q元素在元素周期表中的位置为__第3周期第ⅥA族__。
(2)Z、J两元素对应的简单离子的半径从大到小顺序为__O2->Na+__(填离子符号)。
(3)元素的非金属性:Z__>__Q(填“>”或“<”),下列各项中,不能说明这一结论的事实有__C__(填字母)。
A.Q的氢化物的水溶液放置在空气中会变浑浊
B.Z与Q之间形成的化合物中元素的化合价
C.Z和Q单质的状态
D.Z和Q在周期表中的位置
(4)Q的氢化物与Z的一种氢化物发生氧化还原反应的化学方程式为 H2O2+H2S===S↓+2H2O 。
(5)X与Y可形成分子A,也可形成阳离子B,A、B在水溶液中酸碱性恰好相反,写出A的电子式: ;B的水溶液不呈中性的原因: NH+H2ONH3·H2O+H+ (用离子方程式表示)。
(6)液态A类似X2Z,也能微弱电离且产生电子数相同的两种离子,则液态A的电离方程式为 2NH3NH+NH 。
[解析] 元素Z在地壳中含量最高,是O;J元素的焰色反应呈黄色,是Na;Q的最外层电子数与其电子总数之比为3∶8,即最外层电子数是6,Q是S;X能与J形成离子化合物,且J+的半径大于X-的半径,则X是H,不是F(Na+的半径小于F-的半径);Y
的一种氧化物是红棕色气体,则Y是N。
(1)S在元素周期表的第3周期第ⅥA族。
(2)Na+和O2-核外电子层结构相同,核电荷数越大,半径越小,故r(O2-)>r(Na+)。
(3)Q的氢化物的水溶液放置在空气中会变浑浊,即氧气置换出S,非金属性O>S,A不符合题意;根据O与S之间形成的化合物中S的化合价为正价知非金属性O>S,B不符合题意;不能根据氧气和S单质的状态判断非金属性强弱,C符合题意;同主族由上到下元素的非金属性逐渐减弱,即非金属性O>S,D不符合题意。
(4)硫化氢与过氧化氢可发生氧化还原反应:H2O2+H2S===S↓+2H2O。
(5)根据题意A是氨气,B是NH,NH水解使溶液呈酸性。
(6)液氨的电离类似水,电离生成NH、NH。
萃取精华:
元素推断的基本方法
(1)已知元素原子或离子的核外电子排布:
(2)已知元素单质或化合物的性质(特性):
要点速记:
1.牢记1~7周期的元素种类数:2、8、8、18、18、32、32。
2.掌握五个关系式:
(1)质子数=原子序数。
(2)电子层数=周期序数。
(3)最外层电子数=主族序数。
(4)最高正价=主族序数(O、F除外)。
(5)最低负价=主族序数-8(H除外)。
3.理解元素性质的两个递变规律:
(1)同周期(从左到右)
(2)同主族(从上到下)
4.微粒半径大小比较的“四同”:
(1)同周期 (2)同主族 (3)同电子层结构 (4)同一元素
5.强化金属性、非金属性强弱的比较方法:“三位置”“三反应”“两池”。
6.化合物类别的几个特例
AlCl3:由活泼金属元素与活泼非金属元素组成的共价化合物。
NaOH:含有极性键的离子化合物。
Na2O2:含有非极性键的离子化合物。
NH4NO3:全部由非金属元素形成的离子化合物。
7.元素推断题的解题思路