- 2021-07-05 发布 |
- 37.5 KB |
- 19页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届一轮复习人教版氮及其化合物学案
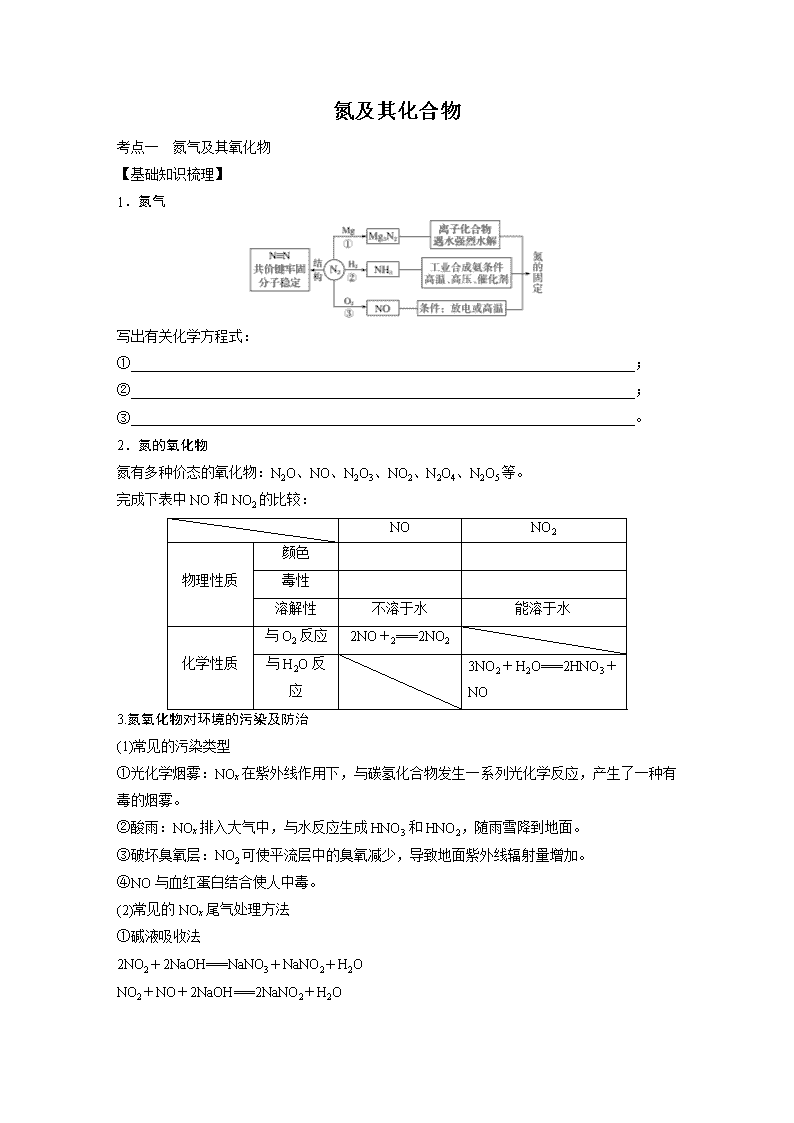
氮及其化合物 考点一 氮气及其氧化物 【基础知识梳理】 1.氮气 写出有关化学方程式: ①________________________________________________________________________; ②________________________________________________________________________; ③________________________________________________________________________。 2.氮的氧化物 氮有多种价态的氧化物:N2O、NO、N2O3、NO2、N2O4、N2O5等。 完成下表中NO和NO2的比较: NO NO2 物理性质 颜色 毒性 溶解性 不溶于水 能溶于水 化学性质 与O2反应 2NO+2===2NO2 与H2O反应 3NO2+H2O===2HNO3+NO 3.氮氧化物对环境的污染及防治 (1)常见的污染类型 ①光化学烟雾:NOx在紫外线作用下,与碳氢化合物发生一系列光化学反应,产生了一种有毒的烟雾。 ②酸雨:NOx排入大气中,与水反应生成HNO3和HNO2,随雨雪降到地面。 ③破坏臭氧层:NO2可使平流层中的臭氧减少,导致地面紫外线辐射量增加。 ④NO与血红蛋白结合使人中毒。 (2)常见的NOx尾气处理方法 ①碱液吸收法 2NO2+2NaOH===NaNO3+NaNO2+H2O NO2+NO+2NaOH===2NaNO2+H2O NO2、NO的混合气体能被足量烧碱溶液完全吸收的条件是n(NO2)≥n(NO)。一般适合工业尾气中NOx的处理。 ②催化转化法 在催化剂、加热条件下,氨可将氮氧化物转化为无毒气体(N2)或NOx与CO在一定温度下催化转化为无毒气体(N2和CO2)。一般适用于汽车尾气的处理。 深度思考 1.正误判断,正确的打“√”,错误的打“×” (1)豆科植物通过根瘤菌吸收空气中的氮属于氮的固定,是化学变化( ) (2)汽车尾气中的氮氧化合物是由游离态氮转化来的( ) (3)氮元素有负化合价,正化合价和零价,因而常温下,N2既能与氧气反应,又能与H2反应( ) (4)在实验室里,NO和NO2均用排水法收集( ) (5)可用NO2与水反应制取硝酸,故NO2是酸性氧化物( ) (6)通过灼热的镁粉,可除N2中的少量氧气( ) 2.俗话说“雷雨发庄稼”,这说明雷雨中含有能被植物吸收利用的化合态的氮。请写出三个有关的化学方程式: (1)________________________________________________________________________; (2)________________________________________________________________________; (3)________________________________________________________________________。 3.溴蒸气和NO2都为红棕色气体,用湿润的淀粉KI试纸或NaOH溶液能鉴别它们吗?为什么?若不能,请你设计一种简单的方法,区别溴蒸气和NO2。 ________________________________________________________________________ ________________________________________________________________________ ________________________________________________________________________ 【解题探究】 题组一 NO、NO2的性质及对环境的影响 1.Murad等三位教授提出NO在人体内有独特的功能,关于NO的叙述正确的是( ) ①NO可以是某些含低价氮物质氧化的产物 ②NO是亚硝酸的酸酐 ③NO可以是某些含高价氮物质还原的产物 ④NO是无色气体,在空气中可变为红棕色 A.全部 B.①③④ C.②③④ D.①④ 2.右图为装有活塞的密闭容器,内盛22.4 mL一氧化氮。若通入11.2 mL氧气(气体体积均在标准状况下测定),保持温度、压强不变,则容器内物质的密度为( ) A.等于1.369 g·L-1 B.等于2.054 g·L-1 C.在1.369 g·L-1和2.054 g·L-1之间 D.大于2.054 g·L-1 3.汽车尾气主要含有CO2、CO、SO2、NOx等物质,这种尾气逐渐成为城市空气污染的主要来源之一。 (1)汽车尾气中的CO来自于______________________,NO来自于______________________。汽车尾气对环境的危害主要有______________________(至少填两种)。 (2)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:____________________________。 (3)汽车尾气中的CO、NOx在适宜温度下采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。写出NO被CO还原的化学方程式:______________________________ ________________________________________________________________________________。 (4)用氨可将氮氧化物转化为无毒气体。已知:4NH3+6NO5N2+6H2O,8NH3+6NO27N2+12H2O。同温同压下,3.5 L NH3恰好将3.0 L NO和NO2的混合气体完全转化为N2,则原混合气体中NO和NO2的体积之比是________。 题组二 氮氧化物溶于水的定量判断 4.如图所示,试管中盛装的是红棕色气体(可能是混合物),当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中水柱继续上升,经过多次重复后,试管内完全被水充满。原来试管中盛装的( ) A.可能是N2与NO2的混合气体 B.可能是O2与NO2的混合气体 C.不可能是NO与NO2的混合气体 D.只能是NO2一种气体 5.在一定条件下,将NO2和O2的混合气体12 mL通入足量水中,充分反应后剩余2 mL气体(同温同压下),则原混合气体中氧气的体积为( ) ①1.2 mL ②2.4 mL ③3 mL ④4 mL A.①② B.②③ C.③④ D.①④ 6.(2016·湖南大学附中模拟)同温同压下,在3支相同体积的试管中分别充有等体积混合的2 种气体,它们是①NO和NO2,②NO2和O2,③NH3和N2。将3支试管均倒置于盛水的水槽中,充分反应后,试管中剩余气体的体积分别为V1、V2、V3,则下列的关系正确的是( ) A.V1>V2>V3 B.V1>V3>V2 C.V2>V3>V1 D.V3>V1>V2 【反思归纳】 解答氮氧化物溶于水的计算问题首先应明确原理 无论是单一气体(NO2),还是NO、NO2、O2中的两者或三者的混合气体,反应的实质是3NO2+H2O===2HNO3+NO,2NO+O2===2NO2,故若有气体剩余只能是NO或O2,不可能是NO2。 (1)若NO和O2通入水中,总关系式为4NO+3O2+2H2O===4HNO3。 (2)若NO2和O2通入水中,总关系式为4NO2+O2+2H2O===4HNO3。考点二 典型的氧化性考点二 硝酸 【基础知识梳理】 1.物理性质 硝酸是无色易挥发的液体,有刺激性气味。 2.化学性质 (1)不稳定性 反应:________________________________________________________________________。 (2)强氧化性 硝酸无论浓、稀都有强氧化性,而且浓度越大,氧化性越强。 按要求完成下列反应的方程式: ①与金属反应: 稀硝酸与铜反应: ________________________________________________________________________; 浓硝酸与铜反应: ________________________________________________________________________。 ②与非金属反应: 浓硝酸与C的反应: ________________________________________________________________________; ③与还原性化合物反应: 硝酸可氧化H2S、SO2、Na2SO3、HI、Fe2+等还原性物质。 稀硝酸与FeSO4溶液反应的离子方程式: ________________________________________________________________________。 (3)与有机物反应 ①硝化反应(与反应): ________________________________________________________________________; ②颜色反应:含有苯基的蛋白质遇到浓硝酸时变黄色。 特别提醒 (1)硝酸与金属反应的规律 ①HNO3与金属反应一般不能产生H2。 ②还原产物一般为HNO3(浓)→NO2,HNO3(稀)→NO;很稀的硝酸还原产物也可能为N2O、N2或NH4NO3。 ③硝酸与金属反应时既表现氧化性又表现酸性。 (2)涉及HNO3的离子反应常见的易错问题 ①忽视NO在酸性条件下的强氧化性。在酸性条件下NO不能与Fe2+、I-、SO、S2-等还原性较强的离子大量共存。 ②在书写离子方程式时,忽视HNO3的强氧化性,将氧化还原反应简单的写成复分解反应。 深度思考 1.正误判断,正确的打“√”,错误的打“×” (1)常温下,铁、铝在浓硝酸中的钝化为化学变化( ) (2)可用稀硝酸与FeS固体反应制取H2S( ) (3)过量的铜与浓硝酸反应,产物中一定有NO( ) (4)浓硝酸在光照下久置,会变黄( ) (5)浓硝酸中滴加紫色石蕊试液,最终变为红色( ) 2.久置的浓硝酸呈黄色,如何除去?怎样保存浓硝酸? ________________________________________________________________________ ________________________________________________________________________ ________________________________________________________________________ 【解题探究】 题组一 硝酸的基本性质及应用的判断 1.硝酸被称为“国防工业之母”是因为它是制取炸药的重要原料。下列实验事实与硝酸的性质不相对应的一组是( ) A.浓硝酸使紫色石蕊溶液先变红后褪色——酸性和强氧化性 B.不能用稀硝酸与锌反应制氢气——强氧化性 C.要用棕色瓶盛装浓硝酸——不稳定性 D.能使滴有酚酞的氢氧化钠溶液的红色褪去——强氧化性 2.将相同质量的铜分别与足量的浓硝酸、稀硝酸反应,下列叙述正确的是( ) A.硝酸浓度越大消耗的硝酸越少,产生的有毒气体也越少 B.反应中转移的电子总数稀硝酸少 C.试管内壁上的铜用浓硝酸除好,因反应速率快 D.两者用排水法收集的气体的体积相同 题组二 硝酸与金属反应的定量判断 3.锌与某浓度的硝酸以物质的量之比为1∶3发生反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,下列说法正确的是( ) A.在此反应中硝酸体现强氧化性,全部被还原 B.向反应后的溶液中再加入金属铁,不再发生化学反应 C.该反应中被还原的硝酸与未被还原的硝酸之比为1∶4 D.该反应中被还原的硝酸与未被还原的硝酸之比为1∶5 4.(2016·张家口高三模拟)某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6 g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体)。下列分析或结果错误的是( ) A.原混合酸中NO物质的量为0.1 mol B.OA段产生的是NO,AB段的反应为Fe+2Fe3+===3Fe2+,BC段产生氢气 C.第二份溶液中最终溶质为FeSO4 D.H2SO4浓度为2.5 mol·L-1 5.将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答下列问题: (1)NO的体积为________ L,NO2的体积为________ L。 (2)参加反应的HNO3的物质的量是_______________________________________________。 (3)待产生的气体全部释放后,向溶液中加入V mL a mol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为_______________________________mol·L-1。 (4)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水___________________________g。 【反思归纳】 1.金属与硝酸反应的思维模型 2.金属与硝酸反应计算的四种方法 (1)原子守恒法 HNO3与金属反应时,一部分HNO3起酸的作用,以NO的形式存在于溶液中;一部分作为氧化剂转化为还原产物,这两部分中氮原子的总物质的量等于反应消耗的HNO3中氮原子的物质的量。 (2)得失电子守恒法 HNO3与金属的反应属于氧化还原反应,HNO3中氮原子得电子的物质的量等于金属失电子的物质的量。 (3)电荷守恒法 HNO3过量时反应后溶液中(不考虑OH-)则有: c(NO)=c(H+)+nc(Mn+)(Mn+代表金属离子)。 (4)离子方程式计算法 金属与H2SO4、HNO3的混合酸反应时,由于硝酸盐中NO在H2SO4提供H+的条件下能继续与金属反应,因此此类题目应用离子方程式来计算,先作过量判断,然后根据完全反应的金属或H+或NO进行相关计算,且溶液中要符合电荷守恒。 题组三 硝酸的性质实验现象的描述 6.某实验过程如图所示:则图③的试管中的现象是( ) A.无明显现象,因稀H2SO4不与铜反应 B.铜片溶解,产生无色气体,该气体遇到空气不变色 C.铜片溶解,放出红棕色有刺激性气味的气体 D.铜片溶解,产生无色气体,该气体在试管口变为红棕色 7.在如图所示的实验装置中,盛有足量水的水槽里放两个烧杯, 小烧杯里放有适量铜片和过量浓硝酸,小烧杯外面倒扣一大烧杯,请回答下列问题: (1)实验过程中,观察到的主要现象是 ①________________________________________________________________________; ②________________________________________________________________________; ③________________________________________________________________________; ④________________________________________________________________________。 (2)用该装置做铜与浓硝酸反应的实验,最突出的优点是 ________________________________________________________________________。 (3)若要验证最终得到的气体生成物,最简便的操作及现象是____________________ ________________________________________________________________________。 现象描述答题模板 (1)全面描述现象的程序——“海、陆、空” “海”——溶液有什么变化; “陆”——固体有什么变化; “空”——气体有什么变化。 (2)规范描述现象的答题模板 如①颜色:……由……(具体颜色)变为……(具体颜色); ②气体:溶液中产生……(颜色)的气泡,(或)在固体表面产生……(颜色)气泡; ③沉淀:在……(颜色)溶液中产生……(颜色)的沉淀(浑浊)。 考点三 氨 铵盐 【基础知识梳理】 1.氨的分子结构和物理性质 电子式 密度 气味 水溶性 比空气____ 强烈____性气味 极易溶于水 (1∶700) 2.氨的化学性质 (1)氨气与水的反应 NH3+H2ONH3·H2ONH+OH-,氨气溶于水得氨水,氨水中含有的粒子有 ________________________________________________________________________ ________________________________________________________________________。氨水为可溶性一元弱碱, 易挥发,不稳定,易分解:NH3·H2O_____________________________________________。 (2)氨气与酸的反应 蘸有浓盐酸的玻璃棒与蘸有浓氨水的玻璃棒靠近,其现象为 ________________________________________________________________________, 将浓盐酸改为_________________________________________,也会出现相同的现象。 化学方程式:_____________________________________________________________ ________________________________________________________________________。 (3)与盐溶液的反应 如过量氨水与AlCl3反应的离子方程式: ________________________________________________________________________。 (4)氨气的还原性——氨的催化氧化 化学方程式:____________________________________________________________。 3.氨气的实验室制法 4.铵盐及NH的检验 (1)铵盐的物理性质 铵盐都是________色固体,均易溶于水。 (2)铵盐的化学性质 (3)NH的检验 未知液呈碱性湿润的________色石蕊试纸变________色,则证明含NH。 深度思考 1.正误判断,正确的打“√”,错误的打“×” (1)氨气溶于水能导电,所以氨气是电解质( ) (2)实验室可用浓氨水与生石灰制取氨气( ) (3)氨气的还原性可以解释氨气与氯化氢的反应实验( ) (4)实验室制取氨气的方法是加热分解氯化铵( ) (5)铵盐加热都易分解,产生氨气( ) (6)氨水中含氮微粒中最多的微粒是NH( ) (7)铵盐都易溶于水,其水溶液均呈酸性( ) 2.(1)现有1 mol·L-1的氨水,则该溶液中NH3·H2O浓度是1 mol·L-1吗?为什么? ________________________________________________________________________ ________________________________________________________________________ (2)为什么蘸有浓氨水和浓盐酸的两支玻璃棒靠近时会产生白烟?蘸有浓氨水和浓硫酸的两支玻璃棒靠近时是否也产生白烟? ________________________________________________________________________ ________________________________________________________________________ ________________________________________________________________________ 3.固态NH4Cl受热变成气体,气体遇冷又变为固态NH4Cl;固态碘受热变成蒸气,蒸气遇冷又变成固态碘。这两种现象的本质是否相同?请说明判断的理由。 ________________________________________________________________________ ________________________________________________________________________ 【解题探究】 题组一 氨气 铵盐的性质实验 1.探究氨气及铵盐性质的过程中,下列根据实验现象得出的结论不正确的是( ) A.将集有氨气的试管倒扣于水槽中,液体迅速充满试管,说明氨气极易溶于水 B.向氨水中加入浓氢氧化钠溶液,加热产生使湿润的红色石蕊试纸变蓝的气体,说明氨水中含有NH C.加热NH4HCO3固体,观察到固体逐渐减少,试管口有液滴产生,说明NH4HCO3具有热不稳定性 D.将红热的Pt丝伸入上图所示的锥形瓶中,瓶口出现少量的红棕色气体,说明氨气催化氧化的产物中有NO 2.如下图,利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是( ) 选项 实验现象 解释 A 浓盐酸附近产生白烟 NH3与浓盐酸反应产生了NH4Cl固体 B 浓硫酸附近无明显现象 NH3与浓硫酸不发生反应 C 氯化物溶液变浑浊 该溶液一定是AlCl3溶液 D 干燥红色石蕊试纸不变色,湿润红色石蕊试纸变蓝 NH3是一种可溶性碱 题组二 氨气的制法 3.下面是实验室制取氨气的装置和选用的试剂,其中错误的是( ) A.①② B.②③ C.③④ D.①③ 4.NH3及其盐都是重要的化工原料。 (1)用NH4Cl和Ca(OH)2制备NH3,反应发生、气体收集和尾气处理装置依次为________。 (2)按下图装置进行NH3性质实验。 ①先打开旋塞1,B瓶中的现象是________________________________________________, 原因是________________________________________________________________________ ________________________________________________________________________。稳定后,关闭旋塞1。 ②再打开旋塞2,B瓶中的现象是__________________________________________________ ________________________________________________________________________。 【反思归纳】 实验室制取氨气的简易方法 方法 化学方程式(或原理) 发生装置 加热浓氨水 NH3·H2O NH3↑+H2O 浓氨水+固体NaOH NaOH溶于水放热,促使氨水分解,且OH-浓度的增大有利于NH3的生成 浓氨水+固体CaO CaO与水反应,使溶剂(水)减少;反应放热,促使氨水分解。化学方程式 NH3·H2O+CaO=== NH3↑+Ca(OH)2 考点四 氮及其重要化合物的综合应用 【基础知识梳理】 注意 箭头指出可体现物质的性质,指向可寻找该物质的制备方法。 【解题探究】 题组一 氮及其化合物的转化 1.NH3是一种重要的化工原料,可以制备一系列物质(如图)。下列有关表述正确的是( ) A.NH4Cl和NaHCO3都是常用的化肥 B.NH4Cl、HNO3和Na2CO3受热时都易分解 C.NH3和NO2在一定条件下可发生氧化还原反应 D.图中所涉及的盐类物质均可以水解 2.在下列物质转化中,A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是酸,当X无论是强酸还是强碱时,都有如下的转化关系: 当X是强酸时,A、B、C、D、E均含同一种元素;当X是强碱时,A、B、C、D、E 均含另外同一种元素。请回答: (1)A是________,Y是________,Z是________。 (2)当X是强酸时,E是________,写出B生成C的化学方程式: ________________________________________________________________________。 (3)当X是强碱时,E是________,写出B生成C的化学方程式: ________________________________________________________________________。 题组二 含氮物质的性质与实验综合 3.实验室模拟合成氨和氨催化氧化的流程如下: 已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。 (1)从图中选择制取气体的合适装置:氮气____________________________________、 氢气______________。 (2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有________________、________________________________________________________________________。 (3)氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨,____________(填“会”或“不会”)发生倒吸,原因是______________________________________________________。 (4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是_____________________________________________________, 锥形瓶中还可观察到的现象是___________________________________________________。 (5)写出乙装置中氨氧化的化学方程式:___________________________________________ _____________________________________________________________________________。 (6)反应结束后锥形瓶内的溶液中含有的离子为H+、OH-、________、________。 【反思归纳】 1.有关氮及其重要化合物的推断题常以“产生白烟、红棕色气体、无色气体在空气中变为红棕色、能使湿润红色石蕊试纸变为蓝色”等特殊现象为突破口。 2.不同价态的含氮物质的转化 (1)歧化——同一元素的化合价在同一反应中既升高又降低。 如:3NO2+H2O===2HNO3+NO 2NO2+2NaOH===NaNO3+NaNO2+H2O (2)归中:6NO+4NH35N2+6H2O NO2+NO+2NaOH===2NaNO2+H2O (3)含氮物质的连续氧化 NH3NONO2HNO3 N2NONO2HNO3 答案精析 考点一 基础知识梳理 1.①3Mg+N2Mg3N2 ②N2+3H22NH3 ③N2+O22NO 2.(从左到右,从上到下)无色 红棕色 有毒 有毒 深度思考 1.(1)√ (2)√ (3)× (4)× (5)× (6)× 解析 (3)N2在放电条件下才能与O2反应;在高温高压、催化剂条件下才能与H2化合生成NH3。(4)NO2可与水反应生成HNO3和NO。(6)3Mg+N2Mg3N2 2.(1)N2+O22NO (2)2NO+O2===2NO2 (3)3NO2+H2O===2HNO3+NO 3.不能鉴别。因为这两种气体都有氧化性,都可以把KI中的I-氧化成I2,使试纸变蓝色。NaOH溶液可以吸收溴蒸气和NO2而形成无色溶液。方法:①用AgNO3溶液,Br2可与AgNO3溶液反应生成浅黄色沉淀AgBr;②用水,溶于水后有颜色的是Br2,无颜色的是NO2。 解题探究 1.B 2.D 3.(1)汽油的不完全燃烧 N2与O2在汽车汽缸内的高温环境下的反应 形成硝酸型酸雨、导致光化学烟雾、产生温室效应(任填两种即可) (2)3NO2+H2O===2HNO3+NO (3)2CO+2NON2+2CO2 (4)1∶3 4.B [若是N2与NO2的混合气体,无论鼓入多少氧气,最后都有N2剩余,试管内不可能完全被水充满;若是O2与NO2的混合气体,由4NO2+O2+2H2O===4HNO3,可知,当>4时,NO2有剩余,剩余的NO2和水反应产生NO,故试管内水面上升,但不能充满试管,当向试管内不断鼓入氧气后,4NO+3O2+2H2O===4HNO3,故试管能被水充满;若是NO与NO2的混合气体,开始时,3NO2+H2O===2HNO3+NO,气体体积减小,但有NO剩余,当向试管内不断鼓入适量的氧气后,4NO+3O2+2H2O===4HNO3,试管内的气体完全被水吸收。] 5.D [首先分析剩余的2 mL气体有两种可能。如果剩余2 mL O2,则V(NO2)=×(12-2) mL=8 mL,则混合气中:V(O2)=12 mL-8 mL=4 mL。若剩余的2 mL气体是NO,则混合气中的V(O2)=(12 mL-2 mL×3)×=1.2 mL,D项正确。] 6.B [设各种气体的体积都为1体积。①根据3NO2+H2O===2HNO3+NO,即剩余NO的体积V1=(1+)体积。②根据4NO2+O2+2H2O===4HNO3,即剩余O2的体积V2=(1-)体积。③剩余N2的体积V3=1体积。即B项符合题意。] 考点二 基础知识梳理 2.(1)4HNO3(浓)△或光照,2H2O+4NO2↑+O2↑ (2)①3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O ②C+4HNO3(浓)CO2↑+4NO2↑+2H2O ③3Fe2++4H++NO===3Fe3++NO↑+2H2O (3)①+HNO3+H2O 深度思考 1.(1)√ (2)× (3)√ (4)√ (5)× 解析 (2)稀硝酸具有强氧化性,可氧化H2S。(3)浓硝酸与Cu反应,逐渐变为稀硝酸,因而会产生NO。(5)浓硝酸具有酸性和强氧化性,可使石蕊试液先变红后褪色。 2.浓硝酸显黄色是由于浓硝酸见光或受热发生分解,生成的NO2溶于浓硝酸所致,所以消除的方法是通入O2(或空气),使其发生反应4NO2+O2+2H2O===4HNO3。保存时应保存在棕色试剂瓶中,并置于阴凉处。 解题探究 1.D 2.D 3.D 4.A [铁粉既能与硝酸反应也能与硫酸反应,从题干图中看出(注意只是第二份100 mL)OA段产生的是NO,AB段的反应为Fe+2Fe3+===3Fe2+,BC段产生氢气,反应为Fe+2H+===Fe2++H2↑,可知NO反应完全,第二份中NO应为×3÷3=0.1 mol,溶液中最终溶质为FeSO4,此时反应的铁的质量是14 g,即0.25 mol,故原混合酸中H2SO4浓度为=2.5 mol·L-1,NO物质的量为0.2 mol。所以选A。] 5.(1)5.824 5.376 (2)1.52 mol (3) (4)57.8 解析 (1)n(Cu)==0.51 mol,设混合气体中NO的物质的量为x,NO2的物质的量为y。 根据气体的总体积为11.2 L,有:x+y=0.5 mol。 根据得失电子守恒,有:3x+y=(0.51×2) mol。 解方程组得:x=0.26 mol,y=0.24 mol。 则:V(NO)=0.26 mol×22.4 L·mol-1=5.824 L V(NO2)=11.2 L-5.824 L=5.376 L。 (2)参加反应的HNO3分两部分:一部分没有被还原,显酸性,生成Cu(NO3)2;另一部分被还原成NO2和NO,所以参加反应的HNO3的物质的量为0.51 mol×2+0.5 mol=1.52 mol。 (3)HNO3在反应中一部分变成气体,一部分以NO的形式留在溶液中。变成气体的HNO3的物质的量为0.5 mol。 加入NaOH溶液至正好使溶液中Cu2+全部转化为沉淀,则溶液中只有NaNO3,其物质的量为10-3aV mol,也就是以NO形式留在溶液中的HNO3的物质的量为10-3aV mol。 所以,c(HNO3)= mol·L-1。 (4)由得失电子守恒得:2×n(Cu)=2×n(H2O2),×2=n(H2O2)×2,n(H2O2)=0.51 mol,则m(H2O2)=17.34 g。需30%的双氧水:17.34 g÷30%=57.8 g。 6.D [生成的Cu(NO3)2在H2SO4的酸性条件下相当于又有了HNO3,铜片会继续溶解生成NO。] 7.(1)①铜片表面产生气泡,铜片慢慢溶解并逐渐消失 ②小烧杯中溶液的颜色逐渐变成蓝色 ③大烧杯中有红棕色气体生成,后来慢慢变成无色 ④大烧杯内液面上升,水槽中液面下降 (2)反应体系封闭,无氮氧化合物逸出,不污染环境 (3)轻轻掀起倒扣的大烧杯,通入适量的空气,若有红棕色气体生成,则证明最终气体生成物为NO气体 考点三 基础知识梳理 1. 小 刺激 2.(1)NH3·H2O、NH3、H2O、NH、OH-、H+ NH3↑+H2O (2)有白烟生成 浓硝酸 HCl+NH3===NH4Cl、NH3+HNO3===NH4NO3 (3)Al3++3NH3·H2O===Al(OH)3↓+3NH (4)4NH3+5O24NO+6H2O 4.(1)白 (2)NH4ClNH3↑+HCl↑ NH4HCO3NH3↑+CO2↑+H2O NH+OH-NH3↑+H2O (3)红 蓝 深度思考 1.(1)× (2)√ (3)× (4)× (5)× (6)× (7)× 解析 (7)NH4HCO3、(NH4)2S溶液呈碱性。 2.(1)不是。溶液中NH3、NH、NH3·H2O的浓度和为1 mol·L-1。 (2)浓氨水和浓盐酸均有挥发性,挥发出来的NH3和HCl在空气中相遇,反应生成NH4Cl固体小颗粒,即为白烟。浓硫酸没有挥发性,故不可能形成白烟。 3.不相同。NH4Cl固体受热分解生成NH3和HCl,发生了化学变化;固态碘受热升华成为碘蒸气,是物理变化。 解题探究 1.B 2.A 3.D [NH4Cl受热可产生NH3和HCl,但两者遇冷会重新发生化合反应生成NH4Cl,且可能出现堵塞导管的情况;③中试管口未向下倾斜会导致水倒流入试管底部而使试管破裂,故①③错误。把浓氨水滴入氧化钙固体中,会发生反应CaO+NH3·H2O===Ca(OH)2+NH3↑,反应放热,温度升高有利于NH3放出,故可用②的方法制取氨气;浓氨水受热产生氨气,通过碱石灰吸收水蒸气后即得到干燥的NH3,④符合要求。] 4.(1)ACG (2)①有白烟出现 因A瓶中HCl气体压强大,所以HCl进入B瓶,与NH3发生反应,生成白色NH4Cl固体颗粒 ②石蕊水溶液进入B瓶,且溶液显红色 考点四 解题探究 1.C [NaHCO3不能用作肥料,A项错误;Na2CO3很稳定,受热时不易分解,B项错误;图中的NaCl是强酸强碱盐,不水解,D项错误。] 2.(1)(NH4)2S O2 H2O (2)H2SO4 2H2S+3O22SO2+2H2O (3)HNO3 4NH3+5O24NO+6H2O 解析 本题考查氮、硫及其化合物的转化关系。由D的相对分子质量比C的相对分子质量大16,容易联想D比C增加1个氧原子,则D可能是氧化物,而E为酸,则应为含氧酸,而Y是能提供“O”的物质,A为正盐,与碱反应放出的物质能连续两次氧化最后得一含氧酸,可推知A可能是铵盐:ANH3NONO2HNO3,而A与强酸反应时,生成的物质也会连续氧化两次,最后生成含氧酸,则A可能为硫化物(含S2-):AH2SSO2SO3H2SO4,综上所述可确定A是(NH4)2S。 3.(1)a b (2)干燥气体 控制氢气和氮气的流速 (3)不会 混合气体中含有大量难溶于水的氮气、氢气 (4)氨的氧化反应是一个放热反应 有红棕色气体产生 (5)4NH3+5O24NO+6H2O (6)NH NO查看更多